光动力疗法对人小细胞肺癌H446细胞杀伤效应
廖洁梅,肖宝红,郭彩宏,巩秀珍,程兆忠,林存智
(青岛大学,山东 青岛 266003 1 附属医院呼吸与危重症医学科; 2 医学院松山医院综合内科)
肺癌是全球发病率及死亡率均居首位的恶性肿瘤,是癌症病人死亡的主要原因[1]。肺癌按照其病理类型可以分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两大类,其中SCLC约占所有肺癌的15%[2]。SCLC恶性程度高、侵袭性强,早期即可出现血行转移,未进行任何积极治疗的病人,其5年生存率低于5%,平均总生存期仅为2~4个月[3-4]。多数SCLC病人在确诊时已是晚期,失去了手术治疗的最佳时机,放化疗成为主要治疗手段。尽管SCLC对放化疗敏感,但经过一段时间的治疗后部分病人会出现耐药及肿瘤的扩散,伴随着不可避免的严重副作用[5]。血卟啉衍生物(HPD)介导的光动力疗法(PDT)是一种温和、相对安全的局部治疗方法,因具有可选择性杀伤肿瘤细胞、创伤小等特点,PDT在癌症精准治疗方面展现了独特的治疗优势,是目前恶性肿瘤辅助治疗的新方法。研究表明,PDT对皮肤肿瘤、头颈部肿瘤、基底细胞癌、乳癌、前列腺癌、结肠癌、膀胱癌等均有治疗作用[6-9]。但目前关于PDT对SCLC作用的研究甚少,其效果及机制需要进一步的研究,且SCLC的总体生存率低,探索新的治疗方法显得尤为重要。本实验旨在探讨不同光敏剂浓度及不同功率密度的630 nm激光照射对人SCLC H446细胞的体外杀伤效应及其作用机制,以期为肺癌的临床治疗提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1细胞株与主要试剂 人SCLC H446细胞,购自武汉普诺赛生命科技有限公司。HPD购自重庆华鼎现代生物制药公司,细胞培养液DMEM购自美国Hyclone公司,胎牛血清购自以色列Biolo-gical Industries公司,CCK8试剂盒购自美国MedChemExpress公司,逆转录试剂盒、SYBR Green荧光定量试剂盒均购自日本TaKaRa公司,Hoechst 33258染色液购自北京索莱宝科技有限公司,AnnexinV-FITC和PI凋亡检测试剂盒购自上海爱必信生物有限公司。
1.1.2仪器 实验所用的LED-IB光动力治疗仪,由武汉亚格光电技术有限公司生产,输出波长为红光(633±10)nm、蓝光(417±10)nm、黄光(590±10)nm,输出功率密度为红光20~100 mW/cm2、蓝光25~120 mW/cm2、黄光10~40 mW/cm2,工作方式为连续或脉冲。
1.2 实验方法
1.2.1细胞培养 H446细胞常规用含100 kU/L青霉素和0.1 g/L链霉素混合液、体积分数0.10灭活胎牛血清的DMEM培养液,在37 ℃、含体积分数0.05 CO2、饱和湿度培养箱中培养,每天更换1次培养液,待细胞密度增长至70%~80%时,常规传代培养,取对数生长期的细胞用于实验。
1.2.2CCK8法检测细胞活力 将H446细胞接种于5块96孔板中,每组设置3个复孔,培养至贴壁后进行实验。分别加入HPD浓度为0、5、10、12、15、20 mg/L的培养液避光培养4 h后更换含体积分数0.10胎牛血清的培养液,分别给予0、25、50、75、100 mW/cm2功率密度的630 nm激光垂直照射2 min,垂直距离9 cm,光斑直径9 cm。培养24 h后弃培养液,加入100 μL含体积分数0.10 CCK8的培养液继续培养。用自动酶标仪于450 nm波长处检测各组细胞吸光度(A)值,计算细胞活力:细胞活力=(A实验组-A空白组)/(A对照组-A空白组)×100%。实验重复3次。
1.2.3流式细胞术检测细胞凋亡 选取CCK8实验中筛选出来的最佳HPD-PDT参数进行后续实验。实验设空白对照组(无光敏剂,无激光照射)、单纯光敏剂组(光敏剂浓度为15 mg/L,无激光照射)、单纯光照组(无光敏剂,激光功率密度为50 mW/cm2)和HPD-PDT组(光敏剂浓度为15 mg/L,激光功率密度为50 mW/cm2)。经上述处理24 h后收集细胞,调整至密度为109/L,离心后以PBS洗2次,加入500 μL Binding buffer重悬细胞,按要求依次加入AnnexinV-FITC和PI染色剂各5 μL,室温避光孵育5~15 min,应用流式细胞仪检测细胞凋亡率。实验重复3次。
1.2.4Hoechst 33258染色检测细胞凋亡 取洁净细胞爬片,用体积分数0.75乙醇浸泡10 min、PBS洗3次、培养液洗1次后置于12孔板内,接种H446细胞后培养过夜。细胞贴壁后随机分为空白对照组(无光敏剂,无激光照射)、单纯光敏剂组(光敏剂浓度为15 mg/L,无激光照射)、单纯光照组(无光敏剂,激光功率密度为50 mW/cm2)和HPD-PDT组(光敏剂浓度为0、5、10、12、15、20 mg/L,激光功率密度为50 mW/cm2)。进行相应处理避光培养24 h后弃培养液,每孔加入0.5 mL固定液,15 min后弃固定液并用PBS洗3次,每孔加入0.5 mL Hoechst 33258染色液染色5 min,弃染色液,以PBS洗3次,将一滴抗荧光猝灭剂滴在载玻片上,盖上染色好的细胞爬片,室温避光孵育15 min后于倒置荧光显微镜下观察并拍照。
1.2.5实时荧光定量PCR(RT-PCR)检测Bax、Bcl-2、Caspase-9mRNA的表达水平 分组及处理方法同1.2.4。处理24 h后每孔加入TRIzol 1 mL,静置5 min 后转移到1.5 mL EP管中,加入三氯甲烷0.2 mL,振荡混匀后离心;吸取上清至新的EP管中,加入与其等量的异丙醇;离心后弃上清,加入无水乙醇0.5 mL;离心后弃乙醇,检测所提取的RNA浓度。按照TaKaRa反转录试剂盒说明书操作获得cDNA,根据SYBR Green荧光定量试剂盒说明以此cDNA为模板进行目的片段扩增,计算各组基因相对表达量。
1.3 统计学方法
2 结 果
2.1 HPD-PDT对H446细胞活力的影响
不同HPD浓度和光照强度下各组细胞存活率比较,光敏剂浓度(F=1 269.533,P<0.001)和激光功率密度(F=1 229.600,P<0.001)主效应均有统计学意义,且二者存在交互效应(F=78.430,P<0.001)。单独给予光敏剂或者激光照射对H446细胞无明显杀伤作用;HPD-PDT对H446细胞杀伤效应随着光敏剂浓度的增加和激光功率密度的增大而增大,当激光功率密度为50、75、100 mW/cm2以及光敏剂浓度为15、20 mg/L时,细胞存活率明显下降,差异具有统计学意义(F=663.385~807.743,P<0.001)。当激光功率密度为50 mW/cm2、HPD浓度为15 mg/L时,HPD-PDT对细胞的杀伤效应明显,再增加激光功率密度或者光敏剂浓度细胞存活率无显著变化(t=0.480~1.946,P>0.05)。因此,选取激光功率密度为50 mW/cm2和HPD浓度为15 mg/L进行后续实验。见图1。
2.2 HPD-PDT对H446细胞凋亡的影响
流式细胞术检测显示,空白对照组、单纯光敏剂组、单纯光照组和HPD-PDT组的细胞凋亡率分别为(8.60±1.22)%、(11.99±0.21)%、(10.17±0.58)%和(59.67±2.36)%,4组整体比较差异具有统计学意义(F=2 073.518,P<0.001),HPD-PDT组与空白对照组、单纯光敏剂组和单纯光照组相比细胞凋亡率明显增加,差异均具有统计学意义(t=62.612~65.612,P<0.001)。Hoechst 33258染色显示,空白对照组、单纯光敏剂组和单纯光照组无明显细胞凋亡,HPD-PDT组可见凋亡细胞染色质固缩,细胞核致密浓染,随着光敏剂浓度的增加,凋亡细胞增多且细胞密度降低。见图2、3。
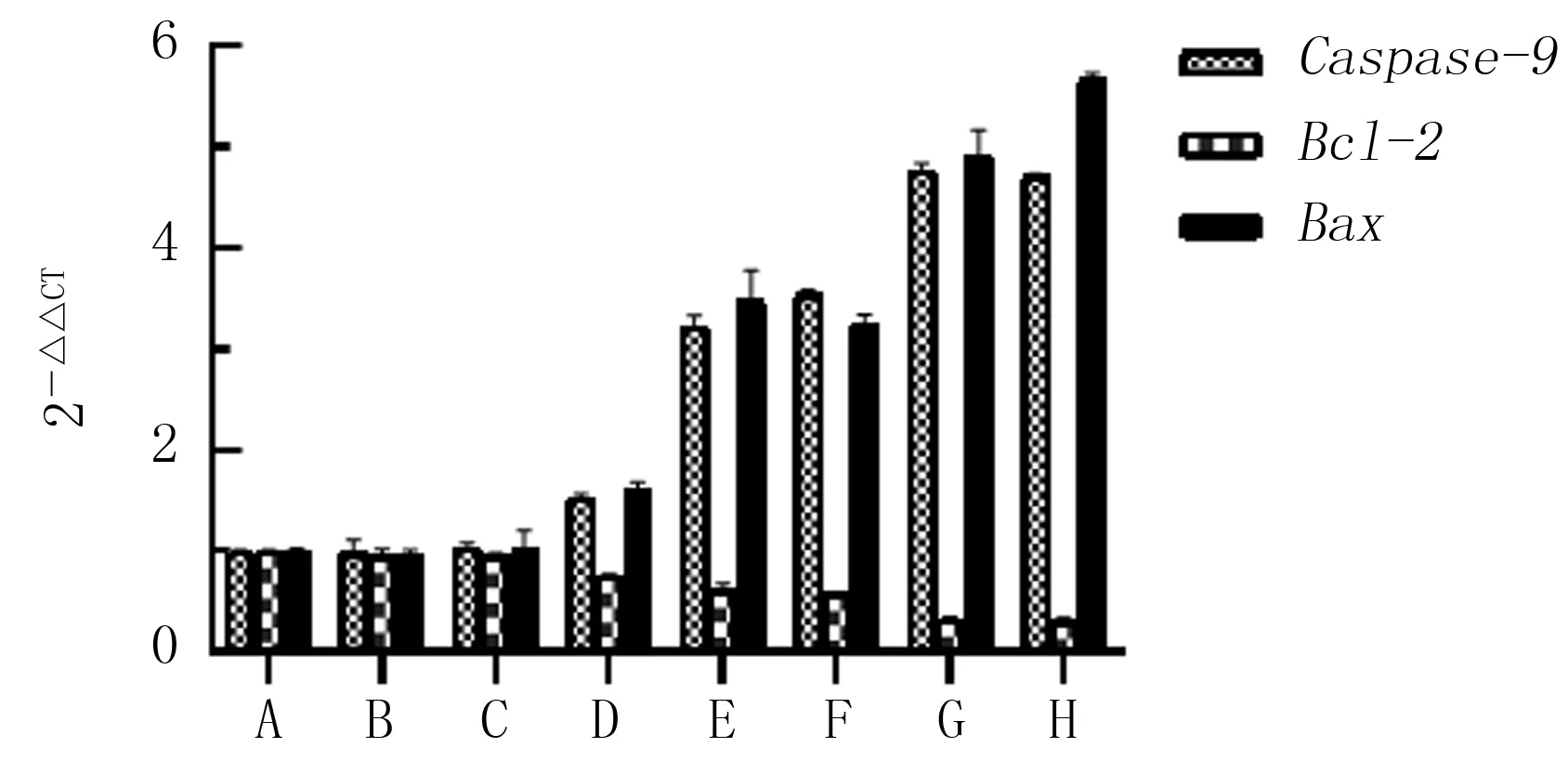
2.3 HPD-PDT对H446细胞Caspase-9、Bax及Bcl-2 mRNA表达的影响
RT-PCR检测结果显示,与各对照组相比较,HPD-PDT组H446细胞的Bax、Caspase-9mRNA的表达水平明显上调(F=445.426、1 765.177,P<0.05),而Bcl-2mRNA表达水平则明显下调(F=171.193,P<0.05)。见图4。
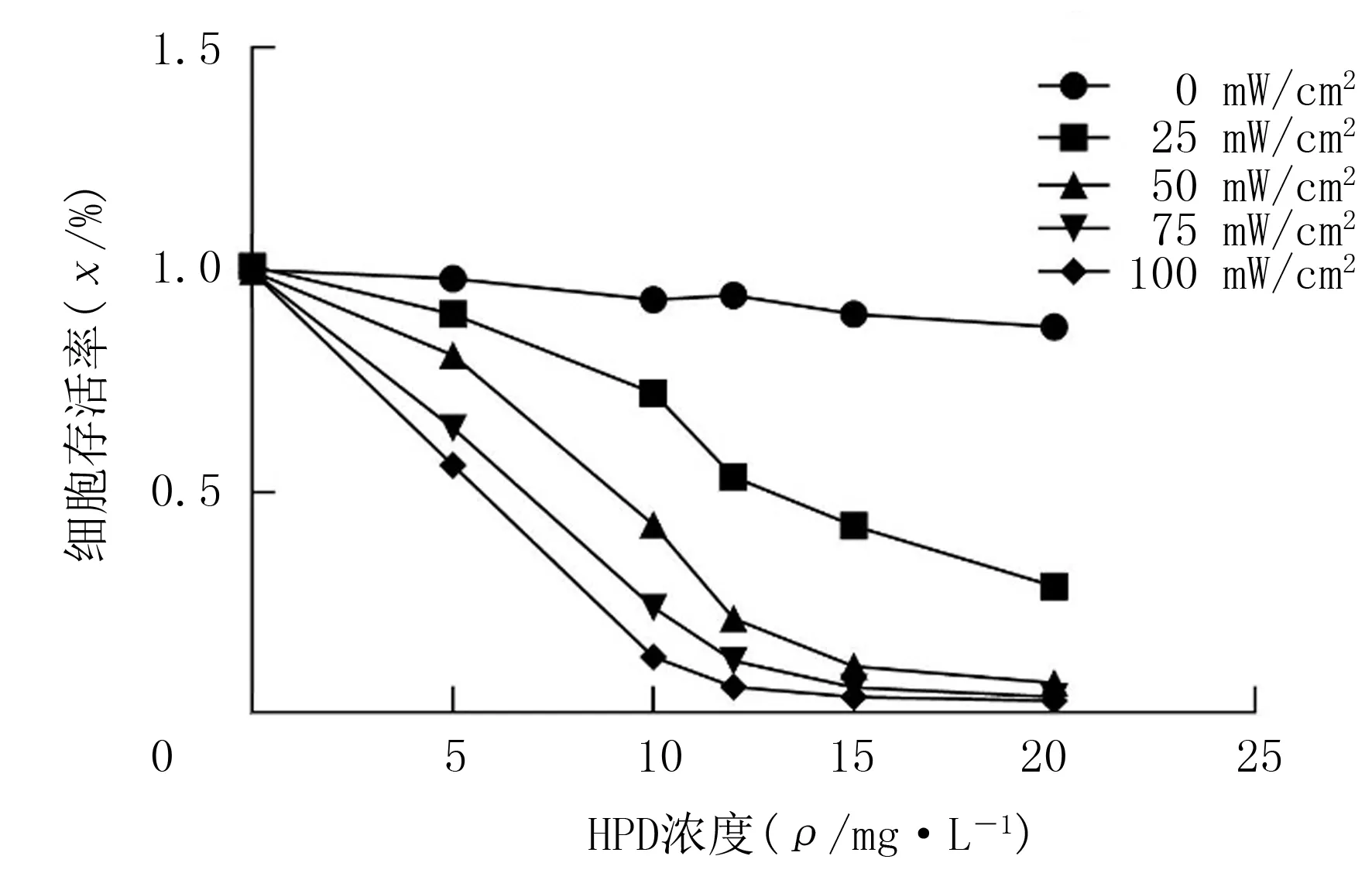
图1 不同浓度HPD结合不同功率密度激光照射对H446细胞活力的影响
3 讨 论
PDT是近年来肿瘤治疗领域的一种新型微创技术,该技术利用肿瘤组织对光敏剂选择性摄入和浓集的特性,给予特定波长激光照射,激发肿瘤组织中的光敏剂产生活性氧,从而导致肿瘤细胞发生凋亡、坏死及自噬等一系列过程,最终达到治疗的目的[6,10]。光敏剂在正常组织中能迅速代谢,因此在杀死肿瘤细胞的同时对正常细胞的损伤较小,不会产生严重副作用,PDT因为靶向性强、微创、可重复进行多次治疗等优点逐渐成为癌症治疗的新手段。其抗肿瘤机制主要有如下几点。①光敏剂吸收特定波长的光后发生Ⅰ型和Ⅱ型光化学反应,Ⅰ型光化学反应即三重态光敏剂与底物分子间直接发生电子转移或抽氢作用,产生自由基离子,并进一步与周围的氧反应生成活性氧;Ⅱ型光化学反应即三重态光敏剂转移能量至基态氧,产生单态性氧。这些物质与肿瘤细胞中的分子发生氧化反应,最终导致细胞凋亡或坏死[11]。②PDT通过改变新生血管内皮细胞的功能结构,导致新生血管血供减少,从而使之缺血、低氧而变性坏死,抗新生血管生成。③增强肿瘤免疫原性,激发机体免疫反应[10]。本研究结果显示,HPD-PDT处理后人SCLC H446细胞的存活率明显降低,其杀伤效应与HPD浓度和激光照射剂量密切相关,在一定范围内,随着光敏剂浓度和激光功率密度的增加而增大。
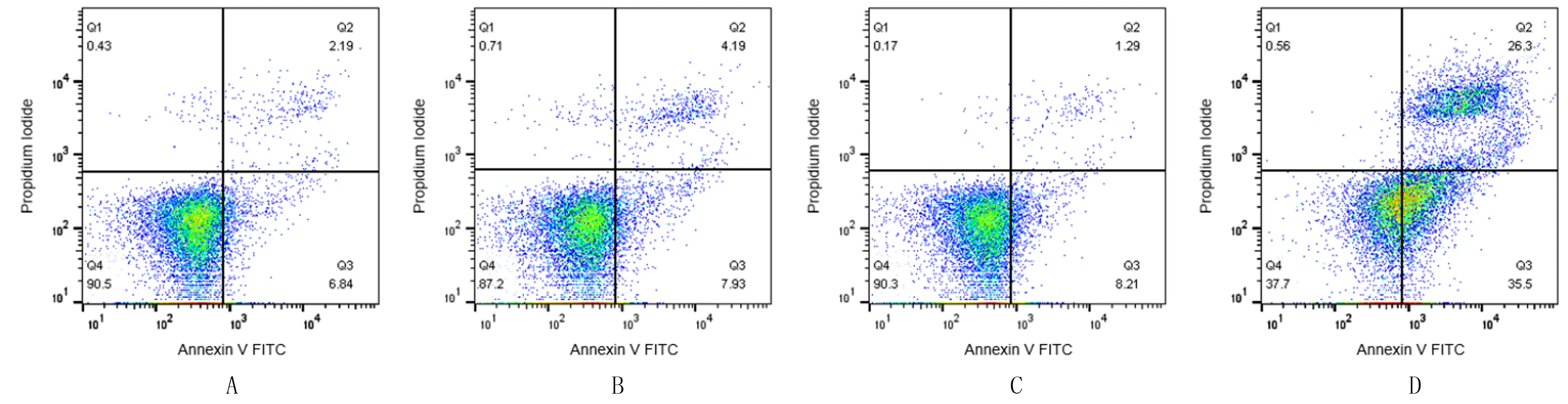
A:空白对照组;B:单纯光敏剂组;C:单纯光照组;D:HPD-PDT 组。
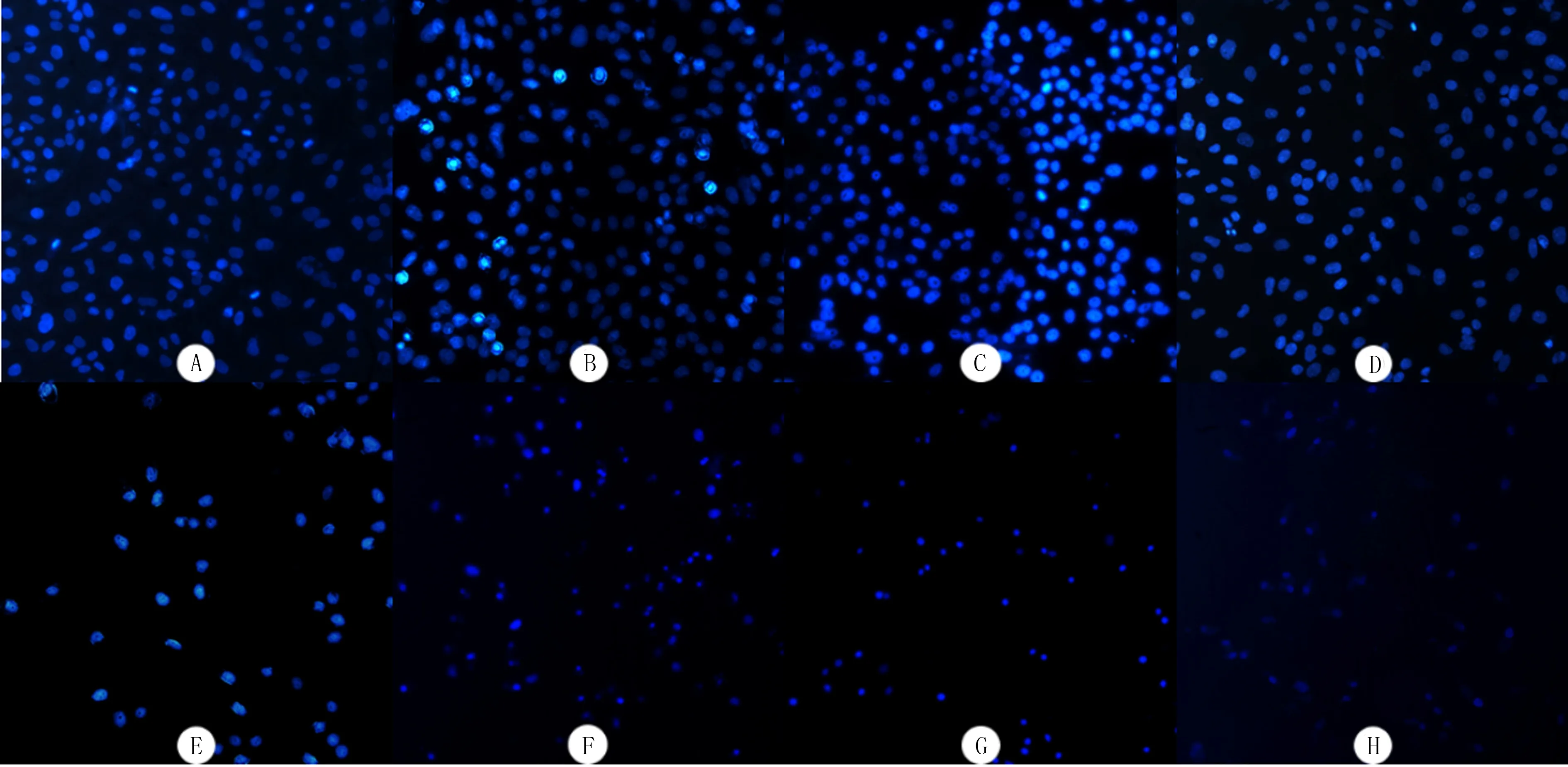
A:空白对照组;B:单纯光敏剂组;C:单纯光照组;D:HPD-PDT组(HPD为5 mg/L);E:HPD-PDT组(HPD为10 mg/L);F:HPD-PDT组(HPD为12 mg/L);G:HPD-PDT组(HPD为15 mg/L);H:HPD-PDT组(HPD为20 mg/L)。200倍。
A:空白对照组;B:单纯光敏剂组;C:单纯光照组;D:HPD-PDT组(HPD为5 mg/L);E:HPD-PDT组(HPD为10 mg/L);F:HPD-PDT组(HPD为12 mg/L);G:HPD-PDT组(HPD为15 mg/L);H:HPD-PDT组(HPD为20 mg/L)。
Bcl-2家族蛋白是细胞凋亡途径的关键调控因子,可分为凋亡促进因子和凋亡抑制因子,两者的比值决定细胞是否能接受凋亡信号[12]。Bcl-2属于抗凋亡因子,Bax属于促凋亡因子,Bax通过与自身组成同源二聚体或者与Bcl-2组成异源二聚体,抑制Bcl-2的活性,从而发挥促进细胞凋亡的作用[13-14]。本研究结果显示,HPD-PDT处理后的H446细胞Bcl-2mRNA表达水平明显降低,而BaxmRNA表达水平明显升高,提示HPD-PDT可能通过改变Bax和Bcl-2异源二聚体平衡而诱导细胞凋亡,与GUO等[15]的研究结果(PDT导致Bcl-2表达水平下调、Bax表达水平上调)一致。Caspase家族是执行细胞凋亡的关键酶家族,其成员为存在于胞质溶胶中的半胱氨酸蛋白酶,可以选择性地对多种信号转导途径中的蛋白质进行高效切割[16]。Caspase-9是内源性凋亡途径中的关键蛋白酶,Bcl-2家族成员Bax和Bak的激活导致细胞色素C(Cyt C)等促凋亡蛋白的释放[17-18],Cyt C结合Apaf-1形成凋亡小体并激活Caspase-9,活化的Caspase-9可以直接裂解并激活Caspase-3和Caspase-7,从而加速细胞凋亡[19-21]。本研究中H446细胞经HPD-PDT处理后BaxmRNA表达增加,Bcl-2mRNA表达降低,启动Caspase级联反应,Caspase-9活化并激活下游Caspase-3和Caspase-7,完成对底物的切割,诱导细胞凋亡。
综上所述,PDT能明显抑制人SCLC H446细胞增殖,并诱导其发生凋亡,呈光敏剂浓度与激光功率密度依赖性,其机制可能与上调Bax和Caspase-9mRNA的表达以及下调Bcl-2mRNA的表达有关。本研究结果为PDT在肺癌中的临床应用提供了一定的理论支持。

