水热合成温度对CuO/CeO2 催化甲醇水蒸气重整制氢性能的影响
冯 旭 ,林 宇 ,张财顺 ,韩 蛟 ,庆绍军 ,张 磊,* ,高志贤,* ,官国清
(1. 辽宁石油化工大学 石油化工学院, 辽宁 抚顺 113001;2. 中国科学院山西煤炭化学研究所, 山西 太原 030001;3. 国立弘前大学 区域创新研究所能量转换工程实验室, 青森松原 030-0813)
环境污染已经成为全球关注的焦点问题,目前,化石燃料的使用是造成环境污染的众多原因之一,因此,开发一种清洁的新能源迫在眉睫。氢能被广泛认为是一种理想的高效的清洁能源[1]。目前,制氢技术大多数是烃类化合物重整[2],甲醇因其氢碳比高、H2产率高、有害产物少等特点[3],被认为是最有前途的制氢原料之一。在众多甲醇制氢方法中,甲醇水蒸气重整制氢(MSR)之所以能脱颖而出,是因为它反应所需要的温度低,产物中H2含量高,其储氢量可达到甲醇质量的18.8%[4]。
氧化铈(CeO2)作为一种重要的镧系稀土氧化物,具有良好的光学、电学性能,且其晶型单一,被广泛应用于发光材料、催化反应、固体氧化物燃料电池等领域,具有广阔的应用前景[5]。制备纳米CeO2的方法有很多种如:化学沉淀法、溶胶-凝胶法、燃烧法、水热法、微乳液法、超声雾化反应法、模板法等[6,7]。而水热法制备氧化物粉体是近几年发展起来的。水热法可使一些在常温常压下反应速率很慢的反应在水热条件下实现快速化,水热法的原料成本相对较低,所得到的粉体纯度高、分散性好、晶型好,且大小可控。因此,常用水热法制备超细CeO2氧化物,也用来控制制备纳米级尺寸的CeO2材料。
CuO/CeO2催化材料是铜物种分散在CeO2上构成的一种催化体系,可用于多种与能源和环境应用密切相关的化学反应。如CO 选择性氧化、低温水煤气变换、甲醇水蒸气重整反应体系等[8]。近年来,许多专家学者一直把合成负载型铜基催化剂作为发展高活性、高稳定性催化材料的重要研究方向。Liu 等[9]研究了不同的载体对MSR 的影响,与CuO/ZnO 和CuO/Al2O3催化材料相比,CuO/CeO2催化材料中Cu-Ce 之间的相互作用较强,Cu比表面积较大,进而催化剂活性较好。Gonzalo等[10]比较了不同载体制备的CuO-CeO2/C 催化材料(C = Al2O3、ZrO2、SiO2)催化CO 氧化性能,发现CuO-CeO2/SiO2拥有较高的比表面积,其催化氧化活性也最高。CeO2的微观结构对Cu 物种分散、稳定以及形成铜铈界面具有重要意义[11,12]。近年来,纳米级CeO2材料的尺寸控制及其性能应用成为研究的热点之一。Mai 等[13]通过改变水热合成温度和沉淀剂浓度制备CeO2纳米材料并且应用在CO 选择性氧化反应中,结果表明,主要暴露(100)和(110)晶面的CeO2纳米材料,在400 ℃下测量的储氧量(OSC) 显示,氧的储存既发生CeO2纳米材料的表面,也发生在其内部。因此,主要暴露(100) 和(110) 晶面结构的CeO2纳米材料对CO 选择性氧化更具有活性。Zhou 等[14]以Ce(NO3)3·6H2O 和NaOH 为 原 料 合 成 了CeO2纳 米材料并探索了不同水热合成时间得到的CeO2纳米材料应用在光降解亚甲基蓝反应中的催化性能,结果表明,随着水热合成时间的延长其催化效果也随之增加。刘玉娟等[15]分别采用水热法、沉淀法、溶胶-凝胶法三种方法合成了CeO2纳米材料后负载CuO 得到CuO/CeO2催化材料用于MSR反应中,其中,水热法合成时以Ce(NO3)3·6H2O、NaOH和乙醇胺为原料,所得CeO2纳米材料制备的CuO/CeO2催化MSR 反应可达到较好的催化效果。本研究在此基础上,将沉淀剂NaOH 改为尿素,并不用乙醇胺,其优势在于合成产物不含Na+,减少了洗涤次数。在初步考察了水热合成条件基础上,本研究重点探讨了改变水热合成温度制备CeO2纳米材料,并探究了不同水热合成温度对CeO2微观结构,CuO/CeO2催化剂结构、性质和催化MSR反应性能的影响。建立催化材料结构和性能之间的关系,为了甲醇水蒸气重整制氢催化材料的设计提供理论依据。
1 实验部分
1.1 催化剂的制备
CeO2的制备:分别称取13.024 和5.405 g 的Ce(NO3)3·6H2O 和 尿素(其中,Ce(NO3)3·6H2O 和 尿素的物质的量比为1∶3),加入30 mL 的去离子水中,室温下搅拌混合30 min。将所配制的溶液倒入以聚四氟乙烯做内衬的不锈钢反应釜中,将反应釜放入均相反应器内(均相反应器由箱体、旋转系统、加热系统、控制系统四部分组成)。此类均相反应器常用于多个水热反应釜进行相同组分的介质在不同的环境下反应情况的测试。而且这种反应器具有的支架可以旋转使水热反应釜中的介质得到充分的搅拌、反应充分彻底,比单纯的恒温干燥箱效果更好。然后将均相反应器以5 ℃/min的程序升温到一定的温度(140、160、180、200 ℃),在转速为28 r/min 下水热合成24 h,停止水热合成后,冷却到室温,经抽滤得滤饼,用2000 mL,80 ℃的去离子水洗涤后,在85 ℃烘箱中干燥12 h,得到的固体黄色粉末,放入450 ℃马弗炉中焙烧5 h得CeO2粉末,标记为CeO2-x(x= 140、160、180、200)。
CuO/CeO2催化剂的制备:采用不同水热合成温度制备的CeO2载体,将活性组分CuO 浸渍在载体CeO2上(Cu 元素(g)/CeO2(g) = 10%),然后在110 ℃烘箱中干燥12 h,将干燥后的样品研磨至100−200 目,在450 ℃的马弗炉中焙烧3 h,压片,粉碎后过筛至40−80 目,得CuO/CeO2催化材料,记作CuO/CeO2-x(x= 140、160、180、200)。
1.2 催化剂的表征
使用德国Bruker D8 型X 射线粉末衍射仪检测样品的物相结构。使用贝士德BSD-PM2 型高性能比表面积及微孔分析仪测定样品的比表面积和孔体积,比表面积由BET法计算,孔体积由BJH 法计算。样品的还原性质采用浙江泛泰仪器有限公司型号为FINESORB-3010C 的全自动程序升温化学吸附仪测定。XPS 分析在Thermo Scientific Escalab 250Xi 光电子能谱仪上完成。实验中以AlKα 为激发光源,内标物采用样品的污染碳(C 1s= 284.6 eV),用以校正样品表面的荷电效应。
1.3 催化剂的性能测试
样品的甲醇水蒸气重整制氢性能在实验室自行搭建的固定床反应器上进行,具体过程见参考文献[16]。
甲醇转化率和产氢速率公式如下:
甲醇转化率:
CO 选择性:
式中,FR是标准状况下重整气的流量(mL/min);F是泵的进料量(mL/min);ρmix是甲醇水溶液的混合密度(g/mL);w是水醇的物质的量比;mcat为评价时催化剂的质量(kg);CCO、CCO2、CH2分别为FR的CO、CO2、H2的体积分数。
2 结果与讨论
2.1 晶体结构分析
图1为不同水热合成温度制备CeO2样品的XRD 谱图。由图1 可知,谱图中并未发现其他物质的峰,图中28.6°、33.1°、47.5°、56.4°、59.1°、69.5°、76.8°和79.1°处出现的衍射峰,可归属于(111)、(200)、(220)、(311)、(222)、(400)、(331)和(420)晶面,八个CeO2的特征衍射峰均对应于标准图谱(JCPDS NO.43-1002)CeO2的特征衍射峰,说明所制备的样品都属于立方萤石结构的CeO2晶体材料。由Scherrer 公式[17]计算四种CeO2载体的粒径大小为14.1、19.7 、19.5 、23.9 nm,说明所制备的样品都属于纳米级CeO2晶体材料。负载CuO 后制备的催化材料的衍射峰如图2 所示,可以看到,除了CeO2衍射峰外,在2θ= 35.5°和38.7°处能观察到两个衍射峰,归属于单斜结构的CuO(JCPDS 89-2529)。由Scherrer 公式[17]计算得,CuO/CeO2-x催化材料中CuO 的平均晶粒尺寸为37.9、38.1、33.1、32.5 nm。
2.2 催化剂物化性质分析
表1为不同水热合成温度制备CeO2-x载体以及CuO/CeO2-x催化材料的物化性质和甲醇水蒸气重整反应的产氢率表。由表1 可知,改变水热合成温度参数,所制备的CeO2-x载体具有不同的晶胞参数。与CeO2标准谱图(JCPDS NO.43-1002)晶胞参数(5.411 Å)作对比,发现制备的CeO2-x载体的晶胞参数与标准的晶胞参数略有偏差,这表明可能不同水热合成温度对制备的载体CeO2的微观结构性质(应力、缺陷)产生了一定的影响。对比负载前后的CuO/CeO2-x催化材料中CeO2晶胞参数,发现负载后的晶胞参数变小了。这一结果说明少量的Cu2+可能进入到了CeO2晶体结构,形成固溶体;因其Cu2+的半径(0.73 Å)比Ce4+半径(0.97 Å)要小[18],所以负载后的CeO2的晶胞参数发生收缩变小了。
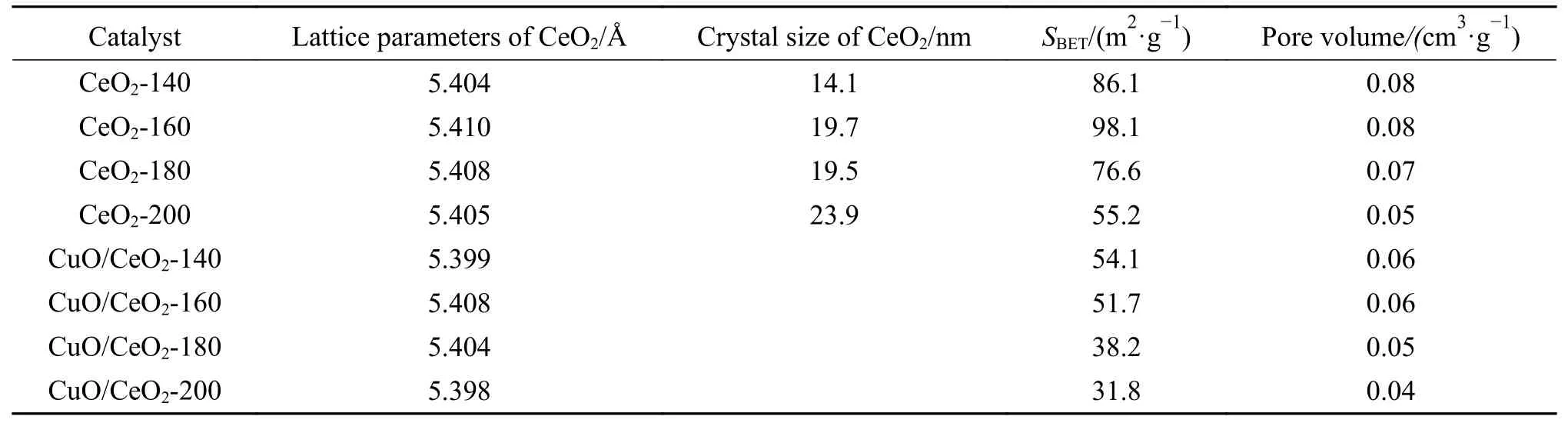
表1 CeO2 和CuO/CeO2-x 的物化性质Table 1 Physicochemical and hydrogen production rate of CuO/CeO2-x and CeO2
通过低温N2吸附-脱附测得CeO2-x载体以及CuO/CeO2-x样品的比表面积(SBET)和孔容列于表1,CeO2-140、CeO2-160、CeO2-180 和CeO2-200 载体的比表面积分别为86.1 、98.1、76.6 和55.2 m2/g。负载CuO 后,比表面积减小,分别为54.1 、51.7、38.2和31.8 m2/g。这是由于负载CuO 后,CeO2的部分孔道被CuO 堵塞造成的。
图3和图4 分别为载体CeO2-x样品和CuO/CeO2-x催化材料的N2吸附-脱附等温曲线。根据文献[19]可知,此类型的等温线,可归属为Ⅳ型。从图4可以看出,所有制备的CuO/CeO2-x催化材料样品均出现了H3 型回滞环。当相对压力(p/p0) 在0.4以下时,在催化材料的表面只发生一层吸附;相对压力在0.4−0.8 时,图中出现了回滞环,出现回滞环的原因是N2在催化材料的内部孔道产生了多层吸附和凝聚现象,催化材料发生脱附时出现的滞后现象所导致的,这说明制备的四种催化材料都属于介孔材料。
2.3 催化剂的还原性质分析
根据文献[20]可知,通过催化材料还原峰的位置来判断催化材料中CuO 与CeO2载体间的相互作用情况[21],因此,对制备的CuO/CeO2-x催化剂进行了H2-TPR 分析。纯CuO 的还原温度为340 ℃,四种CuO/CeO2-x催化材料中CuO 的还原温度均小于此数值,这说明活性组分CuO 与载体CeO2之间发生了相互作用,导致制备的催化材料中CuO的还原温度降低[22],也说明了Cu-Ce 的相互作用有利于CuO 的还原[23]。图5 中四种催化材料均出现了三个还原峰,对应CuO/CeO2-x催化材料中三种可还原的Cu 物种。其中,α峰和β峰都可归属为高度分散的表面CuO 物种的还原峰,γ峰归属为分散性较差晶相CuO 物质的还原峰[24]。在四种催化材料中Cu-Ce 的相互作用强度,可以利用α峰(或β峰)的位置来判断,α峰的位置出现的越靠近低温区,Cu-Ce 之间的相互作用较强。这是因为,首先这里的CuO 是指暴露在载体表面或周围的CuO。它在载体表面的分散性越好越容易还原,对应的还原温度越低;其次,CuO 与CeO2载体发生相互作用,降低其表面自由能,使得表面或周围的CuO 稳定且高度分散,这一结论与文献结果一致[25]。由图5 可知,CuO/CeO2-180 催化材料的α峰还原温度较低,因此,CuO/CeO2-180 催化材料的Cu-Ce 之间相互作用较强。
四种催化材料各还原温度和还原峰的峰面积占比情况见表2。对比不同CuO/CeO2-140、CuO/CeO2-160、CuO/CeO2-180 和CuO/CeO2-200 催化材料发现,CuO/CeO2-180 催化材料α峰和β峰的总面积占比相较于其他三种催化材料较大,说明此催化材料中高度分散在表面的CuO 物种含量较多。对于CuO/CeO2催化材料,表面的CuO 物种含量对甲醇水蒸气制氢起主要贡献作用,表面的CuO 物种含量较多,催化活性较好,由图10 可知,此催化材料的催化活性较好。
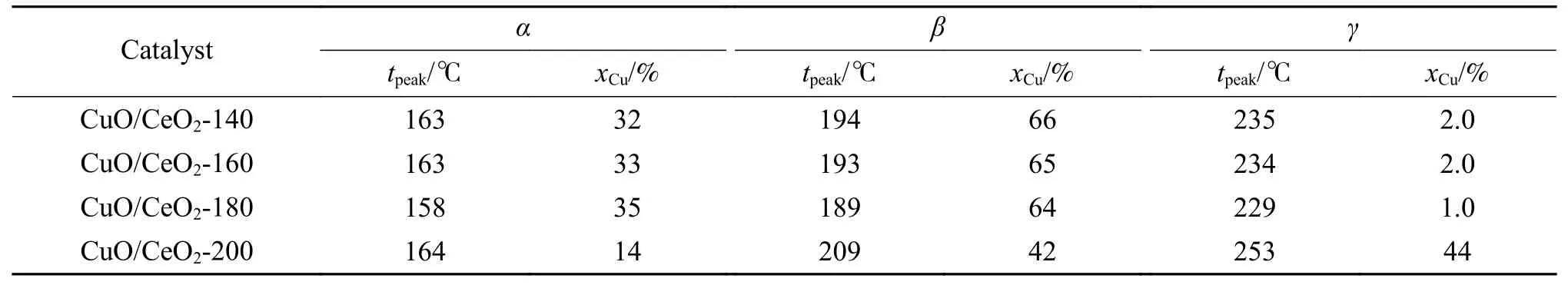
表2 催化剂的还原峰位置和Cu 含量Table 2 Reduction peak position of catalyst and Cu content
2.4 XPS 分析
图6为不同水热合成温度下制备的CuO/CeO2-x催化剂的Ce 3dX 射线光电子能谱。由图6可知,四种不同的催化材料均出现了八个Ce 3d的特征衍射峰,其中,u、u'、u''、u'''属于Ce 3d3/2能级的电子结合能,而v、v'、v''、v'''则属于Ce 3d5/2能级的电子结合能。在图6 中所示的八个特征峰中,u'和v'属于Ce3+的特征峰,u、u''、u'''、v、v''、v'''则归属于Ce4+[26],说明所制备的催化材料中共同存在Ce3+和Ce4+。Ce3+的存在与催化材料表面形成的氧空穴有着直接的联系,Ce3+含量越多,催化剂表面的氧空穴越多,催化活性越好。
从表3 给出的Ce3+含量占比可以看到,不同CuO/CeO2-x催化材料中Ce3+含量的大小顺序为:CuO/CeO2-180 > CuO/CeO2-160 > CuO/CeO2-140 >CuO/CeO2-200,其大小顺序与催化材料的评价结果(图10)相吻合。其中,CuO/CeO2-180 催化剂的Ce3+含量占比高达18.2%,表面的氧空穴最多,这是此催化剂表现出较好催化活性的重要原因之一。
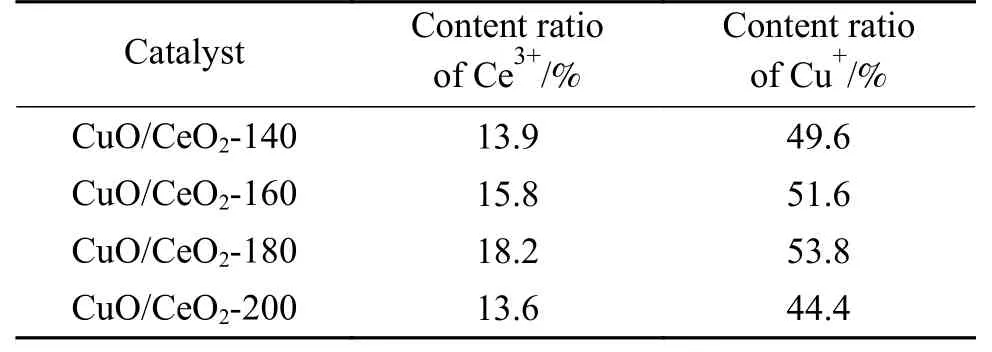
表3 催化剂Ce 3d 和Cu 2p 的XPS 曲线拟合结果Table 3 Fitting results of Ce 3d and Cu 2p XPS curves of catalysts
图7为不同水热合成温度下制备的CuO/CeO2催化材料的Cu 2pXPS 谱图。由图7 可知,不同水热合成温度制备的催化材料均出现了三个特征峰,其中,953.2 eV 附近出现的特征衍射峰属于Cu 2p1/2能级的电子结合能,938.2−947.3 eV 出现的特征峰则属于Cu 2p的卫星峰[27]。此卫星峰是Cu2+离子中价层轨道电子与溢出的光电子发生相互作用,产生的电荷震荡导致的[28]。该峰属于Cu2+离子的电子能谱特征峰。在933.1 eV 附近出现的衍射峰属于Cu 2p3/2能级电子结合能[29],与标准Cu 2p3/2能级的电子结合能(934.9 eV)相比,发生了偏移,因此,说明该催化材料中可能存在Cu+和Cu0两物种。
Cu+和Cu0两物种的出峰位置与特征峰形状均较为类似,为两种物质的辨别造成了困难,只通过Cu 2pXPS 谱图很难区分Cu+或Cu0特征峰,因此,加入了Cu LMM 谱图,以进一步区分两物种,催化材料的Cu LMM 谱图,见下图8。由图8 可知,917.0 和912.0 eV 附近特征峰的结合能均低于Cu0的俄歇电子能(918.6 eV),因此,将这两个位置出现的特征峰均归属于Cu+。XRD 分析中(图2)发现只有CuO 的特征衍射峰,并未发现Cu2O 的特征衍射峰,这表明,Cu2O 高度分散于催化材料的表面。催化材料表面存在Cu+,是因为Cu2+与Ce3+发生了相互作用,Ce3+转化为Ce4+,Cu2+也变成了Cu+;显然,Cu+物种的含量大小代表着Cu-Ce 之间发生相互作用的程度,Cu+越多,Cu-Ce 之间的相互作用也就越强。
根据Cu 2p的XPS 谱图,对Cu+所占的含量进行了计算,如表3 所示。可以看出,CuO/CeO2-180催化材料中Cu+所占的含量最高,说明CuO/CeO2-180 催化材料的表面,Ce-Cu 之间的相互作用更强,一般而言,相互作用越强,催化剂的催化活性越好,因此,CuO/CeO2-180 催化材料在MSR 反应中表现出较好的催化性能,并且甲醇转化率最高。
图9为四种不同水热合成温度制备的CuO/CeO2催化材料的O 1sXPS 谱图。由图9 可知,不同水热合成温度制备的催化材料均出现了两个特征峰,其中,529.0 eV 附近出现的特征峰归属于晶格氧的电子结合能,531.0 eV 附近出现的特征峰则归属于吸附氧物种的电子结合能[30]。
2.5 催化性能测试
不同水热合成温度条件下合成的催化材料催化MSR 反应的甲醇转化率都随着重整反应温度的升高而增加。这是因为该反应作为一个强吸热反应,升高反应温度可能对该反应是有利的,进而甲醇的转化率有了提高[31]。在四种催化材料中,CuO/CeO2-180 催化材料的催化性能最好,在反应温度为280 ℃、W/M为1.2、GHSV 为800 h−1的条件下,甲醇转化率为91.0%。CuO/CeO2-140 催化材料和CuO/CeO2-160 催化材料在相同条件下,催化材料催化MSR 反应的甲醇转化率分别为79.2%和83.9%。相比之下,CuO/CeO2-200 催化材料上甲醇转化率最低,催化活性最差,相同条件下转化率仅为68.8%。根据产氢速率公式计算可知,水热合成温度为180 ℃条件下所合成的CuO/CeO2-180 催化材料在四个催化材料中具有最大的产氢速率,为649.5 cm3/(kg·s)。水热合成温度为200 ℃条件下所合成CuO/CeO2-200 催化材料的产氢速率最小,为505.6 cm3/(kg·s)。
由此可以得出,不同水热合成温度对催化材料的甲醇转化率存在不同程度的影响。造成催化活性差异的主要原因是不同的水热合成温度影响催化材料的表相CuO 还原温度、Cu-Ce 之间相互作用以及表面氧空穴量。甲醇水蒸气重整制氢反应过程主要反应为甲醇和水生成二氧化碳和氢气(CH3OH +H2O = CO2+ 3H2),甲醇裂解反应(CH3OH = CO +2H2)和水气变换反应(CO + H2O = CO2+ H2),结合表征可知,在所制备的四种催化材料中,水热温度为180 ℃合成的CeO2衍射峰强度大,说明此条件下制备的CeO2晶化程度高,CeO2的形成结构影响在其表面Cu 物种的分散,这有可能是CuO 物种在此条件下制备的CeO2表面形成了高度分散。由H2-TPR 谱图可知,CuO/CeO2-180 催化材料中,分散在其表面的CuO 物种含量较高,Cu 作为CeO2/CuO催化材料的活性中心对甲醇水蒸气重整制氢反应起主要贡献作用,表面的CuO 物种含量较多,催化活性较好。除此之外CuO/CeO2-180 催化材料中表相CuO 的还原温度较低,Cu-Ce 之间的相互作用较强,表面氧空穴较多,这些因素都促进了甲醇水蒸气重整主反应的进行,甲醇转化率较高,因此,表现了较好的催化活性。
首先控制重整尾气中CO 的摩尔分数至1.0 ×10−5以下,是氢用于燃料电池氢源系统的关键。CO 摩尔分数越高,导致催化剂中毒的几率就会越大,进而也会影响燃料电池的效率,因此,控制CO 摩尔分数是关键。其次在提高甲醇转化率的同时降低副产物含量也是非常重要的。本研究对四种催化材料的重整尾气中CO 摩尔分数进行了测定,由图11可知,随着重整反应温度的升高,重整尾气中CO摩尔分数逐渐上升。这是由于在MSR 体系中,除了甲醇水蒸气重整制氢的主要反应即甲醇和水反应生成二氧化碳和氢气外,还存在了副反应,甲醇的直接裂解生成了CO 和H2[32],甲醇的直接裂解也是吸热反应,温度升高会导致重整尾气中CO 含量的上升。另外,反应过程中还可能发生逆水气变化反应,也会增加尾气中CO 的含量。
由图11 可知,当重整反应温度为220–280 ℃时,比较CuO/CeO2-x催化材料重整尾气中CO 摩尔分数的大小,CuO/CeO2-200 催化材料的重整尾气中CO 摩尔分数相较于另外三种催化材料较小,为0.06%,CuO/CeO2-180 催化材料的重整尾气中CO 摩尔分数相较于另外三种催化材料较大,为1.29%。
为了比较转化程度与生成CO 的关系,以产物中CO 选择性除以转化率,得到比选择性。图12是四个催化剂的CO 比选择性与重整反应温度的关系曲线,可以看出与图11 的变化规律一致,CuO/CeO2-200 催化材料CO 比选择性较低,对应的选择性也较低,这表明CO 的生成与甲醇转化率之间没有直接的关联。
3 结 论
本研究探究水热合成温度对CeO2载体和CuO/CeO2催化材料应用在MSR 反应中催化性能的影响。以Ce(NO3)3·6H2O 和尿素为原料,改变水热合成温度来制备CeO2载体,然后再通过浸渍法制得CuO/CeO2-x催化材料,最后在MSR 反应中测试催化材料的催化活性。结合N2吸附-脱附XRD、H2-TPR、BET 和XPS 表征方法,分析可知,水热合成温度不仅影响载体CeO2的合成,还会影响其晶粒大小、比表面积和孔结构等性质,进而影响负载CuO 后制备的CuO/CeO2催化材料的性质,如催化材料表相CuO 的还原温度,Cu-Ce 之间相互作用情况以及表面氧空穴,因此,催化性能也表现出了一定的差异。在四种催化材料中,180 ℃条件下水热合成载体所制备的CuO/CeO2-180 催化材料表相CuO 的还原温度最低,Cu-Ce 之间相互作用最强以及表面氧空穴最多,因此,该催化材料具备最好的催化活性。当反应条件为280 ℃,W/M为1.2,GHSV 为800 h−1时,甲醇转化率为91.0%,重整气中CO 摩尔分数为1.29%。

