载TGF-β3甲基丙烯酰化肝素对牙髓干细胞成骨分化能力的影响及其机制
邹馨颖,高 爽,赵 红,刘 新,赵远航,宋嘉卓,闫琳琳,张志民
(吉林大学口腔医院牙体牙髓科,吉林 长春 130021)
颌面部骨缺损包括牙周缺损和广泛的骨丢失等,可导致周围结构的破坏、畸形和功能受限[1]。颌面部骨组织缺损的传统修复方式包括自体骨移植和异体骨移植等[2],但其在恢复颌骨形态和功能重建方面均有局限性,不能阻止疾病发展也不能使缺损的组织再生[3]。目前颌面部骨缺损修复最有效的是组织工程学方法[4]。近年来随着组织工程学的发展,种子细胞、生长因子和载体材料成为研究热点。在未分化的状态下,间充质细胞增殖和分化能力极强,口腔中牙源性干细胞为种子细胞的主要来源[5], 其 中 牙 髓 干 细 胞 (dental pulp stem cells,DPSCs)具有自我更新和多向分化为优势种子细胞的潜能[6]。转化生长因子 β(transforming growth factor-β, TGF-β)家族是组织工程学中广泛使用的生长因子之一,其中TGF-β3是在干细胞分化为成骨细胞过程中具有多种功能的多肽类生长因子[7]。 甲 基 丙 烯 酰 化 肝 素 (methacrylamide heparin,HepMA)为双改建改性肝素,可通过光引发剂在紫外光照射下凝固成胶,是一种生物源性材料,具有优异的生物相容性和可降解性[8]。HepMA富含易于修饰改性的羟基和羧基,利于生长因子的释放,近年来被广泛用于组织工程支架材料研究[9]。TGF-β3 对 DPSCs成骨分化能力的影响目前尚不明确,且尚未有利用HepMA作为TGF-β3载体的研究。本研究旨在探讨载TGF-β3的HepMA对DPSCs成骨分化能力的影响,为组织工程学在口腔颌面外科方面的应用提供理论依据。
1 材料与方法
1.1 主要试剂和仪器 DMEM培养基、双抗和PBS缓冲液(中国海克隆公司),胎牛血清(美国Gibco公司),肝素、β甘油磷酸钠、维生素C和茜素红试剂盒(美国Sigma公司),CCK-8试剂盒(中国新赛美公司),碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒(上海碧云天生物技术有限公司),CD90、CD105、CD34、CD45抗体和TGF-β3(美国Proteintech公司),实时荧光定量 PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒和TRIeasyTM总RNA提取试剂盒(上海翊圣生物科技有限公司)。倒置相差显微镜(日本Olympus公司),5%CO2恒温培养箱(美国Thermo Fisher Scientific公司),流式细胞仪(美国BD公司),扫描电子显微镜(德国Semorr公司)。
1.2 人 DPSCs(human DPSCs,hDPSCs)的分离、培养和鉴定 本实验经吉林大学口腔医院伦理委员会审批。收集于吉林大学口腔医院颌面外科就诊的18~23岁患者的第三磨牙,纳入标准为牙体完整且无龋坏的第三磨牙。将新鲜的离体牙装在含10%双抗的PBS缓冲液中,采用酶消化法和组织块法提取hDPSCs。超净台中将离体牙敲开后,取出牙髓放入装有含10%双抗的PBS缓冲液的1.5 mL EP管中,用镊子夹取牙髓依次在4个含10%双抗的PBS缓冲液的1.5 mL EP管中洗涤,用眼科剪将牙髓在EP管中剪碎,离心后加入1%胶原酶和1%胰蛋白酶覆盖过牙髓组织块,将EP管放置在37℃恒温箱中30 min,待细胞融合至80%后进行传代,取第3代细胞进行后续实验。胰蛋白酶消化第3代hDPSCs,PBS缓冲液冲洗并重悬,在各管中加入鼠抗人CD45-FITC、CD90-FITC、CD105-FITC和CD34-FITC抗体吹打混匀,置于4℃冰箱中避光孵育15 min,PBS缓冲液清洗2次,采用流式细胞仪检测细胞表面抗原表达情况。
1.3 材料制备 1%肝素在PBS缓冲液中溶解,每克肝素与10倍摩尔质量的甲基丙烯酸酐在4℃的条件下搅拌24 h,并保持反应液的pH值为8。光引发剂为苯基-2,4,6-三甲基苯甲酰基膦酸锂(LAP),避光条件下将0.05 g LAP加入20 mL无菌PBS缓冲液中,40℃水浴加热溶解15 min,期间震荡数次。所有反应溶液用去离子水进行透析,以去除未反应的分子,经过无菌过滤即得到HepMA水凝胶,4℃避光保存备用。HepMA水凝胶溶液在405 nm光源下照射10~30 s,制备出光固化HepMA水凝胶。
1.4 扫描电子显微镜观察材料表面形态表现 将制备好的HepMA水凝胶样品冻干,样品的断面进行喷金处理,在场发射环境中扫描电子显微镜下观察HepMA水凝胶断面的超微结构,采用Image J统计软件分析HepMA水凝胶孔径大小。
1.5 TGF-β3-HepMA制备 在超净台内将TGF-β3冻干粉溶于无菌去离子水,浓度分别为20、 40、 60、 80 和 100 μg ·L-1, 将 不 同 浓 度 的TGF-β3溶液与无菌的HepMA溶液混合,于波长405 nm光源条件下,照射混合液10~30 s制备出载TGF-β3的HepMA水凝胶,即TGF-β3-HepMA。
1.6 CCK-8法检测hDPSCs的增殖活性 采用CCK-8法筛选出载TGF-β3最适浓度。将载有不同浓度 (0、20、40、60、80 和 100 μg·L-1) TGF-β3的HepMA分别置于6孔细胞培养板中,每孔加入900 μL,光固化后,每孔加入3 mL单纯培养基,置于恒温细胞培养箱中24 h。收集各组液体配成含10%血清和1%双抗的浸提液。按每孔2 000个细胞将hDPSCs铺于96孔细胞培养板中,培养24 h后,按照不同分组方法加入含有相应浸提液的培养基,继续培养1、3和5 d后弃培养液,每孔加入100 μL不 含 血 清 的 DMEM 培 养 基 和 10 μL CCK-8,继续孵育3 h,采用酶标仪测定波长450 nm处吸光度(A)值,以A值代表各组细胞增殖活性,实验重复3次。
1.7 绘制药物释放曲线 以HepMA为载体,将“1.6”中检测的最适浓度TGF-β3加载于未成胶的HepMA中制备 1 mL TGF-β3-HepMA,加入到10 mL离心管中在波长405 nm光源下照射10~30 s使TGF-β3-HepMA成胶,然后向离心管中加入模拟体液3 mL,每隔一段时间(30 min、2 h、4 h、6 h、8 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d、7 d、12 d、14 d 和 21 d) 取 100 μL 溶液,并 补加100 μL模拟体液,收集后采用ELISA试剂盒检测各个时间点TGF-β3浓度,计算各时间点的累计药物释放量,并绘制体外药物释放曲线。
1.8 ALP染色法观察各组细胞的ALP染色面积 按照每孔1×104个细胞将hDPSCs接种于6孔细胞培养板中,24 h后更换成骨诱导液,分为对照组、HepMA组和TGF-β3-HepMA组,置于37℃、5%CO2孵箱中培养,待细胞贴壁后,更换为含有不同浸提液的成骨诱导培养基,每3 d更换1次,分别诱导7和14 d后,弃掉培养基用去离子水冲洗2次,每次5 min,冲洗后4%多聚甲醛固定30 min,弃液后用去离子水冲洗3次,在室温避光条件下,按照说明书的步骤配制工作液进行ALP染色,反应中止后在显微镜下观察各组细胞ALP染色面积,ALP染色阳性可见细胞质呈蓝紫色,并且有蓝紫色颗粒物。
1.9 茜素红染色观察各组细胞钙结节形成情况 按照每孔1×104个细胞将hDPSCs接种于6孔细胞培养板中,分为对照组、HepMA组和TGF-β3-HepMA组,置于 37℃、5%CO2孵箱中培养,待细胞贴壁后,更换为含有不同浸提液的成骨诱导培养基,每3 d更换1次,诱导21 d后,弃掉培养基,去离子水冲洗2次,多聚甲醛固定30 min弃液,去离子水冲洗3次,采用1%茜素红染液进行钙结节染色,观察各组细胞矿化钙结节染色情况及面积,矿化结节呈红色斑点状。
1.10 RT-qPCR法检测各组细胞中成骨相关因子mRNA表达水平 按照每孔1×104个细胞将hDPSCs接种于6孔细胞培养板中,分为对照组、HepMA组和TGF-β3-HepMA组,每3 d更换培养基,于第7和14天使用Trizol up裂解细胞,采用RNA提取试剂盒提取RNA,逆转录后通过RT-qPCR法检测成骨相关因子—Runt相关转录因子 2(Runt-related transcription factor 2,Runx2)、ALP、骨钙桥素(osteocalcin,OCN)和Ⅰ型胶原蛋白(collagen type-Ⅰ,COL-Ⅰ)mRNA表达水平。引物序列见表1。反应程序:95℃预变性15 min;95℃变性15 s,60℃退火/延伸30 s, 45个循环。采用2-ΔΔCt法计算目的基因mRNA表达水平。
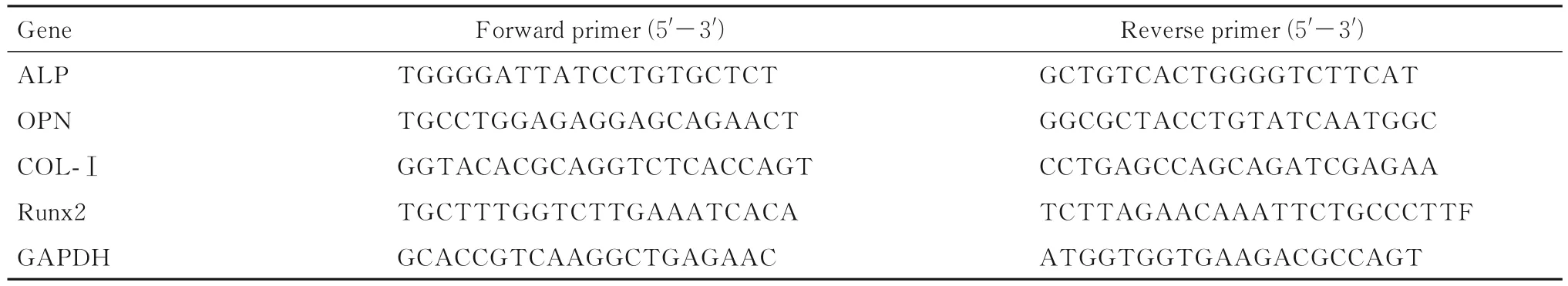
表1 RT--qPCR引物序列Tab.1 Primer sequences for RT--qPCR
1.11 统计学分析 采用Graphpad Prism 6.0统计软件进行统计学分析。各组细胞增殖率和细胞中成骨相关因子mRNA表达水平均符合正态分布,多组间样本均数比较采用单因素方差分析,组间两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 hDPSCs的培养和鉴定 倒置相差显微镜下观察原代培养的hDPSCs,牙髓组织块周围爬出呈长梭形的细胞(图1),第3代hDPSCs形态良好(图2)。流式细胞术检测结果显示:培养细胞中CD90和CD105抗体呈阳性表达,CD34和CD45抗体呈阴性表达,符合hDPSCs表面抗体表达特征,故提取的细胞鉴定为hDPSCs。见图3。
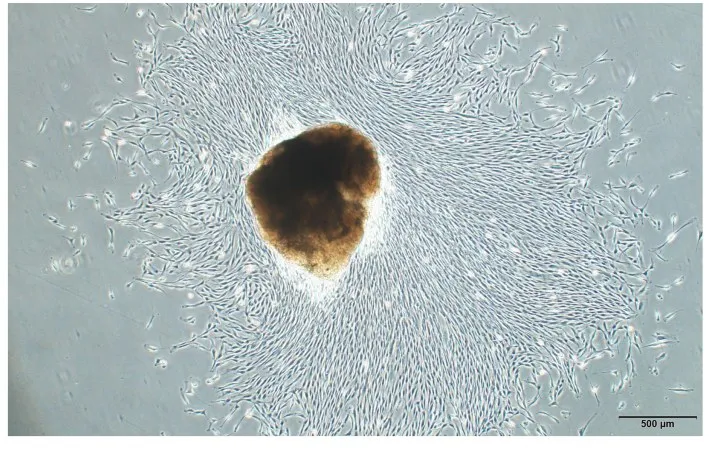
图1 原代hDPSCs形态表现(Bar=500 μm)Fig.1 Morphology of primary hDPSCs(Bar=500 μm)

图2 第3代hDPSCs形态表现Fig.2 Morphology of third generation of hDPSCs
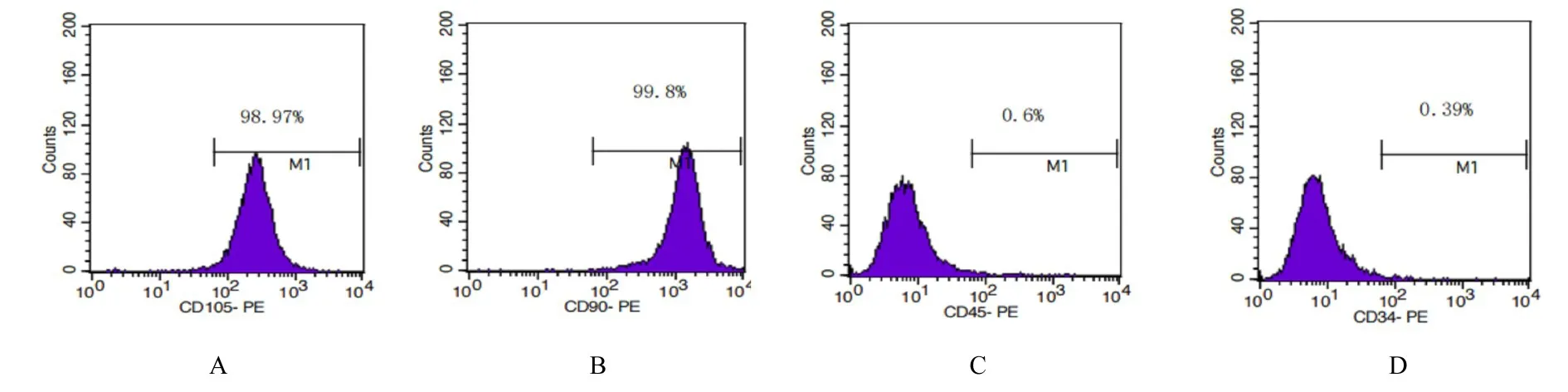
图3 流式细胞术鉴定hDPSCsFig.3 Identification of hDPSCs by flow cytometry
2.2 扫描电子显微镜下观察HepMA材料表面形态表现 光照后10 s左右HepMA水凝胶成胶,倒置后成胶的HepMA水凝胶呈半透明的胶冻状(图4)。光固化HepMA水凝胶冻干的扫描电子显微镜图像见图5,经Image J软件分析其孔径为50~70 μm。

图4 HepMA水凝胶Fig.4 HepMA hydrogel
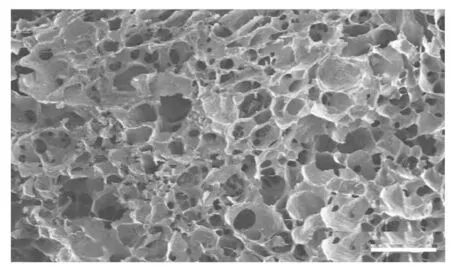
图5 SEM观察HepMA材料表面结构(Bar=100 μm)Fig.5 Surface structure of HepMA material observed by SEM(Bar=100 μm)
2.3 CCK-8法筛选载TGF-β3最适浓度 在细胞培养第1、3和5天时,培养基中累计释放TGF-β3浓度为 0、20、40和 60 μg·L-1时 hDPSCs的增殖活性依次增强,与 0 μg·L-1TGF-β3-HepMA 组比较,20、40 和 60 μg·L-1TGF-β3-HepMA 组 hDPSCs增殖活性明显升高 (P<0.05),60 μg·L-1TGF-β3-HepMA组hDPSCs增殖活性最高;当TGF-β3浓度继续增加至 100 μg·L-1时,hDPSCs的增殖活性逐渐降低,故筛选出载TGF-β3的最适浓度为60 μg·L-1,用于后续实验。见图 6。
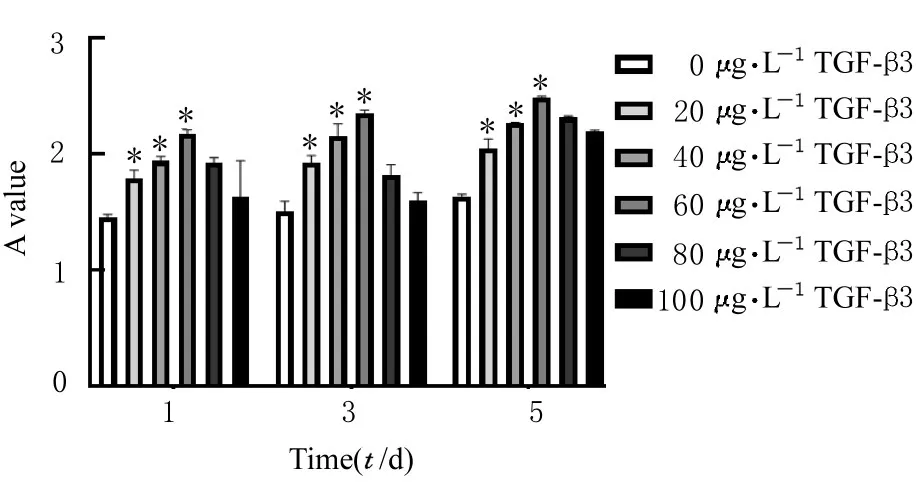
图6 TGF-β3-HepMA中TGF-β3的最适浓度Fig.6 Optimal concentration of TGF-β3 in TGF-β3-HepMA
2.4 药物释放曲线 为了验证60 μg·L-1TGF-β3-HepMA的药物释放能力,收集不同时间段细胞上清采用ELISA法检测细胞上清中TGF-β3的含量,计算 TGF-β3的累计释放量。TGF-β3-HepMA 体外释放曲线见图7,在模拟体液中,药物释放经历了2个阶段,分别为TGF-β3突释阶段(0~7 d)和 TGF-β3缓释阶段 (8~21 d),之后逐渐达到平衡。
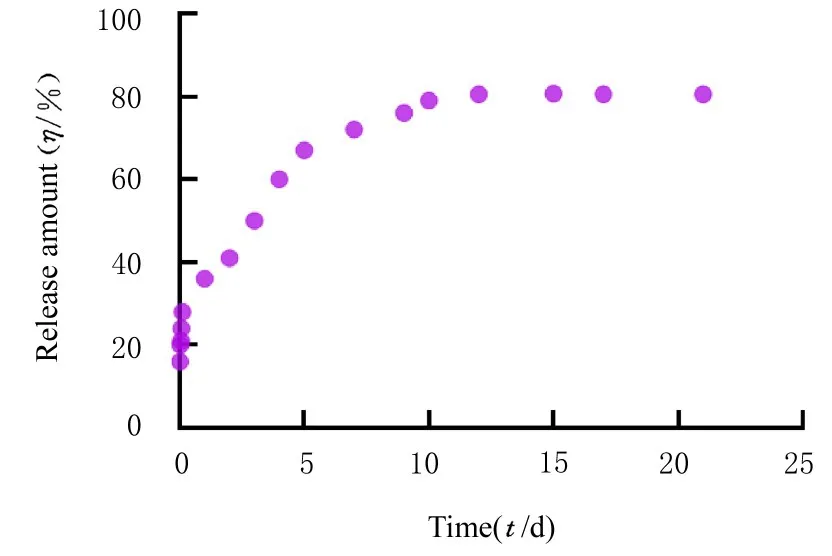
图7 TGF-β3-HepMA中TGF-β3的释放曲线Fig.7 Release curve of TGF-β3 in TGF-β3-HepMA
2.5 成骨诱导后各组hDPSCs的ALP染色情况 hDPSCs成骨诱导分化7和14 d后,与对照组和HepMA组比较,TGF-β3-HepMA组hDPSCs中可见大量散在胞质内的蓝紫色颗粒,ALP染色呈阳性,且细胞ALP染色面积最大,14 d时ALP染色面积较7 d时明显增加。见图8。
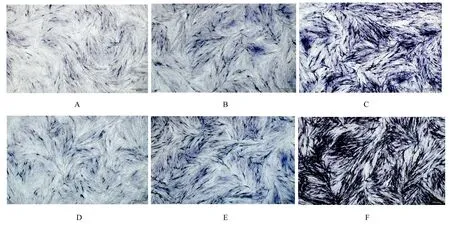
图8 成骨诱导7 d(A-C)和14 d(D-F)时各组hDPSCs的 ALP染色结果(×4)Fig.8 ALP staining results of HDPSCs of in various groups at 7 d(A-C)and 14 d(D-F)after osteogenesis induction(×4)
2.6 成骨诱导后各组hDPSCs钙结节形成情况 成骨诱导分化21 d后,各组hDPSCs经茜素红染色均有红染钙结节形成。与对照组和HepMA组比较, TGF-β3-HepMA组hDPSCs中钙结节面积明显增加。见图9。

图9 成骨诱导21 d后各组hDPSCs钙结节形成情况(茜素红)Fig.9 Calcium nodule formation of HDPSCs in various groups at 21 d after osteogenesis(Alizarin red)
2.7 各组细胞中成骨相关因子mRNA表达水平
培养第7和14天时,与对照组比较,HepMA组和 TGF-β3-HepMA组hDPSCs中 Runx2、ALP、OCN和COL-ⅠmRNA表达水平明显升高(P<0.05或P<0.01);与 HepMA 组比较,TGF-β3-HepMA组 hDPSCs中 Runx2、ALP、OCN和COL-Ⅰ mRNA表达水平明显升高(P<0.05)。培养第14天时各组hDPSCs中上述成骨相关因子mRNA表达水平较第7天时进一步升高。见图10。

图10 培养第7天(A)和第14天(B)时各组hDPSCs中成骨相关因子mRNA表达水平Fig.10 Expression levels of osteogenic related factors in hDPSCs in various groups on 7th day(A)and 14th day(B)of culture
3 讨 论
颌面部骨组织缺损的修复方式是目前研究的热点,传统修复方式(自体骨移植和异体骨移植)[10]存在许多缺点和不足[11-12],随着医学的发展,骨组织工程学联合再生医学成为骨组织修复的首选。
大多数学者在骨组织工程学中采用骨髓间充质干细胞,但有研究[13-14]显示:与骨髓间充质干细胞比较hDPSCs具有更好的克隆形成能力、增殖能力和成骨向分化能力,同时hDPSCs起源于神经嵴的外胚间充质,与颌面部骨组织具有相同的组织来源,因此选用hDPSCs作为颌面骨缺损种子细胞具有更丰富的分化潜能和同源优越性。
转 化 生 长 因 子 (transforming growth factor,TGF)家族是再生医学领域中经典的生长因子家族,作为多功能细胞因子,参与广泛的生物过程的调节,包括细胞增殖和细胞分化等[15]。TGF-β家族包括 TGF-β1、TGF-β2 和 TGF-β3,能够促进间充质干细胞增殖和早期分化成为成骨细胞、软骨细胞、脂肪细胞和肌腱细胞[16]。研究[17-18]显示:TGF-β3能够募集内源的间充质细胞发起骨再生,诱导软骨内骨形成并完成骨重塑,在成骨过程中发挥重要作用,是修复骨组织缺损的选择性生物活性分子。
组织工程学中要求载体材料具有良好的生物相容性和稳定的化学性质。肝素是一种糖胺聚糖和硫酸乙酰肝素的结构类似物,其分子上的负电荷基团能与生长因子等蛋白质有较强的静电相互作用[19],因此肝素可以吸附生长因子并提高其生物稳定性。研究[20]显示:HepMA为双键改性肝素更利于生长因子的富集和释放,被广泛应用于组织工程支架和缓释系统。
本研究以HepMA作为TGF-β3的载体,药物释放结果显示:将TGF-β3加载到HepMA中缓释效果极佳;TGF-β3-HepMA中TGF-β3在0~60 μg·L-1累计释放浓度范围以剂量依赖的方式促进hDPSCs增殖,当累计释放浓度大于 60 μg·L-1时促增殖作用开始下降。验证成骨作用的主要指标为ALP染色、钙结节形成以及成骨相关因子ALP、COL-Ⅰ、Runx2和OCN等的表达情况。本研究结果显示:TGF-β3-HepMA组细胞中ALP染色和钙结节形成明显高于对照组和HepMA组;同时RT-qPCR法检测结果显示:与对照组和HepMA组比较,成骨诱导7 d时成骨早期的标志因子ALP和Runx2 mRNA表达水平明显升高,14 d时其他成骨因子COL-Ⅰ和OCN mRNA表达水平也明显升高。本研究结果表明:将TGF-β3加载于HepMA中更利于TGF-β3的释放和发挥作用,60 μg·L-1TGF-β3-HepMA 对hDPSCs的成骨分化具有更好的促进作用。
综上所述,TGF-β3-HepMA可以通过促进成骨相关因子的表达进而提高hDPSCs的成骨分化能力,本研究结论为利用组织工程学修复颌面骨组织缺损提供了理论依据。

