SH-6联合CHKA基因沉默对胶质瘤细胞增殖及侵袭的影响①
黄 灵 邹有瑞 李琢琦 岳芳倩 马 辉 (宁夏医科大学临床医学院,银川 750004)
胶质瘤是中枢神经系统中最常见的恶性肿瘤之一,约占中枢神经系统原发性恶性肿瘤的80%[1-2]。近年来,虽然医疗技术发展迅速,但胶质瘤治疗的主要方式仍然停留在手术切除辅助放化疗阶段,即便是采取了先进的综合治疗措施,患者仍然容易出现复发、耐药、转移[3]。胆碱激酶α(cho⁃line kinase alpha,CHKA)在肯尼迪途径中是一种将游离胆碱磷酸化为磷酸胆碱的酶[4]。胆碱是合成磷脂所必需的底物,磷脂酰胆碱是膜和底物的主要磷脂成分之一,同时也是细胞大量增殖和合成脂质信号分子的基本底物;研究发现在肿瘤细胞内磷酸胆碱的浓度明显增高[5]。磷酸胆碱是细胞内维持磷脂酸产生所必需的;磷脂酸是磷脂酶D2裂解磷脂酰胆碱产生的代谢产物之一,同时也是磷脂酰肌醇3-激酶PI3K/AKT 存活信号通路的关键激活因子[6]。与此同时,肿瘤内部各信号通路及各个代谢通路之间存在错综复杂的相互作用。这就是临床上在使用单一药物抗肿瘤时,肿瘤可在较短的时间内对药物形成耐受的原因。正是这些错综复杂的因素使得科研和抗肿瘤临床药物治疗都变得极其困难和复杂。这些综合性因素提示无论是在科研,还是在临床上采用单一的药物抗肿瘤的效果可能不理想。基于此,本研究通过利用新型AKT抑制剂SH-6联合慢病毒沉默CHKA基因在体内外干预脑胶质瘤细胞并探讨影响胶质瘤生长的作用机制,为今后胶质瘤联合靶向药物治疗提供理论依据。
1 材料与方法
1.1 材料 U87细胞购自中科院上海细胞库;兔抗人CHKA、AKT、GAPDH、p-AKT、PI3K、p-PI3K 蛋白抗体购自Abcam 公司;二抗购自北京中桥生物科技公司;多聚甲醛(4%)购自上海索莱宝公司;DMEM、胎牛血清(fetal bovine serum,FBS)购自Gibco 公司;胰蛋白酶、结晶紫和双抗购自上海碧云天有限公司;二幸可宁酸(bicinchoinic acid,BCA)蛋白定量检测试剂盒购自江苏凯基公司;Transwell 小室购自康宁公司;基质胶购自BD 公司;CCK-8 细胞凋亡及细胞周期检测试剂盒购自同仁公司;DMSO 购自MP生物医疗公司;电泳仪、转膜仪购自Bio-Rad 公司;CHKA 沉默慢病毒及其对照组慢病毒购自北京合生基因生化技术有限公司;实验用裸鼠购自北京维通利华实验动物技术有限公司,饲养于宁夏医科大学实验动物中心,体质量250~320 g,日龄21~34 d,SPF级BALB/c 雌性大鼠,许可证号:SCXK(京)2016-0006。
1.2 方法
1.2.1 细胞培养 37 ℃水浴锅内迅速复苏胶质瘤U87细胞,将冻存管经消毒后置于超净工作台中,向冻存管中加入1 ml 培养基并离心500 r/min,5 min,弃上清。加入5 ml DMEM(含5%FBS)培养基后,将细胞与培养基混匀后转移至T25培养瓶中做“井”字形晃动使肿瘤细胞均匀铺于瓶内,置于37 ℃、5%CO2恒温恒湿培养箱内培养。待细胞长至总体积约80%时,加入不含EDTA 胰蛋白酶消化并传代。待传3~5 代胶质瘤细胞稳定后,取适量胶质瘤细胞进行后续实验。
1.2.2 慢病毒转染 取对数生长期的U87 细胞以2×106个/孔接种于6 孔板,培养24 h 贴壁后,根据慢病毒使用说明书,分别向6 孔板中加入1 ml 含20µl CHKA 沉默慢病毒及对照组慢病毒。放入培养箱中继续培养12 h。更换培养基,继续培养48 h后,使用荧光显微镜观察慢病毒荧光在胶质瘤细胞中的表达情况;若转染后表达慢病毒荧光的胶质瘤细胞数占未表达细胞数的80%以上,则可进行后续实验。若转染上荧光的细胞小于80%,则需要用嘌呤霉素对胶质瘤细胞进行筛选后进行后续实验。
1.2.3 肿瘤细胞体内外分组 慢病毒转染成功,可进行后续实验。体外实验分组:①Control 组:该组培养未感染慢病毒的胶质瘤细胞;②shNC 组:在该组中培养转染有对照慢病毒的U87 细胞;③SH-6组:向该组培养未感染慢病毒的U87 细胞中加入SH-6 溶液(10 µmol/ml)进行干预处理;④shCHKASH-6 组,即转染CHKA 沉默慢病毒12 h 后向该组中加入SH-6溶液。
体内实验分组:①DMSO 组:向该组裸鼠移植未感染慢病毒的U87 细胞100µl 后,使用DMSO 10µl对肿瘤进行干预处理;②shNC 组:向该组裸鼠移植转染有对照慢病毒的U87细胞100µl;③SH-6组:在该组裸鼠皮下移植未感染慢病毒的U87细胞100µl后,使用SH-6 10 µl 对肿瘤进行干预治疗;④shCHKASH-6 组:向该组裸鼠中移植有沉默慢病毒转染的U87 细胞,同时使用SH-6 10 µl 对肿瘤进行干预治疗。其中每组各6 只裸鼠。待肿瘤长到5~10 mm3时,DMSO组只用DMSO 10µl干预处理;shNC组不予任何处理;SH-6 组及shCHKA-SH-6 组用SH-6 10 µl进行治疗,每组均干预治疗3 d/次。称量各组裸鼠体质量及测量胶质瘤的长径(L)及宽径(W),肿瘤体积(V)=(LW2)/2,经测量后计算各组肿瘤大小(mm3)及体质量的平均值,绘制肿瘤在30 d 内的生长曲线并统计分析。
1.2.4 CCK-8 法检测U87 细胞的增殖能力 用胰蛋白酶将贴壁细胞从培养瓶壁上消化使其脱落并制成单细胞悬液,用培养基稀释至细胞数为3×102个/ml。向96 孔板中加入100 µl 细胞悬液,每组设置3个复孔,置于37 ℃、5%CO2湿式培养箱培养贴壁,分别在24 h、48 h、72 h 时向每孔中加入10 µl CCK-8试剂,继续培养2 h。使用酶标仪检测不同时间点在450 nm处的OD值进行数据统计分析。
1.2.5 流式细胞术检测细胞周期 用不含EDTA的胰蛋白酶消化贴壁的U87 细胞重悬成单细胞悬液,收集适量的单细胞悬液到1.5 ml EP 管内,向每管中加入约0.5 ml 预冷染色缓冲液,重悬细胞并重复1 次。1 000 r/min 离心3~5 min。弃上清,加入0.5 ml 培养基重悬细胞。最后加入4 µl 的Red NucleusⅠ染色液,缓慢并充分混匀,在避光常温条件下孵育20 min后上机检测。
1.2.6 流式检测细胞凋亡 用不含EDTA 的胰蛋白酶消化并收集贴壁的U87 细胞,PBS 清洗2 遍,弃上清,在冰浴条件下加入5µl Annexin V-PE 和10µl 7-AAD并轻柔混匀,上机检测并分析。
1.2.7 Transwell 实验检测U87 细胞侵袭能力 将基质胶(Matrigel)按试剂盒说明以1∶8 的比例稀释。向小室上室加入50µl稀释过的基质胶,置于4 ℃冰箱晾干(无菌条件)。取2×105个/ml细胞悬液200µl于小室上室,下室加入正常培养基,培养24 h。取出小室,用棉签擦去小室上室中的细胞和基质胶,多聚甲醛(40 g/L)固定30 min;0.1%结晶紫溶液染色10 min后,用显微镜观察不同视野下的细胞并计数。
1.2.8 肿瘤组织免疫化学染色 第30 天时,颈椎脱臼法处死裸鼠,用无菌剪刀剪开皮肤,镊子小心取出各组胶质瘤组织,去除周围脂肪并剪至适量大小,置于4%多聚甲醛中固定24 h。进行包埋、切片、在72 ℃恒温箱中烘烤2 h,脱蜡及抗原修复之后,封闭2 h,加入相应的一抗并孵育2 h,加抗体增强液20 min 后,依次加二抗,约30 min 后,加入DAB显色液及苏木素常规复染后,进行常规封片,干燥后显微镜下观察。
1.2.9 Western blot 检测相关蛋白 提取胶质瘤细胞及肿瘤组织总蛋白,用BCA 法检测总蛋白的浓度。以30µg/孔的上样量进行SDS-PAGE 电泳分离蛋白质,将凝胶上分离的蛋白在270 mA、2 h 条件下转至PVDF 膜上,封闭2 h。用PBST清洗3遍。加入一抗(1∶1 000)、兔抗人GAPDH 抗体(1∶5 000),4 ℃摇床上过夜;第2 天,PBST 清洗3 遍,加入相应种属的二抗室温下孵育1 h;用PBST清洗后,使用ECL发光液曝光,检测蛋白条带的吸光度(A)值。CHKA相对表达量=ACHKA/AGAPDH。
1.3 统计学处理 数据分析处理采用Capture 2.1、Image Lab 和GraphPad Prism 8 软件。组间比较使用t检验,数据统计结果以±s表示。多个样本间比较用单因素方差分析,P<0.05代表差异具有统计学意义。
2 结果
2.1 联合治疗抑制U87细胞增殖能力 根据CCK-8在450 nm 处A 值可以得出,与Control 组、shNC 组、SH-6 组相比,shCHKA-SH-6 组细胞在24 h、48 h 及72 h 的增殖速度明显降低(P<0.05),而Control 组、shNC 组、SH-6 组基本保持同步增加,组间比较差异无统计学意义(P>0.05)。见图1。

图1 U87细胞增殖能力变化Fig.1 Changes in proliferation ability of U87 cells
2.2 联合治疗对U87 细胞周期的影响 结果显示各组细胞G2期细胞的占比分别为:shCHKA-SH-6 组(27.5±0.3)% 、Control 组(4.3±3.2)% 、shNC 组(9.4±0.7)%、SH-6 组(10.9±0.4)%,shCHKA-SH-6组处于G2期的细胞数量明显增多(P<0.05),结果表明:SH-6 联合CHKA 基因干扰表达能够使细胞停滞在G2期并抑制细胞增殖。见图2。
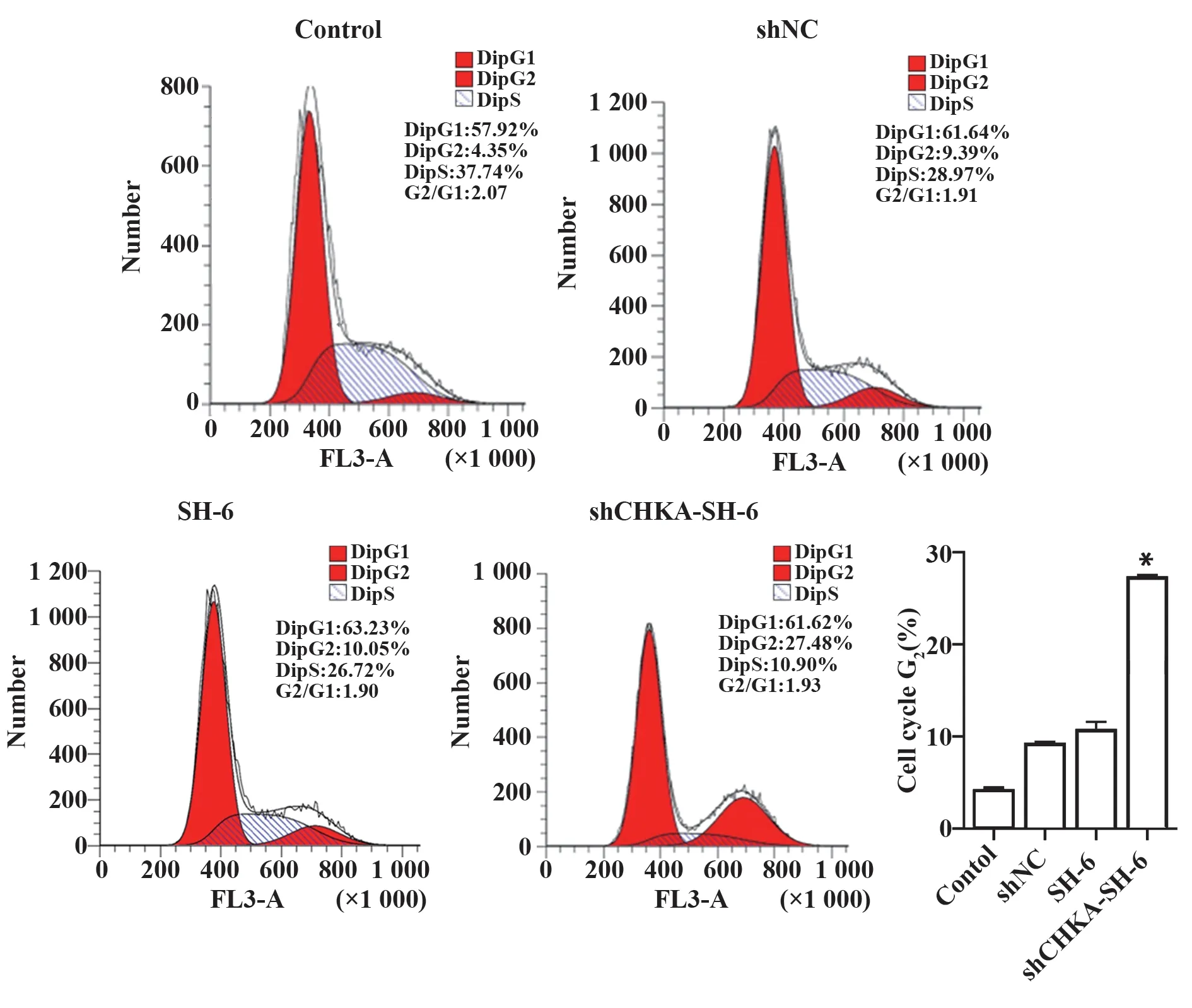
图2 各组细胞周期占比情况及统计结果Fig.2 Cell cycle situation and statistical results of eachgroup
2.3 SH-6 联合下调CHKA 促进细胞凋亡 流式细胞仪检测各组细胞凋亡率分别为:Control 组(1.90±0.04%)、shNC 组(4.90±0.04)%、SH-6 组(8.80±0.06)%、shCHKA-SH-6 组(12.80±0.10)%。提示SH-6 联合下调CHKA 能诱导凋亡,差异具有统计学意义(P<0.05)。见图3。

图3 各组细胞凋亡结果及统计分析Fig.3 Apoptosis results and statistical analysis of each group
2.4 Transwell 实验检测细胞侵袭能力 各组穿透的细胞数分别为:shCHKA-SH-6组(449.3±17.5)个、Control 组(1 359.0±33.3)个、shNC 组(1 353.0±35.4)个、SH-6 组(877.3±21.5)个,shCHKA-SH-6 组与其他3 组相比,差异具有统计学意义(P<0.01)。见图4。

图4 Transwell实验结果及统计分析(结晶紫染色,×100)Fig.4 Transwell experimental results and statistical analysis(Crystal violet dyeing,×100)
2.5 肿瘤体积生长情况 经过计算各组肿瘤平均体积分别为:DMSO 组(710.2±109.7)mm3、shNC 组(722.9±112.1)mm3、SH-6 组(500.7±67.7)mm3、sh-CHKA-SH-6组(211.7±25.9)mm3。结合图片及计算结果可知:shCHKA-SH-6 组皮下肿瘤体积明显小于其他3 组,差异有统计学意义(P<0.05),表明SH-6联合CHKA 基因沉默在体内能明显抑制肿瘤的生长。见图5、图6。

图5 肿瘤组织在体内生长情况Fig.5 Growth of tumor tissue in vivo
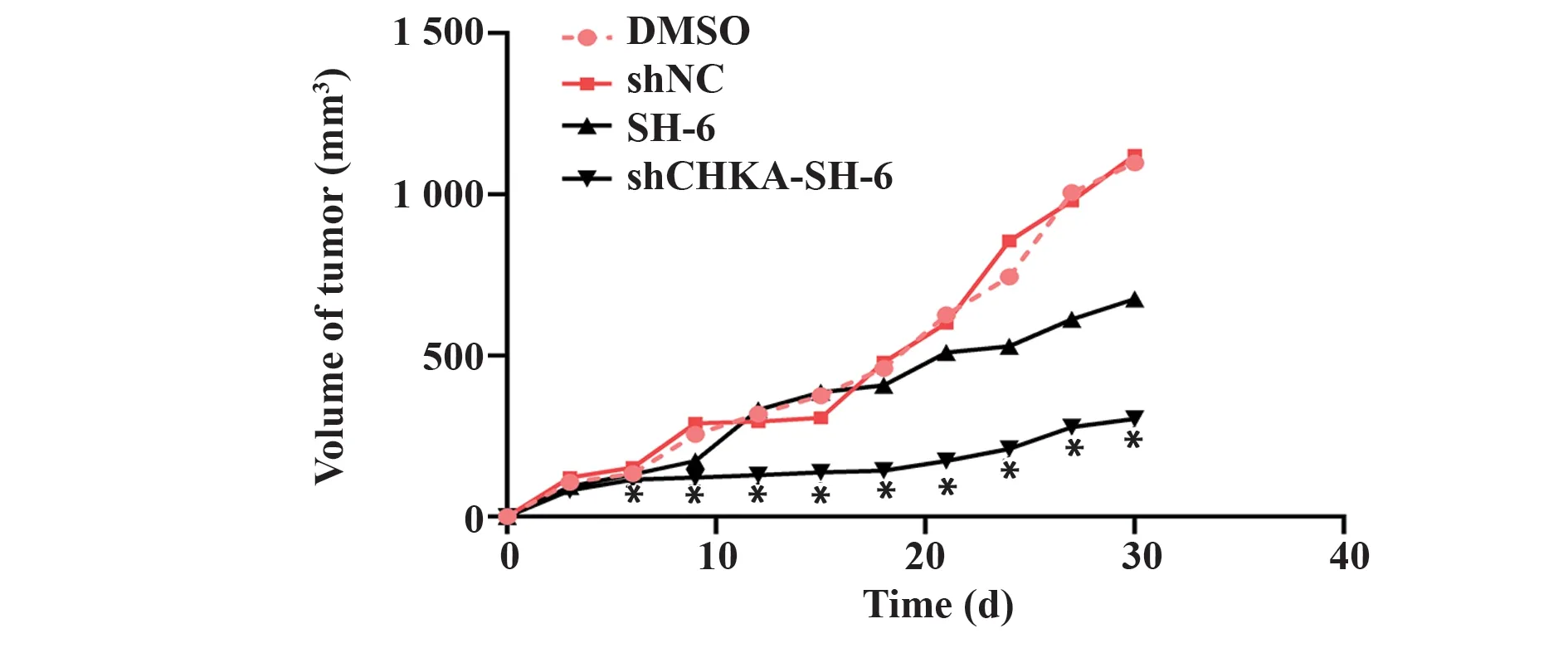
图6 肿瘤组织体内生长曲线Fig.6 In vivo growth curve of tumor tissue
2.6 免疫组化检测结果 免疫组化结果显示:与DMSO 组、shNC 组、SH-6 组相比,shCHKA-SH-6 组胶质瘤组织中CHKA、PI3K/AKT 通路中关键蛋白表达水平明显降低(P<0.05),这表明SH-6联合CHKA基因沉默能有效抑制胶质瘤中CHKA、PI3K/AKT 信号通路中相关蛋白的表达。另外,在SH-6 组中CHKA蛋白表达量比其他3 组高(P<0.05),这说明使用SH-6 能够抑制PI3K/AKT 信号通路中相关蛋白表达的同时,PI3K/AKT通路中相关蛋白的降低不会反馈性地抑制CHKA的表达。见图7。
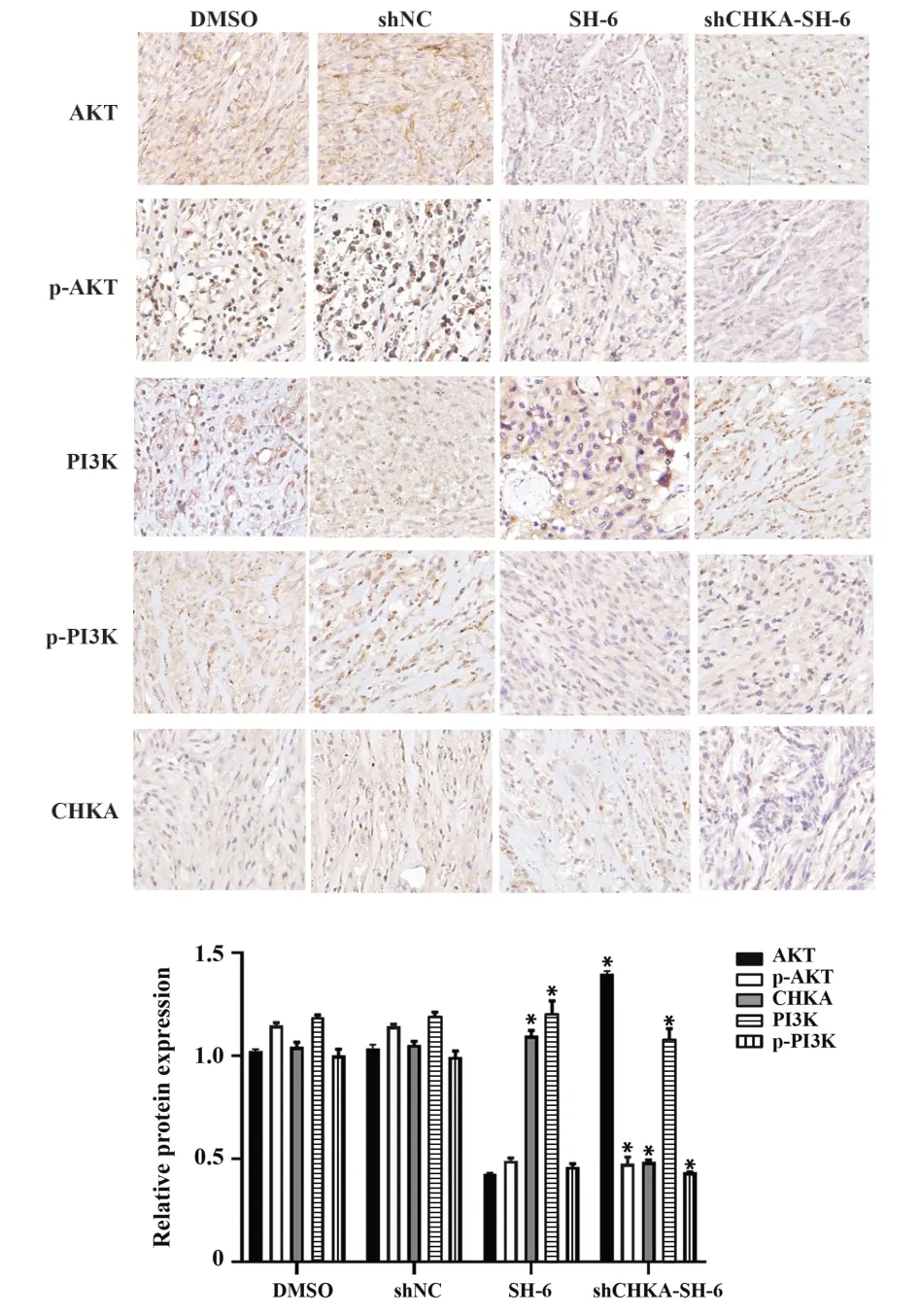
图7 各组CHKA、AKT、p-AKT、PI3K、p-PI3K 免疫组化染色及统计情况Fig.7 CHKA,AKT,p-AKT,PI3K,p-PI3K immunohisto⁃chemical stainings and statistical analysis of each group
2.7 Western blot 检测各组细胞蛋白表达情况
2.7.1 体外实验Western blot 实验结果显示:与Control组、shNC组、DMSO组、SH-6组相比,shCHKASH-6组胶质瘤组织中CHKA、PI3K/AKT 通路中相关蛋白表达水平明显降低(P<0.05);在SH-6组中,PI3K/AKT 通路中相关蛋白表达量降低,而CHKA 的表达量不受通路抑制剂SH-6的影响(P>0.05)。见图8。

图8 CHKA 对U87 细胞PI3K/AKT 通路蛋白表达水平的影响及统计结果Fig.8 Effect of CHKA on expression levels of PI3K/AKT pathway proteins in U87 cells and statistical results
2.7.2 体内实验Western blot 实验结果显示:shCHKA-SH-6 组胶质瘤组织中CHKA、PI3K/AKT 通路中关键蛋白表达水平明显降低(P<0.05),这与体外实验结果相一致;在SH-6 组中,CHKA 蛋白的表达与其他蛋白相比差异无统计学意义(P>0.05)。结果表明CHKA 通过能够抑制PI3K/AKT 信号通路促进胶质瘤生长、转移等生物学功能。见图9。

图9 肿瘤组织中CHKA、PI3K、AKT、p-PI3K、p-AKT蛋白表达及统计情况Fig.9 Expressions and statistical analysis of CHKA,PI3K,AKT,p-PI3K and p-AKT in tumor tissues
3 讨论
胶质瘤发生发展与多种因素有关,如NOK、CMTM6、促血管生成因子等,这些综合性因素导致胶质瘤有较强的侵袭性和转移性,同时也是导致患者预后不良的主要原因[7-10]。因此,在保护正常脑组织的前提下,如何最大程度地诊断肿瘤的边界和彻底切除胶质瘤成为当前研究重点。核磁共振(magnetic resonance imaging,MRI)是常用的诊断脑胶质瘤的辅助检查,但却不能明确诊断肿瘤边界及肿瘤边界处肿瘤细胞代谢物的变化情况,因此MRI在脑部肿瘤的边界具有一定的局限性。然而,多体素1H-MRS 的出现就弥补了MRI 的这一不足,它能够无创性地检测并分析胶质瘤及脑组织之间具有差异的代谢物,利用该代谢物[如:胆碱/肌酸(Cho/Cr)]的差异来评估和明确肿瘤的边界,该诊断能够从分子水平上对肿瘤的边界进行诊断,有望成为MRI 的有力补充[11-14]。本课题组在前期实验研究中发现:Cho/Cr在胶质瘤细胞中明显高于正常脑组织,因此使用多体素1H-MRS 作为辅助指导切除胶质瘤可以更加有效地切除脑胶质瘤,能够明显改善患者的预后和提高生活质量[15-16]。
CHKA 是在肯尼迪代谢通路中参与胆碱代谢的第一个关键酶,并调节磷脂酰胆碱(PC)合成。磷脂酰胆碱是肿瘤细胞膜重要组成部分之一,主要通过该代谢途径从头合成,此外,胆碱代谢后生成的产物及催化酶本身对肿瘤细胞的生长起到正反馈作用[17-18]。因此,CHKA 基因被认为是新的癌基因产物。PI3K/AKT(磷脂酰肌醇-3 激酶/蛋白激酶B)信号通路由磷酸化磷脂酰肌醇3羟基的脂类激酶活性PI3K 及下游AKT 组成,分为Ⅰ型、Ⅱ型和Ⅲ型。研究表明,AKT 致癌基因的激活可促进细胞转化,并影响肿瘤的发生发展[19-20]。因此,AKT 被认为是有效的药物干预靶点[21]。在经过几十年AKT 抑制剂合成及大量的临床试验,如Perifosine、GSK2110183和RX-0201进入了Ⅰ期和Ⅱ期临床试验。这些临床试验证明,合成的磷脂酰肌醇磷酸酯(PIA)类似物能有效阻断肿瘤细胞中的AKT 活性[22-23]。因此,本研究使用了最新人工合成的磷脂酰肌醇磷酸类似物(SH-6),因为SH-6 在肌醇环的第三位缺失羟基,并且有能够修饰的脂肪族侧链,具有更高的代谢稳定性。经过体内外实验证明,通过SH-6 联合CHKA基因敲除策略能够使CHKA 表达降低干扰AKT 的激活,从而诱导细胞凋亡,使肿瘤细胞停滞在G2期并抑制肿瘤细胞生长,增殖能力下降,凋亡增加,作为一种重要的凋亡信号通路,PI3K/AKT在抑制胶质瘤细胞凋亡和促进细胞增殖中发挥重要作用,这一机制有可能与阻止AKT 与磷脂酰肌醇结合有关[24],但是只使用SH-6 干预胶质瘤细胞时却发现,PI3K/AKT信号通路中关键因子减少的同时CHKA却无明显变化,这一现象说明CHKA对PI3K/AKT信号通路的调控可能是单向性的,PI3K/AKT 信号通路对CH⁃KA并无负反馈作用。
综上所述,CHKA 通过调控PI3K/AKT 信号通路中的关键信号分子在胶质瘤细胞中的表达,从而抑制胶质瘤细胞的增殖、迁移和侵袭,增加细胞凋亡等生物学功能。通过实验证明CHKA 与PI3K/AKT信号通路在胶质瘤的发生和发展中具有相互作用。CHKA 的敲低至少能够通过PI3K/AKT 信号通路的失活抑制人脑胶质瘤细胞的增殖和侵袭,这为人脑胶质瘤的精准靶向治疗提供了一定的分子依据及理论基础。

