miR-125b对过敏原刺激后支气管上皮细胞凋亡和分泌炎症因子的作用
肖惠玲 李艳红 赵 申 李俊杰 (湖北文理学院附属医院,襄阳市中心医院儿科,襄阳 441000)
支气管哮喘是一种十分常见的呼吸系统炎症性疾病,不同患者哮喘严重程度差距明显,目前临床上用于哮喘治疗的药物主要是糖皮质激素等,部分患者经这些药物治疗后症状明显改善,但有些患者出现激素抵抗,治疗效果不佳现象[1]。免疫-炎症反应、支气管上皮细胞过度凋亡等是目前公认的哮喘发病机制[2]。近年来,哮喘已被证实是由多种基因调控引起,且分子靶向治疗也成为哮喘治疗的潜在途径[3]。miRNA 的长度为20~24 nt,是一种内源性的小分子RNA,没有编码蛋白质的作用,其主要通过影响下游靶基因和信号通路发挥作用[4]。miRNA不仅与胚胎发育和机体稳态维持有关,还与炎症、细胞凋亡、细胞生长、肿瘤等进程关系密切[5]。miR-125b 为miR-125 家族成员,也是miR-125 家族中较为活跃的成员,miR-125b 在肿瘤、脑梗死、阿尔茨海默病等进展中发挥调控作用[6]。既往研究显示,miR-125b 与哮喘有关,在哮喘患者中发现miR-125b表达下调,且上调miR-125b能够抑制尘螨诱导的哮喘小鼠气道炎症[7]。现阶段仍不明确miR-125b在过敏原刺激后支气管上皮细胞凋亡和炎症因子分泌中的作用。有研究发现,miR-125b 抵抗骨关节炎软骨细胞炎症分泌与下调NF-κB 信号有关[8]。NF-κB 信号通路在人体组织中广泛存在,是典型的炎症反应枢纽,其激活能够诱导下游炎症因子释放,促进炎症反应[9]。另外,NF-κB 还参与调控细胞凋亡过程,是一个多功能信号通路[10]。本实验以尘螨抗原提取物刺激支气管上皮细胞系16HBE 进行体外研究,探讨miR-125b 在哮喘支气管上皮细胞凋亡和分泌炎症因子中的作用和可能机制,为分子靶向治疗哮喘提供思路。
1 材料与方法
1.1 材料 支气管上皮细胞系16HBE 购自通派(上海)生物科技有限公司;mimics control、miR-125b mimics购自百奥迈科生物技术有限公司;Lipo⁃fectamine2000 试剂盒购自上海源叶生物科技有限公司;Bax 抗体、p65 抗体购自美国Santa Cruz;Bcl-2抗体购自美国BioVision;IL-29检测试剂盒购自美国Abcam;IL-6 检测试剂盒购自美国Cayman Chemical;尘螨抗原提取物(安脱达)购自丹麦ALK-Abello A/S。
1.2 方法
1.2.1 细胞转染处理 支气管上皮细胞接种于6 孔板,以不含青链霉素的细胞培养液培养,24 h 后观察细胞密度为80%,转染mimics control、miR-125b mimics。转染试剂为Lipofectamine2000,转染步骤按照转染试剂说明书进行。支气管上皮细胞分为Control 组、Model 组、miR-NC 组、miR-125b 组,miR-NC 组、miR-125b 组在用300 U/L 尘螨抗原提取物刺激前转染mimics control、miR-125b mimics。Control 组、Model 组均为没有转染的正常支气管上皮细胞,Model 组细胞用300 U/L 尘螨抗原提取物刺激。各组细胞培养24 h以后,用于后续实验检测。
1.2.2 qRT-PCR 分析miR-125b 表达 在Control组、Model 组、miR-NC 组、miR-125b 组细胞中添加1 ml TRIzol试剂,按照常规方法提取细胞RNA,RNA溶解于0.1%的DEPC 水。以微量紫外分光光度计测定OD260/OD280,分析RNA 的浓度和纯度,RNA 置于-80 ℃冰箱内保存。分别在EP 管内添加如下试剂进行cDNA 合成:2µl 5×PrimeScript Buffer、0.5µl PrimeScript RT Enzyme mixⅠ、0.5µl RT引物、300 ng总RNA,最后添加RNAse Free dH2O 至10 µl,cDNA合成条件为:37 ℃15 min,85 ℃5 s,4 ℃1 min。PCR 反应体系为:5 µl SYBR Premix Ex Taq、0.2 µl ROX Reference DyeⅡ、1.0 µl cDNA、0.5 µl 正向引物和反向引物,最后添加ddH2O 至10µl。PCR 仪设置反应程序为:预变性(95 ℃30 s,1 个循环),PCR反应(95 ℃5 s,60 ℃34 s,40 个循环)。根据反应的Ct 值,以2-ΔΔCt法计算miR-125b 的表达变化。miR-125b F:5'-TGAAGAACTGTCCTTACGTGACC-3',miR-125b R:5'-AGAGCACCAAGACTGGCTCT-3';U6 F:5'-TTGGTATCGTGGAAGGACTCA-3',U6 R:5'-TGT⁃CATCATATTTGGCAGGTT-3'。
1.2.3 流式细胞术分析细胞凋亡 在Control、Model、miR-NC、miR-125b组细胞中加入0.25%的胰蛋白酶消化细胞,1 000 g 离心10 min,弃上清液,添加提前预冷的PBS 溶液洗涤细胞2 次。每组收集1×106个细胞,添加结合缓冲溶液400µl,吸取5µl PI和Annexin V-FITC溶液至细胞中,置于室温、避光环境中结合15 min。流式细胞仪检测各组细胞凋亡情况。
1.2.4 ELISA 分析IL-6、IL-29 水平 收集Control、Model、miR-NC、miR-125b组细胞培养液上清,ELISA法检测上清中IL-6、IL-29 含量,步骤完全参照IL-6、IL-29检测试剂盒。
1.2.5 Western blot 分析Bax、Bcl-2、p65 蛋白表达变化 在Control、Model、miR-NC、miR-125b 组细胞中加入以1∶99比例添加PMSF后的RIPA溶液,用移液器反复吹打混合后,冰上静置20 min。收集裂解溶液,以14 000 g 离心10 min,将上清溶液吸取、分装后置于-80 ℃冰箱中保存。按照BCA 方法检测蛋白浓度。在蛋白样品中添加5×SDS-PAGE 缓冲溶液,二者比例为4∶1,100 ℃孵育5 min,冷却后4 ℃备用。选择10%的分离胶及4%的浓缩胶进行SDSPAGE 电泳。每个孔中添加30µg蛋白样品,上层胶采用80 V 电压电泳20 min,下层胶采用110 V 电压电泳90 min。根据目的蛋白分子量大小裁剪NC膜,设置300 mA 电流转膜,转膜时间为90 min。以TBST 洗涤NC 膜,5 min/次,共洗涤3 次。将NC 膜置于封闭液(5%牛血清白蛋白)中,室温反应2 h。将NC 膜置于一抗溶液,4 ℃孵育8 h。然后将NC 膜置于二抗溶液,室温结合2 h。Bax、Bcl-2 一抗按照1∶1 000 稀释,p65 一抗按照1∶800 稀释,二抗按照1∶4 000 稀释。ECL 显色试剂盒显色。分析条带灰度值,以GAPDH 为内参,对目的蛋白表达水平进行半定量分析。
1.2.6 激活NF-κB 信号对miR-125b 调控支气管上皮细胞凋亡和炎症因子分泌作用检测 取转染miR-125b mimics后的支气管上皮细胞,用含300 U/L尘螨抗原提取物和1 µmol/L NF-κB 信号激活剂PMA 的细胞培养液刺激24 h,记为miR-125b+PMA组,以miR-125b组为参照,按照1.2.3、1.2.4、1.2.5中流式细胞术、ELISA法、Western blot法分别检测细胞凋亡和分泌IL-6、IL-29 的水平以及Bax、Bcl-2、p65蛋白表达变化。
1.3 统计学分析 采用SPSS21.0 软件分析数据,计量资料以±s表示,两组间数据比较采用t检验,多组差异比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-125b mimics 对过敏原诱导的支气管上皮细胞中miR-125b表达的影响 Model组支气管上皮细胞中miR-125b 表达水平低于Control 组(P<0.05)。miR-125b组支气管上皮细胞中miR-125b表达水平高于miR-NC 组(P<0.05)。见表1。提示miR-125b mimics 提高过敏原诱导的支气管上皮细胞中miR-125b表达水平。
表1 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中miR-125b水平(±s)Tab.1 Level of miR-125b in bronchial epithelial cells induced by allergens after miR-125b mimics trans⁃fection(±s)
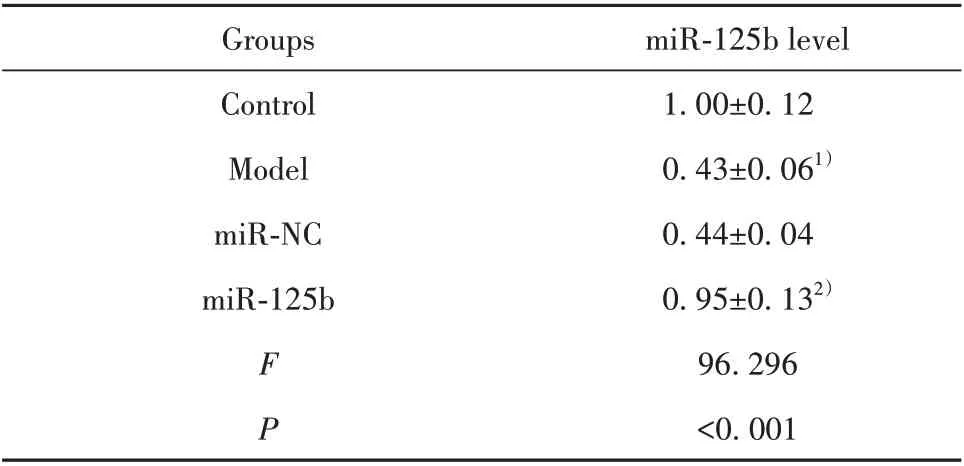
表1 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中miR-125b水平(±s)Tab.1 Level of miR-125b in bronchial epithelial cells induced by allergens after miR-125b mimics trans⁃fection(±s)
Note:Compared with Control group,1)P<0.05;compared with miRNC group,2)P<0.05.
miR-125b level 1.00±0.12 0.43±0.061)0.44±0.04 0.95±0.132)96.296<0.001 Groups Control Model miR-NC miR-125b FP
2.2 上调miR-125b对过敏原诱导的支气管上皮细胞凋亡的影响 Model 组支气管上皮细胞凋亡率升高,Bax 蛋白表达增多,Bcl-2 蛋白表达减少,与Con⁃trol组相比,差异有统计学意义(P<0.05)。miR-125b组支气管上皮细胞凋亡率降低,Bax 蛋白表达减少,Bcl-2蛋白表达增加,与miR-NC组相比,差异有统计学意义(P<0.05)。见图1、表2。提示上调miR-125b抑制过敏原诱导的支气管上皮细胞凋亡。
表2 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞凋亡率和Bax、Bcl-2蛋白水平(±s)Tab.2 Allergen-induced apoptosis rate and Bax and Bcl-2 protein levels of bronchial epithelial cells after miR-125b mimics transfection(±s)
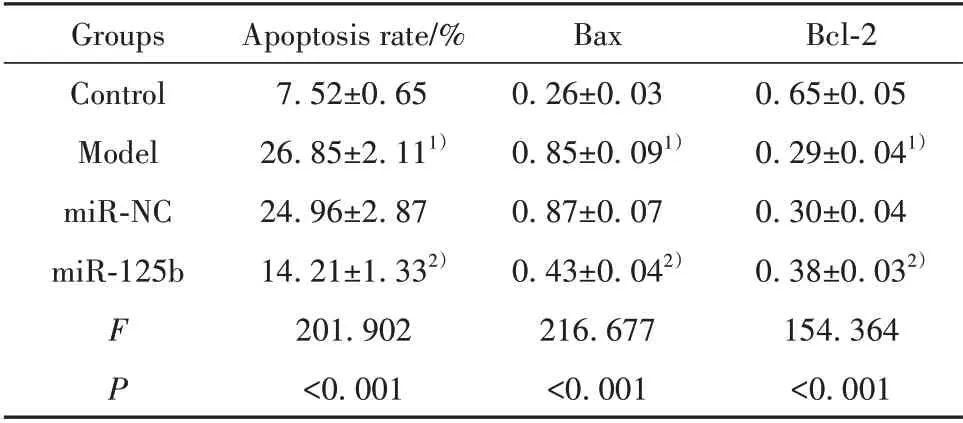
表2 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞凋亡率和Bax、Bcl-2蛋白水平(±s)Tab.2 Allergen-induced apoptosis rate and Bax and Bcl-2 protein levels of bronchial epithelial cells after miR-125b mimics transfection(±s)
Note:Compared with Control group,1)P<0.05;compared with miR-NC group,2)P<0.05.
Bcl-2 0.65±0.05 0.29±0.041)0.30±0.04 0.38±0.032)154.364<0.001 Groups Control Model miR-NC miR-125b FP Apoptosis rate/%7.52±0.65 26.85±2.111)24.96±2.87 14.21±1.332)201.902<0.001 Bax 0.26±0.03 0.85±0.091)0.87±0.07 0.43±0.042)216.677<0.001
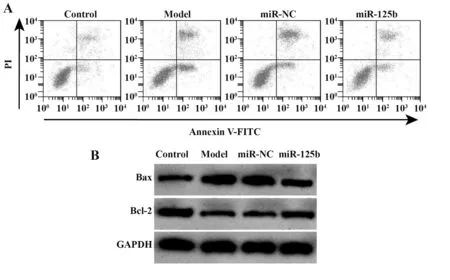
图1 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞凋亡Fig.1 Allergen-induced apoptosis of bronchial epithelial cells after miR-125b mimics transfection
2.3 上调miR-125b 对过敏原诱导的支气管上皮细胞炎症因子分泌的影响 Model 组支气管上皮细胞分泌IL-6、IL-29水平升高,与Control组相比,差异有统计学意义(P<0.05)。miR-125b 组支气管上皮细胞分泌IL-6、IL-29 减少,与miR-NC 组相比,差异有统计学意义(P<0.05),见表3。提示上调miR-125b抑制过敏原诱导的支气管上皮细胞分泌IL-6、IL-29。2.4 上调miR-125b 对过敏原诱导的支气管上皮细胞中NF-κB 信号通路的影响 Model 组支气管上皮细胞中p65蛋白表达水平升高,与Control组相比,差异有统计学意义(P<0.05)。miR-125b 组支气管上皮细胞中p65 蛋白表达水平降低,与miR-NC 组相比,差异有统计学意义(P<0.05)。见图2、表4。提示上调miR-125b 抑制过敏原诱导的支气管上皮细胞中NF-κB信号激活。
表4 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中p65蛋白水平(±s)Tab.4 Allergen-induced p65 protein level in bronchial epi⁃thelial cells after miR-125b mimics transfection(±s)
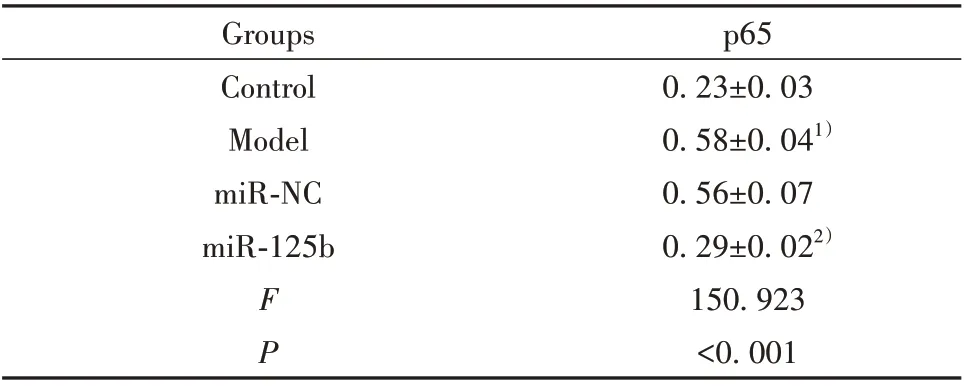
表4 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中p65蛋白水平(±s)Tab.4 Allergen-induced p65 protein level in bronchial epi⁃thelial cells after miR-125b mimics transfection(±s)
Note:Compared with Control group,1)P<0.05;compared with miRNC group,2)P<0.05.
p65 0.23±0.03 0.58±0.041)0.56±0.07 0.29±0.022)150.923<0.001 Groups Control Model miR-NC miR-125b FP

图2 Western blot 检测miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中p65蛋白表达水平Fig.2 Western blot detection of p65 protein expression in bronchial epithelial cells induced by allergens after miR-125b mimics transfection
表3 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞分泌IL-6、IL-29水平(±s,pg/ml)Tab.3 Allergen-induced IL-6 and IL-29 levels of bronchial epithelial cells after miR-125b mimics transfection(±s,pg/ml)
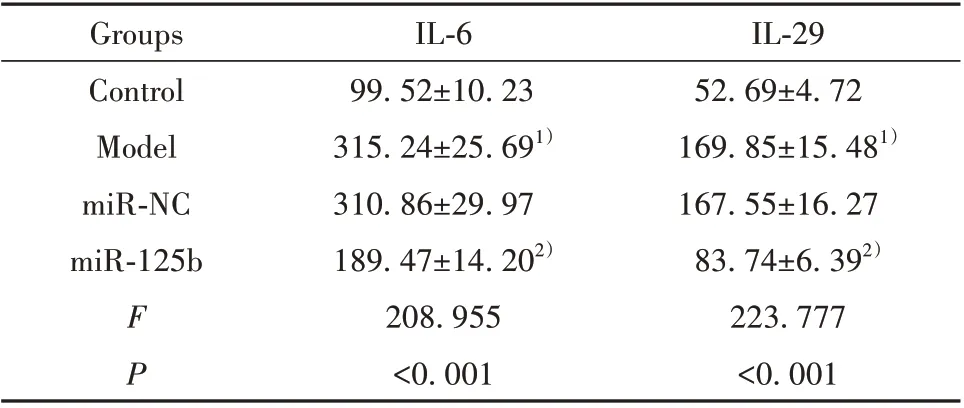
表3 miR-125b mimics 转染后过敏原诱导的支气管上皮细胞分泌IL-6、IL-29水平(±s,pg/ml)Tab.3 Allergen-induced IL-6 and IL-29 levels of bronchial epithelial cells after miR-125b mimics transfection(±s,pg/ml)
Note:Compared with Control group,1)P<0.05;compared with miR-NC group,2)P<0.05.
IL-29 52.69±4.72 169.85±15.481)167.55±16.27 83.74±6.392)223.777<0.001 Groups Control Model miR-NC miR-125b FP IL-6 99.52±10.23 315.24±25.691)310.86±29.97 189.47±14.202)208.955<0.001
2.5 NF-κB 信号激活剂PMA 促进支气管上皮细胞中NF-κB 信号激活 miR-125b+PMA 组支气管上皮细胞中p65 蛋白表达水平升高,与miR-125b 组相比,差异有统计学意义(P<0.05)。见图3、表5。提示NF-κB信号激活剂促进支气管上皮细胞中NF-κB信号激活。
表5 PMA 处理和miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中p65蛋白水平(±s)Tab.5 Levels of p65 protein in bronchial epithelial cells induced by allergens after PMA treatment and miR-125b mimics transfection(±s)

表5 PMA 处理和miR-125b mimics 转染后过敏原诱导的支气管上皮细胞中p65蛋白水平(±s)Tab.5 Levels of p65 protein in bronchial epithelial cells induced by allergens after PMA treatment and miR-125b mimics transfection(±s)
Note:Compared with miR-125b group,1)P<0.05.
p65 0.28±0.04 0.63±0.071)13.024<0.001 Groups miR-125b miR-125b+PMA tP
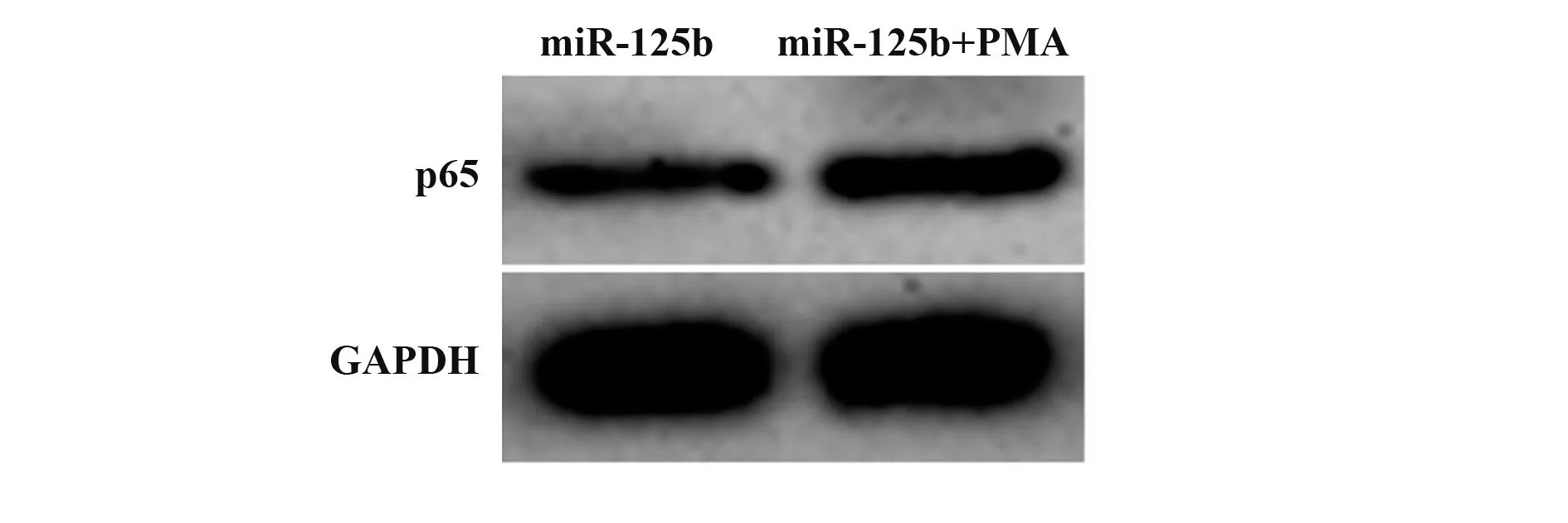
图3 Western blot检测miR-125b mimics和PMA对过敏原诱导的支气管上皮细胞中p65蛋白表达的影响Fig.3 Western blot detection of effect of miR-125b mimics and PMA on expression of p65 protein in bronchial epithelial cells induced by allergens
2.6 NF-κB信号激活剂PMA 对miR-125b影响过敏原诱导的支气管上皮细胞凋亡和分泌炎症因子的作用 miR-125b+PMA 组支气管上皮细胞凋亡率升高,细胞中Bax 蛋白表达增多,Bcl-2 蛋白表达减少,细胞分泌的IL-6、IL-29增多,与miR-125b组相比,差异具有统计学意义(P<0.05),见图4、表6。提示NF-κB 信号激活剂逆转miR-125b 影响过敏原诱导的支气管上皮细胞凋亡和分泌炎症因子的作用。
表6 PMA 处理和miR-125b mimics 转染后过敏原诱导的支气管上皮细胞凋亡率和Bax、Bcl-2 蛋白水平及细胞分泌IL-6、IL-29水平(±s)Tab.6 Allergen-induced bronchial epithelial cell apoptosis,Bax and Bcl-2 protein levels,and cell secretion of IL-6 and IL-29 levels after treatment with PMA and miR-125b mimics transfection(±s)
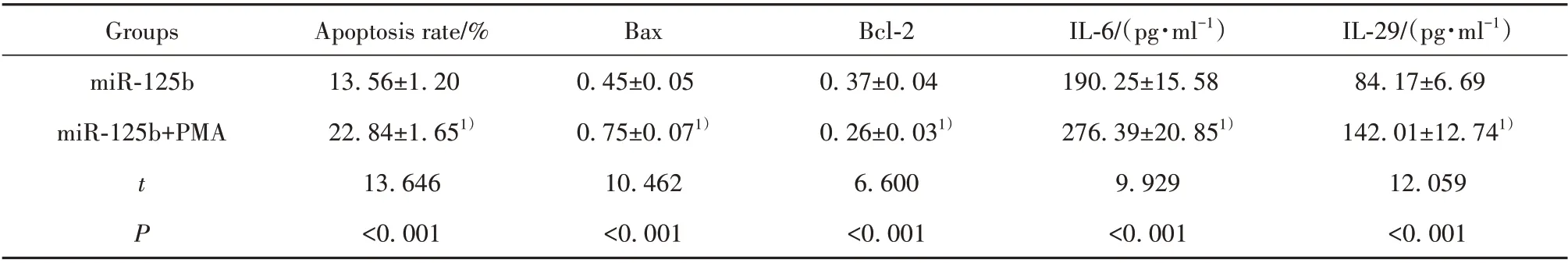
表6 PMA 处理和miR-125b mimics 转染后过敏原诱导的支气管上皮细胞凋亡率和Bax、Bcl-2 蛋白水平及细胞分泌IL-6、IL-29水平(±s)Tab.6 Allergen-induced bronchial epithelial cell apoptosis,Bax and Bcl-2 protein levels,and cell secretion of IL-6 and IL-29 levels after treatment with PMA and miR-125b mimics transfection(±s)
Note:Compared with miR-125b group,1)P<0.05.
IL-29/(pg·ml-1)84.17±6.69 142.01±12.741)12.059<0.001 Groups miR-125b miR-125b+PMA tP Apoptosis rate/%13.56±1.20 22.84±1.651)13.646<0.001 Bax 0.45±0.05 0.75±0.071)10.462<0.001 Bcl-2 0.37±0.04 0.26±0.031)6.600<0.001 IL-6/(pg·ml-1)190.25±15.58 276.39±20.851)9.929<0.001
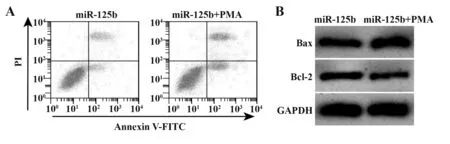
图4 miR-125b mimics和PMA对过敏原诱导的支气管上皮细胞凋亡的影响Fig.4 Effect of miR-125b mimics and PMA on allergeninduced apoptosis of bronchial epithelial cells
3 讨论
哮喘有多种诱导因素,如气候变化、感染、精神因素、过敏原、药物等,尘螨是最常见的哮喘气道炎症诱导因子,也是气道高反应性发生的重要原因。尘螨刺激后的支气管上皮细胞脱落,细胞凋亡水平增加,同时产生大量炎症因子,这些炎症因子又可进一步刺激支气管上皮细胞,加速细胞凋亡[11-12]。IL-29是常见的哮喘炎症因子,其在哮喘患者中表达上调,IL-29具有促进CD4+T细胞分泌IL-6等炎症因子的作用,放大单核细胞炎症反应[13]。IL-6 介导Th1/Th2 及Th17/Treg 平衡,是与哮喘气道炎症密切相关的促炎因子[14]。细胞凋亡是一个复杂的过程,是细胞内多种基因经过复杂的调控网络呈现的最终表现,目前发现的与细胞凋亡有关的蛋白家族主要有Bcl-2等,根据在细胞凋亡中的作用,将Bcl-2蛋白家族中的蛋白成员分为促凋亡蛋白和抗凋亡蛋白,Bax 是Bcl-2 蛋白家族中的促凋亡蛋白,其表达升高后促进细胞凋亡;Bcl-2 是Bcl-2 蛋白家族中的抗凋亡蛋白,其表达升高后抑制细胞凋亡[15-16]。本实验显示,尘螨抗原提取物诱导后的支气管上皮细胞凋亡水平升高,细胞中Bax 蛋白表达增多,Bcl-2蛋白表达减少,细胞分泌的IL-29、IL-6 水平升高,提示尘螨抗原提取物诱导支气管上皮细胞凋亡和炎症因子分泌,说明成功构建了体外哮喘支气管上皮细胞模型。
哮喘的发生受细胞内多种基因的调控,阐明基因在哮喘发生中的作用对于分子靶向治疗哮喘具有重要意义[17]。miRNA 是研究较多的非编码RNA,在人体的不同组织和器官中均有表达,并发挥极为重要的作用,miRNA 在组织中的表达具有时序性、组织特异性,这与miRNA 的功能有关[18]。miR-125b参与肿瘤、心血管系统疾病、关节炎等疾病进程,在人体的不同组织中几乎均有表达[6,19-20]。既往研究发现,miR-125b 在哮喘患者中表达降低,且可上调miR-125b 抑制尘螨诱导的哮喘小鼠气道炎症,改善气道损伤[7]。本研究发现,尘螨抗原提取物刺激后的支气管上皮细胞中miR-125b表达水平降低,且可上调miR-125b 表达水平抑制尘螨抗原提取物诱导的支气管上皮细胞凋亡和IL-29、IL-6 分泌,提示miR-125b 可能具有抑制哮喘支气管上皮细胞损伤的作用。
NF-κB是在B细胞中发现的一种核因子,NF-κB以二聚体的形式存在于细胞内,p65 是NF-κB 的关键亚单位,其表达水平高低与NF-κB 信号激活有关[21]。NF-κB 具有多种作用,如调控细胞生长、凋亡、分化、代谢、炎症等[22-23]。既往研究发现,NF-κB在哮喘中过度激活,NF-κB激活后诱导炎症发生,促进细胞凋亡,造成气道损伤,加重哮喘进程[9,11]。有报道显示,miR-125b 发挥抗炎作用与下调NF-κB 信号通路有关[8]。本研究发现,尘螨抗原提取物刺激后的支气管上皮细胞中p65 蛋白表达水平升高,而上调miR-125b 抑制p65 蛋白表达,NF-κB 信号激活剂逆转miR-125b 对尘螨抗原提取物刺激后的支气管上皮细胞凋亡和炎症因子分泌,提示miR-125b通过抑制NF-κB 信号参与哮喘支气管上皮细胞损伤进程。
综上所述,miR-125b 可能是哮喘治疗的分子靶点,上调miR-125b抑制尘螨抗原提取物诱导的支气管上皮细胞凋亡和炎症因子分泌,其机制与下调NF-κB 信号通路有关。目前尚不清楚miR-125b 通过何种具体靶向机制影响NF-κB 信号进而参与哮喘进程,课题组在以后实验中会进行深入研究。

