miR-205对体外脓毒症心肌细胞模型细胞凋亡和炎症因子分泌的影响
谢 斌 邓 超 陈栩栩 苏 醒 王红梅
(中南大学湘雅医学院附属海口医院重症医学科,海口 570203)
脓毒症主要是指由微生物感染所引起的疾病,其以大量炎症因子释放、免疫抑制、细胞凋亡,最终诱导器官功能衰竭为特征[1]。脓毒症心肌损伤是脓毒症致死的重要原因。脓毒症发生早期就表现出心肌损伤,包括心肌功能收缩异常、心肌细胞结构改变、射血分数降低等等[2]。脓毒症心肌损伤的发生机制十分复杂,与心肌细胞炎症因子释放、氧化损伤、细胞凋亡等有关[3]。LPS 是常见的诱导脓毒症发生的病原微生物的主要致病成分,其可在体外激活心肌细胞凋亡和炎症反应,造成心肌损伤[4]。既往研究发现,脓毒症心肌损伤中miRNA 的调控作用十分关键,且miRNA 在心肌细胞功能调节中发挥重要作用[5]。miRNA 是一类内源性的小分子RNA,可通过调控下游信号通路的转导、蛋白表达进而调控细胞和组织器官功能[6]。miR-205 是现阶段发现的与肿瘤有关的调节因子,在肿瘤细胞的转移、凋亡中发挥作用[7]。最近的研究发现,miR-205还与脓毒症有关,其在脓毒症患者的血清中低表达,且miR-205表达越低,患者的预后情况越差[8]。在外界因素刺激引起的心肌损伤中发现miR-205 降低PM2.5 诱发的心肌细胞凋亡[9]。NF-κB 信号通路是一个在脓毒症心肌损伤中具有促进作用的诱导因素,其激活可加剧脓毒症导致的器官功能损伤[10]。目前对于miR-205在脓毒症心肌细胞损伤中的作用尚不清楚。本实验以LPS诱导构建体外脓毒症心肌细胞损伤模型,研究miR-205 在脓毒症心肌细胞凋亡、炎症因子释放、氧化损伤中的作用和可能机制,为靶向基因治疗脓毒症提供可能参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD 雄性大鼠,体质量260~280 g,购自海南省医学实验动物中心,按照12 h光照以及12 h 黑暗环境进行饲养,不限制饮水以及采食。
1.1.2 细胞与试剂 大鼠心肌细胞H9c2购自通派(上海)生物科技有限公司;LDH 检测试剂盒、MDA检测试剂盒、SOD 检测试剂盒购自北京索莱宝科技有限公司;miRNA 第一链cDNA 合成试剂盒购自赛尔瑞成(北京)生命科学技术有限公司;SYBR Premix Ex Taq miRNA kit 购自武汉科昊佳生物科技有限公司;TNF-α 检测试剂盒、IL-6 检测试剂盒购自深圳子科生物科技有限公司;mimics control、miR-205 mimics 由百奥迈科生物技术有限公司构建合成;C-Caspase-3、NF-κBp65、GAPDH 抗体、二抗购自美国Abcam;GSH-Px 检测试剂盒购自北京雷根生物技术有限公司。
1.2 方法
1.2.1 脓毒症大鼠模型构建 参照文献[11]构建脓毒症大鼠模型,步骤简述为:以10%水合氯醛对大鼠进行腹腔麻醉,将大鼠固定在操作台上,沿腹中线位置在下腹部切开3 cm 的切口,将肌肉分离,找出盲肠,在靠近盲肠末端5 cm 处用丝线结扎,用9号针头贯穿盲肠2次,小心挤压肠管促进粪便从穿刺点溢出,将盲肠放回腹腔,关闭腹腔。手术结束以后,皮下注射生理盐水(剂量为30 ml/kg)补充体液。手术结束以后,大鼠禁食,不限制饮水。将构建成功的脓毒症大鼠模型记为脓毒症组,同时设置正常组,正常组大鼠只进行盲肠探查术,不进行结扎。淘汰造模过程中死亡的大鼠,脓毒症大鼠模型10 只中死亡1 只(死亡率为10%),将正常组的10 只大鼠中随机淘汰1 只,两组大鼠各剩余9 只。造模后12 h,取大鼠心肌组织用于后续实验。
1.2.2 qRT-PCR 方法分析miR-205 表达 分别用Trizol 试剂提取心肌组织中的总RNA,然后在RNA内添加无RNA 酶水溶解RNA,RNA 置于-20 ℃条件下备用。本次实验采用miRNA第一链cDNA合成试剂盒进行反转录反应,反应体系包括:1µl Stem-loop primer、4 µl miRNA、10 µl 2×miRNA L-RT Solution mix、1.5µl miRNA L-RT Enzyme mix,然后用RNasefree water 补充总体积至20 µl,均匀混合后置于16 ℃条件下温浴30 min,然后以37 ℃条件温浴30 min,在85 ℃条件下反应5 min,将合成的cDNA置于-20 ℃备用。按照SYBR Premix Ex Taq miRNA kit进行PCR 反应,PCR 反应的体系包括:1 µl Reverse Primer、1µl cDNA、12.5µl SYBR Premix Ex Taq Ⅱ、1 µl Forward Primer,然后用ddH2O 补充至25 µl,PCR 仪反应的程序设置如下:95 ℃30 s,95 ℃5 s,60 ℃30 s,55 ℃30 s,一共进行45 个循环,把U6 设置成内参,采用2-ΔΔCt法分别计算miR-205 的表达变化。本次PCR 使用的引物序列为:U6 正向引物5'-CTCGCTTCGGCAGCACA-3',反向引物5'-AACCCTTCACGAATTTGCGT-3';miR-205 正向引物5'-GCCGTCCTTCATTCCACCG-3',反向引物5'-TGCAGGGTCCGAGGTAT-3'。
1.2.3 TNF-α、IL-6 水平检测 收集心肌组织,ELISA法检测TNF-α、IL-6水平,步骤分别按照TNF-α检测试剂盒和IL-6检测试剂盒操作说明书进行。
1.2.4 TUNEL 法检测细胞凋亡 将心肌组织置于4%多聚甲醛溶液中固定,常规方法制备5µm 厚的切片,用二甲苯洗涤2 次,在梯度乙醇中浸泡1 次,分别滴加Proteinase K 溶液继续孵育20 min,加入50µl TUNEL 溶液,置于暗湿盒中反应1 h。最后添加50 µl converter-POD,放在暗湿盒内反应30 min。以DAB 染色,以苏木素复染之后计数细胞凋亡指数。
1.2.5 细胞转染以及分组 大鼠心肌细胞H9c2分为Control 组、LPS 组、miR-NC+LPS 组和miR-205+LPS 组,其中LPS、miR-NC+LPS、miR-205+LPS 组细胞分别在实验开始时培养在含有1 mg/L LPS的细胞培养液内,miR-NC+LPS、miR-205+LPS 组心肌细胞在LPS 培养之前,需转染mimics control、miR-205 mimics,Control 组细胞不做处理。细胞转染的方法和具体操作步骤按照转染试剂Lipofectamine2000说明书进行。培养24 h 后,收集各组心肌细胞培养液上清,按照1.2.3方法检测TNF-α、IL-6水平。
1.2.6 CCK-8 方法检测细胞凋亡 将各组心肌细胞分别接种至96 孔板,接种浓度约3×104个/ml,将细胞置于CO2培养箱中,培养24 h后取出培养板,分别在每孔内添加10µl的CCK-8溶液,将细胞板置于孔板振荡仪内充分混合1 min,再把细胞培养板置于CO2培养箱中孵育4 h。取出培养板后用酶标仪检测每孔的OD 值,计算存活率:存活率=实验组OD值/对照组OD值×100%。
1.2.7 流式细胞术检测细胞凋亡 收集各组培养24 h 后的心肌细胞,PBS 洗涤2 次,配制成浓度为5×105个/ml的细胞悬液。用移液枪分别吸取1 ml的细胞悬浮液于离心管内,800 g 离心10 min,继续在细胞沉淀中添加200 µl 的结合缓冲溶液,再吸取5µl的Annexin V-FITC 以及5µl的PI染色液至细胞中,混合溶液避光在室温下结合10 min。然后再次添加300µl 的结合缓冲溶液,利用流式细胞仪分析细胞凋亡情况。
1.2.8 Western blot 分析C-Caspase-3、NF-κBp65 蛋白表达 收集各组培养24 h 后的心肌细胞,PBS 润洗2次,添加RIPA裂解试剂,放在冰上充分裂解反应20 min。取蛋白样品,根据BCA方法测定浓度后,在蛋白内缓缓加入与蛋白溶液等体积的2×Loading Buffer,100 ℃煮沸5 min,促进蛋白变性。然后按照常规方法配制SDS-PAGE 凝胶(分离胶浓度为10%,浓缩胶浓度为5%),分别吸取40 µg 的蛋白添加到点样孔中,打开电源,首先按照80 V 的条件在浓缩胶中电泳,在溴酚蓝即将要到达分离胶时,更换为120 V 的电压继续电泳,在溴酚蓝染料已经到达底部以后,关闭电源。将凝胶取出,然后和裁剪以后的NC膜放在转移缓冲液内备用。设置250 mA的恒流进行转膜,转膜操作需要在冰上进行。转膜结束后,将NC 膜置于封闭液(5%牛血清白蛋白)中,放在室温下结合1 h。NC 膜放在抗体孵育袋内,一抗C-Caspase-3、NF-κBp65 抗体按照1∶500、1∶800 进行稀释,4 ℃过夜孵育,再用二抗用封闭液按照1∶2 000进行稀释,孵育1 h,然后按照ECL 方法进行显色。利用软件分析各条带的灰度值,并将GAPDH 作为参照,分析目的蛋白的表达水平。
1.2.9 LDH、MDA、SOD、GSH-Px 水平检测 收集各组培养24 h 后的培养液上清和心肌细胞,检测培养液上清中LDH 水平,检测细胞中MDA、SOD、GSH-Px 水平,操作步骤分别按照LDH 检测试剂盒(二硝基苯肼法)、MDA 检测试剂盒(硫代巴比妥酸法)、SOD 检测试剂盒(黄嘌呤法)、GSH-Px检测试剂盒说明书进行(比色法)。
1.2.10 NF-κB 信号激活剂对miR-205 的作用检测 经转染miR-205 mimics 的心肌细胞用1 mg/L LPS和1µmol/L的NF-κB信号激活剂PMA的培养液培养,记为miR-205+PMA+LPS 组,设置miR-205+LPS组为参照,按照上述相关方法检测细胞增殖、凋亡和C-Caspase-3、NF-κBp65蛋白表达和LDH、MDA、SOD、GSH-Px、TNF-α、IL-6水平。
1.3 统计学分析 用SPSS21.0 软件分析数据,计量资料用±s表示,两组数据间比较用t检验,多组差异比较用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 miR-205 在脓毒症大鼠心肌组织中低表达与正常组相比,脓毒症大鼠模型心肌组织中miR-205 表达水平降低,心肌组织中TNF-α、IL-6 水平升高,细胞凋亡指数升高。见表1。提示脓毒症大鼠心肌组织中炎症因子水平增加,细胞凋亡增多,miR-205在脓毒症大鼠心肌组织中低表达。
表1 脓毒症大鼠心肌组织中miR-205 表达水平、炎症因子和细胞凋亡指数(±s,n=10)Tab.1 Expression level of miR-205,inflammatory fac⁃tors and apoptosis index in myocardial tissue of sepsis rats(±s,n=10)

表1 脓毒症大鼠心肌组织中miR-205 表达水平、炎症因子和细胞凋亡指数(±s,n=10)Tab.1 Expression level of miR-205,inflammatory fac⁃tors and apoptosis index in myocardial tissue of sepsis rats(±s,n=10)
Note:Compared with normal group,1)P<0.05.
Apoptosis index/%5.18±0.26 39.56±4.251)24.223<0.001 Groups Normal Sepsis tP miR-205 1.00±0.11 0.56±0.061)10.535<0.001 TNF-α/(pg·g-1)90.65±75.16 226.14±12.941)5.330<0.001 IL-6/(pg·g-1)156.27±13.84 497.22±17.231)46.282<0.001
2.2 miR-205 mimics 对LPS 诱导的心肌细胞增殖和凋亡影响 与Control 组相比,LPS 组心肌细胞中miR-205 水平降低,细胞存活率降低,细胞凋亡率升高,细胞中C-Caspase-3 蛋白表达增多,差异有统计学意义(P<0.05)。与miR-NC+LPS 组相比,miR-205+LPS 组心肌细胞中miR-205 水平升高,细胞存活率升高,细胞凋亡率降低,细胞中C-Caspase-3 蛋白表达减少,差异有统计学意义(P<0.05)。见图1和表2。提示miR-205 mimics 提高LPS 诱导的心肌细胞增殖活性,抑制细胞凋亡。
表2 miR-205 mimics转染后LPS诱导的心肌细胞存活率、凋亡率和C-Caspase-3蛋白水平(±s,n=9)Tab.2 Effects of miR-205 mimics on LPS-induced cardiomyocyte survival rate,apoptosis rate and C-Caspase-3 protein level(±s,n=9)

表2 miR-205 mimics转染后LPS诱导的心肌细胞存活率、凋亡率和C-Caspase-3蛋白水平(±s,n=9)Tab.2 Effects of miR-205 mimics on LPS-induced cardiomyocyte survival rate,apoptosis rate and C-Caspase-3 protein level(±s,n=9)
Note:Compared with Control group,1)P<0.05;compared with miR-NC+LPS group,2)P<0.05.
miR-205 1.00±0.09 0.53±0.041)0.52±0.06 1.15±0.122)135.942<0.001 Groups Control LPS miR-NC+LPS miR-205+LPS FP Survival rate/%100.00±10.23 52.03±6.411)53.18±5.59 75.20±6.332)84.742<0.001 Apoptosis rate/%5.69±0.41 34.15±2.691)35.17±2.74 15.36±1.252)458.731<0.001 C-Caspase-3 protein 0.26±0.03 0.85±0.081)0.86±0.07 0.46±0.052)216.338<0.001

图1 miR-205 mimics 转染后LPS 诱导的心肌细胞凋亡变化Fig. 1 Changes of cardiomyocyte apoptosis induced by LPS after miR-205 mimics transfection
2.3 miR-205 mimics 对LPS 诱导的心肌细胞氧化损伤影响 与Control 组相比,LPS 组心肌细胞培养液上清中LDH 水平升高,细胞中MDA 水平升高,SOD、GSH-Px 水平降低,差异有统计学意义(P<0.05)。与miR-NC+LPS 组相比,miR-205+LPS 组心肌细胞培养液上清中LDH 水平降低,细胞中MDA水平降低,SOD、GSH-Px 水平升高,差异有统计学意义(P<0.05)。见表3。提示miR-205 mimics 减弱LPS诱导的心肌细胞氧化损伤。
表3 miR-205 mimics 对LPS 诱导的心肌细胞LDH、MDA、SOD、GSH-Px 水平的影响(±s,n=9)Tab.3 Effects of miR-205 mimics on LPS-induced levels of LDH,MDA,SOD and GSH-Px in cardiomyocytes(±s,n=9)

表3 miR-205 mimics 对LPS 诱导的心肌细胞LDH、MDA、SOD、GSH-Px 水平的影响(±s,n=9)Tab.3 Effects of miR-205 mimics on LPS-induced levels of LDH,MDA,SOD and GSH-Px in cardiomyocytes(±s,n=9)
Note:Compared with Control group,1)P<0.05;compared with miR-NC+LPS group,2)P<0.05.
GSH-Px/(U·g-1)569.37±41.02 227.48±13.501)224.91±14.02 334.17±28.142)330.340<0.001 Groups Control LPS miR-NC+LPS miR-205+LPS FP LDH/(U·L-1)4.77±0.41 32.01±2.561)31.40±3.69 13.84±1.122)301.819<0.001 MDA/(µmol·g-1)9.86±0.78 26.32±2.211)25.78±2.30 16.74±1.312)178.941<0.001 SOD/(U·g-1)185.22±15.32 102.30±8.461)101.20±10.27 159.64±13.322)108.426<0.001
2.4 miR-205 mimics 对LPS 诱导的心肌细胞分泌炎症因子影响 与Control 组相比,LPS 组心肌细胞培养液上清中TNF-α、IL-6 水平升高,差异有统计学意义(P<0.05)。与miR-NC+LPS 组相比,miR-205+LPS组心肌细胞培养液上清中TNF-α、IL-6水平降低,差异有统计学意义(P<0.05)。见表4。提示miR-205 mimics减弱LPS诱导的心肌细胞炎症因子释放。
表4 miR-205 mimics 转染后LPS 诱导的心肌细胞培养液上清中TNF-α、IL-6水平(±s,n=9)Tab.4 Levels of TNF-α and IL-6 in culture supernatant of cardiomyocytes induced by LPS after miR-205 mimics transfection(±s,n=9)

表4 miR-205 mimics 转染后LPS 诱导的心肌细胞培养液上清中TNF-α、IL-6水平(±s,n=9)Tab.4 Levels of TNF-α and IL-6 in culture supernatant of cardiomyocytes induced by LPS after miR-205 mimics transfection(±s,n=9)
Note:Compared with Control group,1)P<0.05;compared with miRNC+LPS group,2)P<0.05.
IL-6/(ng·L-1)512.02±43.26 1 684.20±126.021)1 689.14±152.78 1 034.63±65.792)256.464<0.001 Groups Control LPS miR-NC+LPS miR-205+LPS tP TNF-α/(ng·L-1)85.99±7.16 190.86±13.691)191.77±16.48 113.03±10.542)169.836<0.001
2.5 miR-205对LPS诱导的心肌细胞中NF-κB信号通路的影响 与Control 组相比,LPS 组心肌细胞中NF-κBp65 蛋白表达水平升高,差异有统计学意义(P<0.05)。与miR-NC+LPS组相比,miR-205+LPS组心肌细胞中NF-κBp65蛋白表达水平降低,差异有统计学意义(P<0.05)。见图2 和表5。提示miR-205 mimics减弱LPS诱导的心肌细胞中NF-κB信号。

图2 Western blot法分析miR-205 mimics转染后LPS诱导的心肌细胞中NF-κBp65蛋白表达水平Fig.2 Western blot analysis of NF-κBp65 protein expres⁃sion in cardiomyocytes induced by LPS after miR-205 mimics transfection
表5 miR-205 mimics 转染后LPS 诱导的心肌细胞中NFκBp65蛋白水平(±s,n=9)Tab.5 NF-κBp65 protein level in cardiomyocytes induced by LPS after miR-205 mimics transfection(±s,n=9)

表5 miR-205 mimics 转染后LPS 诱导的心肌细胞中NFκBp65蛋白水平(±s,n=9)Tab.5 NF-κBp65 protein level in cardiomyocytes induced by LPS after miR-205 mimics transfection(±s,n=9)
Note:Compared with Control group,1)P<0.05;compared with miRNC+LPS group,2)P<0.05.
NF-κBp65 protein 0.26±0.03 0.77±0.091)0.80±0.06 0.39±0.042)186.338<0.001 Groups Control LPS miR-NC+LPS miR-205+LPS FP
2.6 NF-κB信号通路激活剂对miR-205调控的LPS诱导的心肌细胞凋亡、氧化损伤及炎症因子释放的影响 与miR-205+LPS 组相比,miR-205+PMA+LPS组心肌细胞存活率降低,凋亡率升高,细胞中C-Cas⁃pase-3、NF-κBp65蛋白水平升高,上清中LDH、TNF-α、IL-6水平升高,细胞中MDA 水平升高,SOD、GSH-Px水平降低,差异有统计学意义(P<0.05)。见表6 和图3。提示NF-κB 信号通路激活剂逆转miR-205 调控的LPS 诱导的心肌细胞凋亡、氧化损伤以及炎症因子释放作用。

图3 NF-κB 信号激活剂对上调miR-205 影响LPS 诱导的心肌细胞凋亡的作用Fig.3 Effect of NF-κB signal activator on up-regulation of miR-205 and LPS-induced cardiomyocyte apoptosis
表6 miR-205 mimics 转染以后LPS 诱导的心肌细胞存活率、凋亡率和C-Caspase-3、NF-κBp65 蛋白水平以及LDH、MDA、SOD、GSH-Px、TNF-α、IL-6水平(±s,n=9)Tab.6 LPS-induced cardiomyocyte survival rate,apoptosis rate,C-Caspase-3,NF-κBp65 protein levels and LDH,MDA,SOD,GSH-Px,TNF-α,IL-6 levels after miR-205 mimics transfection level(±s,n=9)
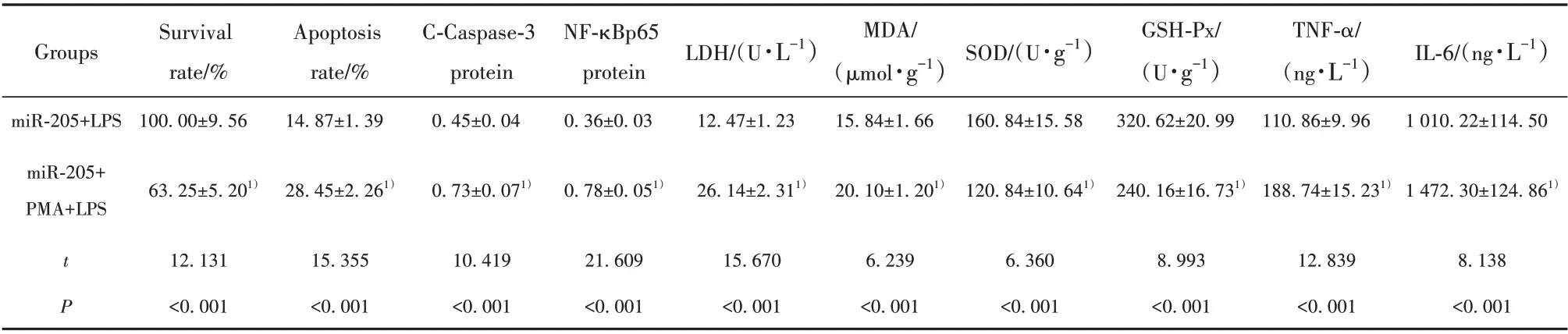
表6 miR-205 mimics 转染以后LPS 诱导的心肌细胞存活率、凋亡率和C-Caspase-3、NF-κBp65 蛋白水平以及LDH、MDA、SOD、GSH-Px、TNF-α、IL-6水平(±s,n=9)Tab.6 LPS-induced cardiomyocyte survival rate,apoptosis rate,C-Caspase-3,NF-κBp65 protein levels and LDH,MDA,SOD,GSH-Px,TNF-α,IL-6 levels after miR-205 mimics transfection level(±s,n=9)
Note:Compared with miR-205+LPS group,1)P<0.05.
Groups LDH/(U·L-1)MDA/(µmol·g-1)SOD/(U·g-1)GSH-Px/(U·g-1)TNF-α/(ng·L-1)IL-6/(ng·L-1)Survival rate/%Apoptosis rate/%C-Caspase-3 protein NF-κBp65 protein miR-205+LPS miR-205+PMA+LPS 100.00±9.56 14.87±1.39 0.45±0.04 0.36±0.03 12.47±1.23 15.84±1.66 160.84±15.58 320.62±20.99 110.86±9.96 1 010.22±114.50 63.25±5.201)28.45±2.261)0.73±0.071)0.78±0.051)26.14±2.311)20.10±1.201)120.84±10.641)240.16±16.731)188.74±15.231)1 472.30±124.861)tP 12.131<0.001 15.355<0.001 10.419<0.001 21.609<0.001 15.670<0.001 6.239<0.001 6.360<0.001 8.993<0.001 12.839<0.001 8.138<0.001
3 讨论
miRNA 有多种作用,在机体疾病发生、正常胚胎发育等过程中均有调控功能。miRNA 没有开放阅读框,长度在20 nt 左右,其在多种生物体内普遍表达[12]。miRNA 和人类疾病的关系已经有很多研究报道,例如,miRNA 通过调控肿瘤细胞的侵袭、生长、凋亡影响肿瘤进程,miRNA 还与动脉粥样硬化、阿尔茨海默病、关节炎等有关[13]。近些年来,很多研究证明在脓毒症心肌损伤中同样存在miRNA 的异常表达,且miRNA 还可能是脓毒症治疗的靶点[5]。miR-205 是一个参与调控肿瘤发生的调节因子,与肿瘤细胞的生长、凋亡等有关[7]。后续研究证明,miR-205 还和脓毒症有关,其在脓毒症患者中低表达与其预后不良具有相关性[8]。在PM2.5诱导的心肌细胞损伤中发现miR-205 表达下调,而上调miR-205抑制心肌细胞凋亡[9]。本研究结果显示,脓毒症大鼠心肌组织中miR-205 表达下调,而且miR-205 在LPS 诱导的体外脓毒症心肌细胞损伤模型中也表达下调,LPS 诱导心肌细胞增殖抑制和促进凋亡,而上调miR-205能够提高心肌细胞增殖活性,减少细胞凋亡,这说明miR-205 在脓毒症心肌损伤中可能发挥保护作用。
脓毒症的发生是一个极为复杂的过程,其造成的心肌损伤与细胞凋亡、炎症因子释放、氧化损伤等具有密切关系[14]。研究显示,脓毒症条件下,大量的TNF-α、IL-6 等炎症因子能够诱导机体内产生过多的氧自由基,加上抗氧化酶如SOD、GSH-Px 的活性下降,这些氧自由基并不能被及时清除,进而聚集在细胞内[15]。过量的氧自由基不仅会造成氧化损伤,还会激活细胞凋亡,首先,氧自由基能够促进细胞内的脂质发生过氧化,产生MDA,同时脂质是细胞膜的主要成分,这就导致了细胞膜被破坏,原本存在于细胞内的LDH 被释放至细胞外,因此,检测MDA 和LDH 水平的变化能够间接反映细胞氧化损伤程度[16]。其次,氧自由基还可以激活细胞内的Caspase 级联反应,最终诱导细胞凋亡的发生[17]。Caspase-3 是Caspase 蛋白家族成员之一,其活化形成剪切的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,CCaspase-3)后可以不可逆地催化细胞凋亡发生[18]。本实验表明,miR-205 能够抑制LPS 诱导的心肌细胞中C-Caspase-3 的表达,减少TNF-α、IL-6 释放,降低MDA 和LDH 水平,提高SOD、GSH-Px 水平,提示miR-205 具有抑制LPS 诱导的心肌细胞凋亡、氧化损伤和炎症因子释放的作用。
NF-κB 信号通路是炎症反应的经典信号通路,其被激活后可以诱导下游一系列炎症反应,促进炎症损伤[19]。另外,NF-κB 信号还参与细胞凋亡及氧化应激过程。NF-κBp65 是NF-κB 信号的关键亚单位,也是其激活水平的标志[20-21]。既往研究已经证明,NF-κB 信号活化促进脓毒症损伤,而抑制NF-κB信号活化可改善脓毒症多器官损伤[22-23]。本研究表明,miR-205 降低LPS 诱导的心肌细胞中NF-κBp65蛋白表达水平,而NF-κB 信号激活剂逆转miR-205对LPS 诱导的心肌细胞凋亡、氧化损伤和炎症因子释放作用,提示miR-205 作用机制可能与NF-κB有关。
综上,miR-205 在脓毒症心肌组织中表达下调,上调miR-205 可能通过作用于NF-κB 信号通路抑制LPS 诱导的心肌细胞凋亡、氧化损伤和炎症因子释放,目前对miR-205 是通过何种机制影响NF-κB 信号通路进而调控心肌损伤的机制还不清楚,课题组在以后实验中会进行详细探讨。本实验结果为研究miR-205 在脓毒症心肌损伤中的作用提供了参考,为靶向基因治疗脓毒症心肌损伤提供了资料。

