亚麻木酚素对TGF-β1诱导的心肌细胞H9C2损伤的影响
王玉燕 铁虎光 金丽山 马万程 (青海省第五人民医院心血管内科,西宁 810000)
心肌损伤是心血管系统疾病(如心力衰竭、心肌纤维化等)发生的重要原因之一,心肌细胞是心肌损伤的关键细胞[1]。研究表明,氧化损伤、细胞凋亡等是心肌细胞损伤的发生机制,细胞内过量活性氧(reactive oxygen species,ROS)可诱发细胞氧化损伤和凋亡[2]。TGF-β1 是心力衰竭、心肌纤维化等的重要诱导因子,可诱导心肌细胞凋亡和氧化损伤[3]。亚麻木酚素(secoisolariciresinol diglucoside,SDG)是亚麻籽的有效活性成分之一,具有降血脂、抗氧化、预防心血管系统疾病、消炎、抗肿瘤等生物学功能[4]。研究发现,SDG 可改善心肌功能,对脓毒症引发的心脏功能损伤和氧化应激具有治疗效果[5]。SDG 处理后铁超载引发的心肌损伤程度明显降低,细胞凋亡和抗氧化酶活性改善[6]。SDG 在体外可抑制氧化应激引起的心肌细胞凋亡,且可与JAK2/STAT3 协同发挥作用[7]。目前SDG 在TGF-β1 诱导的心肌细胞损伤中的作用尚不明确。本研究以心肌细胞H9C2 为研究对象,通过CCK-8、Western blot、流式细胞术等常规实验手段研究SDG 的功能,为SDG治疗心肌损伤的临床应用提供理论基础。
1 材料与方法
1.1 材料 心肌细胞H9C2 购自通派(上海)生物科技有限公司;SDG 购自成都普瑞法科技开发有限公司;LDH 检测试剂盒购自武汉艾美捷科技有限公司;JAK2 抗体购自美国Cell Signaling Technology;MDA 检测试剂盒购自北京索莱宝科技有限公司;STAT3 抗体购自深圳市豪地华拓生物科技有限公司;SOD检测试剂盒、ROS检测试剂盒购自北京普利莱基因技术有限公司;C-Caspase-3、p-JAK2、p-STAT3抗体购自美国santacruze;TGF-β1购自南京欧凯生物科技有限公司。
1.2 方法
1.2.1 CCK-8 测定SDG 对心肌细胞增殖活性的影响 调整心肌细胞浓度为3×104个/ml,吸取100 µl细胞悬浮液接种至96孔板,饱和湿度、37 ℃,5%CO2培养12 h,弃上清,更换为含0、50、100、200、400、800 µmol/L SDG 的细胞培养液继续培养24 h,取出细胞,10µl/孔添加CCK-8 溶液均匀混合,继续培养2 h,取出培养板,酶标仪检测450 nm 处OD 值。以0µmol/L SDG 处理的细胞存活率为100%,分析各浓度SDG处理的细胞存活率变化。
1.2.2 细胞分组 心肌细胞分为对照组、模型组、SDG 低、中、高剂量组。对照组不做任何处理;模型组给予20 ng/ml TGF-β1 细胞培养液处理;SDG 低、中、高剂量组同时给予20 ng/ml TGF-β1 和50、100、200 µmol/L SDG 处理。各组细胞培养24 h 后按
1.2.1检测细胞增殖情况。
1.2.3 LDH、MDA、ROS、SOD 水平检测 各组细胞培养24 h 后收集细胞和上清,按照LDH、MDA、ROS、SOD 检测试剂盒说明分别检测上清和细胞中LDH 水平、细胞中MDA、ROS、SOD 水平。ROS 结果以相对荧光强度表示(对照组荧光强度设为1),计算LDH相对释放率(对照组LDH释放率设为100%)。
1.2.4 流式细胞术检测细胞凋亡 各组细胞按照上述方法培养24 h 后,加入0.25%胰蛋白酶制备单细胞悬浮液,PBS 洗涤2 次,加入400µl 结合缓冲溶液混合,分别加入5µl Annexin V-FITC 及5µl PI 室温反应15 min,流式细胞仪测定细胞凋亡情况。
1.2.5 Western blot检测C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3 蛋白表达 各组细胞按上述方法培养24 h 后,加入含PMSF 的RIPA 裂解溶液冰上裂解20 min,4 ℃、12 000 g 离心10 min,取上清,-20 ℃保存,常规BCA 法检测蛋白浓度,按1∶4 添加5×蛋白上样缓冲液,涡旋振荡,沸水中孵育5 min,安装洗涤干净的玻璃板,制备8%分离胶、5%浓缩胶,30 µg/孔加入蛋白样品,80 V 电泳30 min,蛋白进入分离胶后,100 V继续电泳1 h,溴酚蓝指示剂进入凝胶底部边缘时取出凝胶,置于转移缓冲液中。将裁剪好的PVDF 膜浸泡于无水乙醇,置于转移缓冲液中备用,转膜(4 ℃、100 V),浸泡于含5%牛血清白蛋白的溶液中室温摇晃60 min,加入一抗稀释液4 ℃摇床结合过夜,加入二抗稀释液室温摇晃孵育60 min,ECL显色,Image J分析条带灰度值。目的蛋白表达=目的条带灰度值/内参条带灰度值,C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3 抗体稀释倍数分别为1∶400、1∶800、1∶600、1∶800、1∶600。
1.2.6 JAK2/STAT3 信号抑制剂对SDG 调控心肌细胞的影响 采用20 ng/ml TGF-β1、100 µmol/L SDG 和5 µmol/L JAK2/STAT3 信号抑制剂AG490 处理心肌细胞,记为SDG-M+AG490 组,以SDG-M 组为对照,培养24 h 后按1.2.1 检测细胞增殖,按1.2.3检测MDA、ROS、SOD、LDH 水平,按1.2.4 检测细胞凋亡,按1.2.5 检测C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达。
1.3 统计学分析 采用SPSS21.0 软件分析数据,计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 SDG对心肌细胞增殖的影响 与0µmol/L SDG组相比,50、100、200µmol/L SDG处理的心肌细胞存活率差异无统计学意义(P>0.05),而400、800µmol/L SDG处理的心肌细胞存活率明显降低(P<0.05,表1),因此,选择对心肌细胞增殖活性无影响的50、100、200µmol/L SDG进行后续实验。
表1 不同浓度SDG处理后心肌细胞存活率(±s,%)Tab.1 Survival rate of cardiomyocytes treated with different concentrations of SDG(±s,%)
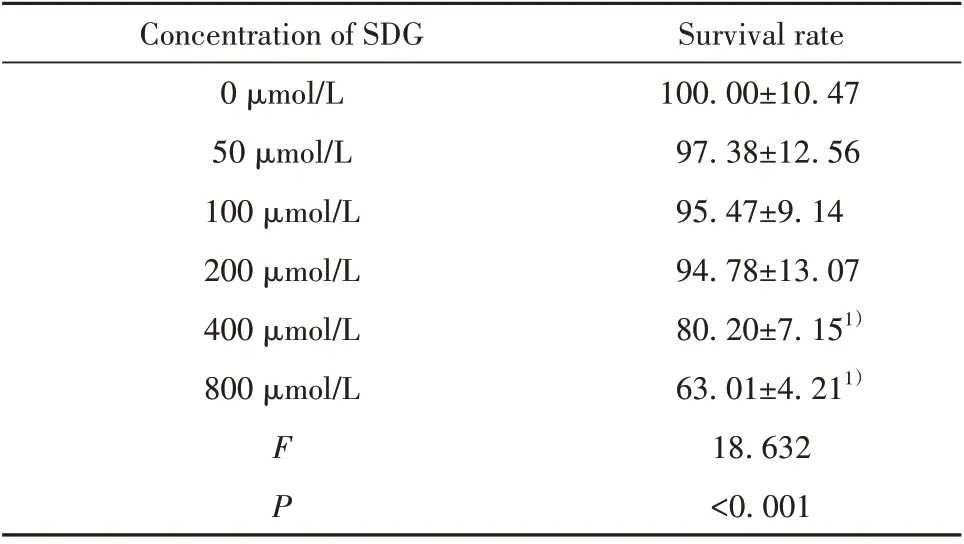
表1 不同浓度SDG处理后心肌细胞存活率(±s,%)Tab.1 Survival rate of cardiomyocytes treated with different concentrations of SDG(±s,%)
Note:Compared with 0µmol/L group,1)P<0.05.
Survival rate 100.00±10.47 97.38±12.56 95.47±9.14 94.78±13.07 80.20±7.151)63.01±4.211)18.632<0.001 Concentration of SDG 0µmol/L 50µmol/L 100µmol/L 200µmol/L 400µmol/L 800µmol/L FP
2.2 SDG 对TGF-β1 诱导的心肌细胞增殖和LDH释放的影响 与对照组相比,模型组心肌细胞存活率降低,LDH 释放率升高(P<0.05);与模型组相比,SDG 低、中、高剂量组心肌细胞存活率升高,LDH 释放率降低(P<0.05,表2),且呈剂量依赖性,提示SDG 可促进TGF-β1 诱导的心肌细胞增殖,抑制LDH释放。
表2 各组心肌细胞存活率和LDH释放率(±s,%)Tab.2 Cardiomyocytes survival rate and LDH release rate in each group(±s,%)
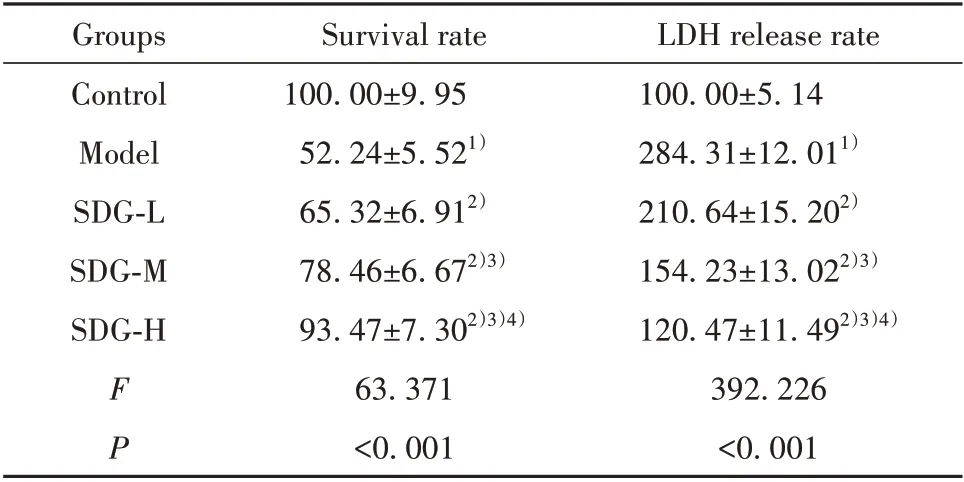
表2 各组心肌细胞存活率和LDH释放率(±s,%)Tab.2 Cardiomyocytes survival rate and LDH release rate in each group(±s,%)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with SDG-L group,3)P<0.05;compared with SDG-M group,4)P<0.05.
LDH release rate 100.00±5.14 284.31±12.011)210.64±15.202)154.23±13.022)3)120.47±11.492)3)4)392.226<0.001 Groups Control Model SDG-L SDG-M SDG-H FP Survival rate 100.00±9.95 52.24±5.521)65.32±6.912)78.46±6.672)3)93.47±7.302)3)4)63.371<0.001
2.3 SDG对TGF-β1诱导的心肌细胞氧化损伤的影响 与对照组相比,模型心肌细胞MDA和ROS水平升高,SOD 水平降低(P<0.05);与模型组相比,SDG低、中、高剂量组心肌细胞MDA 和ROS 水平降低,SOD 水平升高(P<0.05,表3),且呈剂量依赖性,提示SDG可抑制TGF-β1诱导的心肌细胞氧化损伤。
表3 各组心肌细胞MDA、ROS、SOD水平(±s)Tab.3 MDA,ROS and SOD levels of cardiomyocytes in each group(±s)
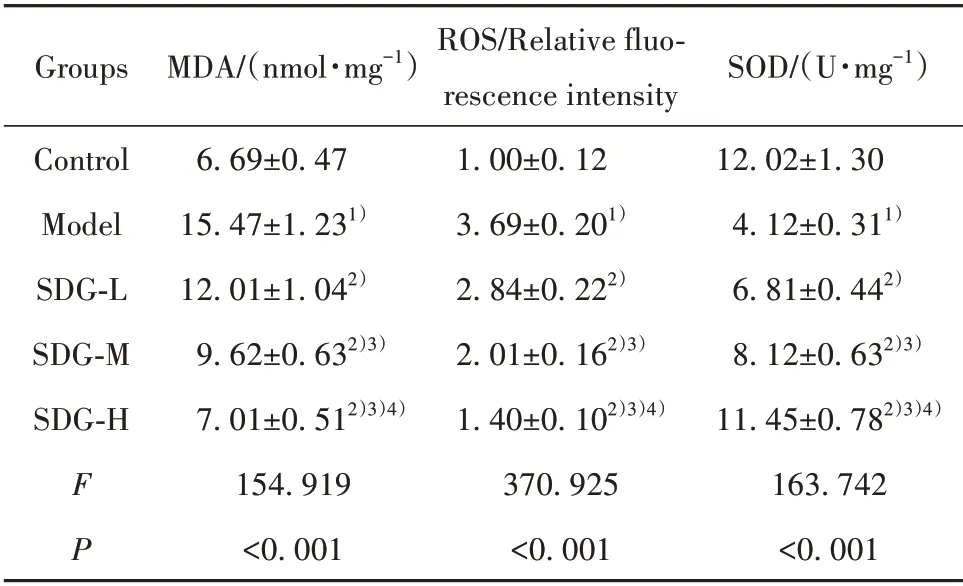
表3 各组心肌细胞MDA、ROS、SOD水平(±s)Tab.3 MDA,ROS and SOD levels of cardiomyocytes in each group(±s)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with SDG-L group,3)P<0.05;compared with SDG-M group,4)P<0.05.
Groups MDA/(nmol·mg-1)SOD/(U·mg-1)FP Control Model SDG-L SDG-M SDG-H 6.69±0.47 15.47±1.231)12.01±1.042)9.62±0.632)3)7.01±0.512)3)4)154.919<0.001 ROS/Relative fluo⁃rescence intensity 1.00±0.12 3.69±0.201)2.84±0.222)2.01±0.162)3)1.40±0.102)3)4)370.925<0.001 12.02±1.30 4.12±0.311)6.81±0.442)8.12±0.632)3)11.45±0.782)3)4)163.742<0.001
2.4 SDG 对TGF-β1 诱导的心肌细胞凋亡的影响与对照组相比,模型组心肌细胞凋亡率升高,C-Caspase-3 蛋白表达增多(P<0.05);与模型组相比,SDG 低、中、高剂量组心肌细胞凋亡率降低,C-Caspase-3 蛋白表达减少(P<0.05,图1、表4),且呈剂量依赖性。提示SDG 可抑制TGF-β1 诱导的心肌细胞凋亡。
表4 各组心肌细胞凋亡率和C-Caspase-3蛋白水平(±s)Tab.4 Apoptosis rate and C-Caspase-3 protein level of cardiomyocytes in each group(±s)
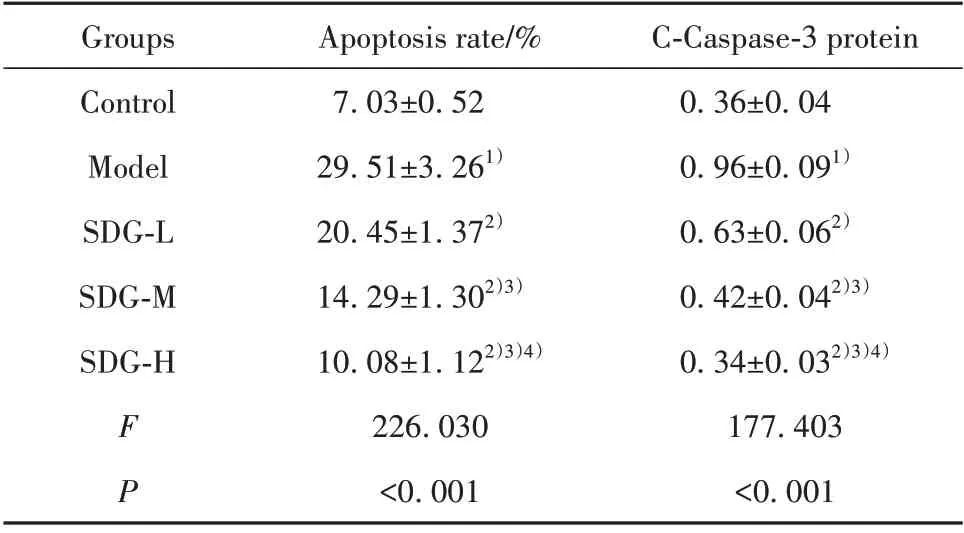
表4 各组心肌细胞凋亡率和C-Caspase-3蛋白水平(±s)Tab.4 Apoptosis rate and C-Caspase-3 protein level of cardiomyocytes in each group(±s)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with SDG-L group,3)P<0.05;compared with SDG-M group,4)P<0.05.
C-Caspase-3 protein 0.36±0.04 0.96±0.091)0.63±0.062)0.42±0.042)3)0.34±0.032)3)4)177.403<0.001 Groups Control Model SDG-L SDG-M SDG-H FP Apoptosis rate/%7.03±0.52 29.51±3.261)20.45±1.372)14.29±1.302)3)10.08±1.122)3)4)226.030<0.001
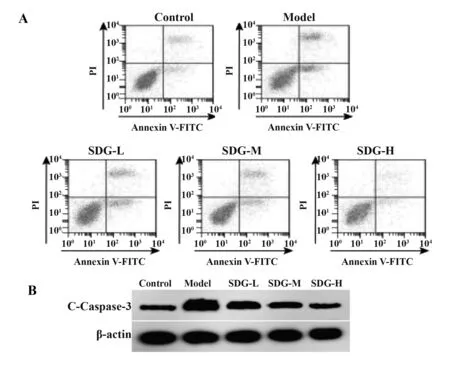
图1 SDG对心肌细胞凋亡的影响Fig.1 Effect of SDG on cardiomyocytes apoptosis
2.5 SDG 对TGF-β1 诱导的心肌细胞JAK2/STAT3信号通路的影响 与对照组相比,模型组心肌细胞p-JAK2、p-STAT3 蛋白表达降低(P<0.05);与模型组相比,SDG 低、中、高剂量组心肌细胞p-JAK2、p-STAT3 蛋白表达增多(P<0.05,图2、表5),且呈剂量依赖性。提示SDG 可促进TGF-β1 诱导的心肌细胞JAK2/STAT3信号通路激活。
表5 各组心肌细胞JAK2、p-JAK2、STAT3、p-STAT3蛋白水平(±s)Tab.5 JAK2,p-JAK2,STAT3,p-STAT3 protein levels of cardiomyocytes in each group(±s)

表5 各组心肌细胞JAK2、p-JAK2、STAT3、p-STAT3蛋白水平(±s)Tab.5 JAK2,p-JAK2,STAT3,p-STAT3 protein levels of cardiomyocytes in each group(±s)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with SDG-L group,3)P<0.05;compared with SDG-M group,4)P<0.05.
p-STAT3 0.69±0.06 0.28±0.041)0.36±0.032)0.55±0.062)3)0.64±0.062)3)4)127.423<0.001 Groups Control Model SDG-L SDG-M SDG-H FP JAK2 0.85±0.08 0.88±0.10 0.86±0.09 0.87±0.07 0.88±0.09 0.204 0.893 p-JAK2 0.75±0.07 0.26±0.031)0.34±0.042)0.52±0.052)3)0.68±0.072)3)4)171.970<0.001 STAT3 0.83±0.08 0.82±0.07 0.84±0.09 0.85±0.07 0.83±0.06 0.247 0.863
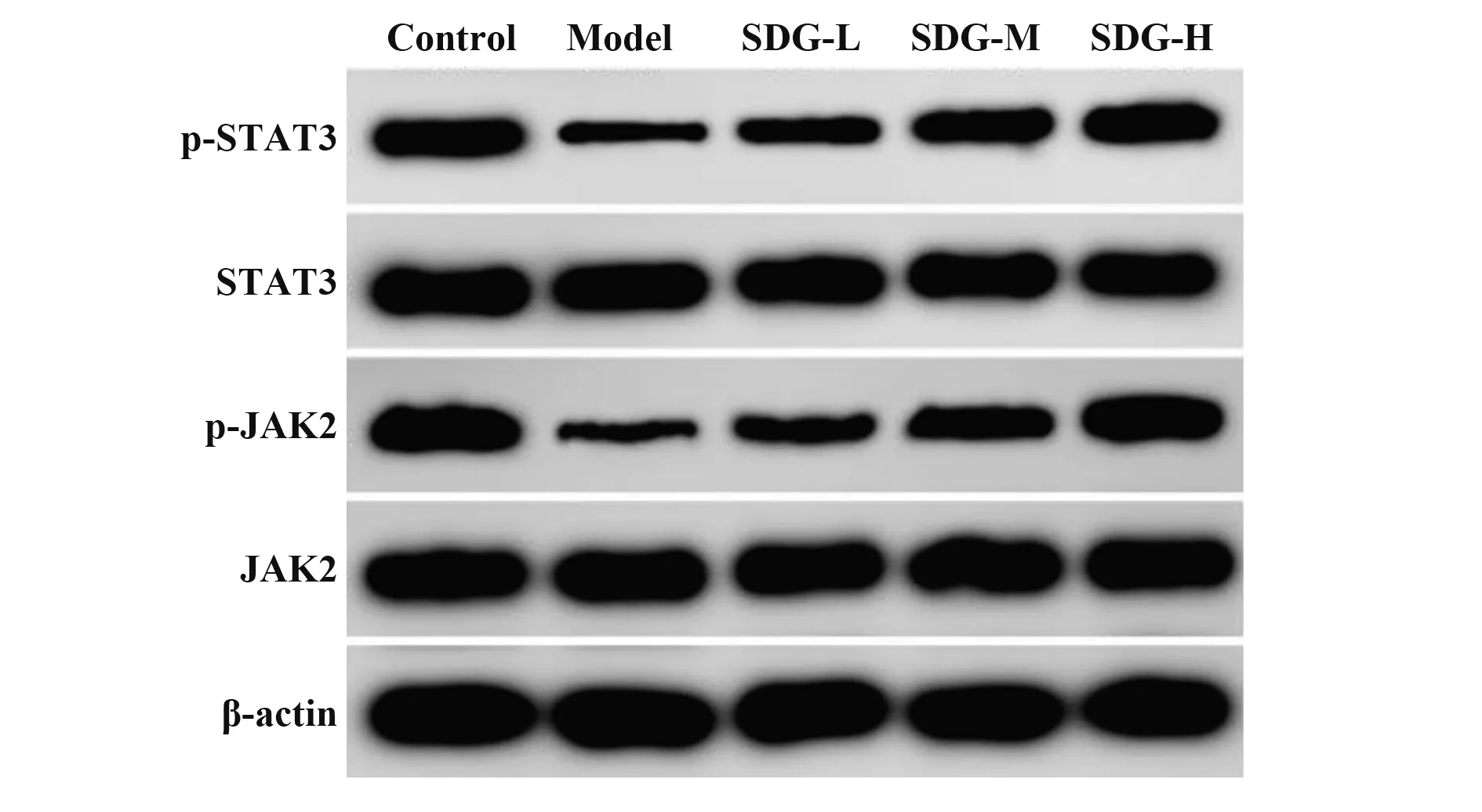
图2 Western blot检测SDG对各组心肌细胞JAK2/STAT3信号通路关键蛋白表达的影响Fig.2 Western blot to detect effect of SDG on key protein expressions of JAK2/STAT3 signaling pathway in cardiomyocytes in each group
2.6 JAK2/STAT3 信号抑制剂AG490 对心肌细胞增殖、LDH释放、凋亡和氧化损伤的影响 与SDG-M 组相比,SDG-M+AG490 组心肌细胞存活率降低,LDH释放率升高,凋亡率升高,MDA、ROS水平升高,SOD水平降低,C-Caspase-3 蛋白表达增多,p-JAK2、p-STAT3 蛋白表达减少(P<0.05,图3、表6)。提示JAK2/STAT3 信号抑制剂AG490 可逆转SDG 对TGF-β1 诱导的心肌细胞增殖、LDH 释放、凋亡和氧化损伤的作用。
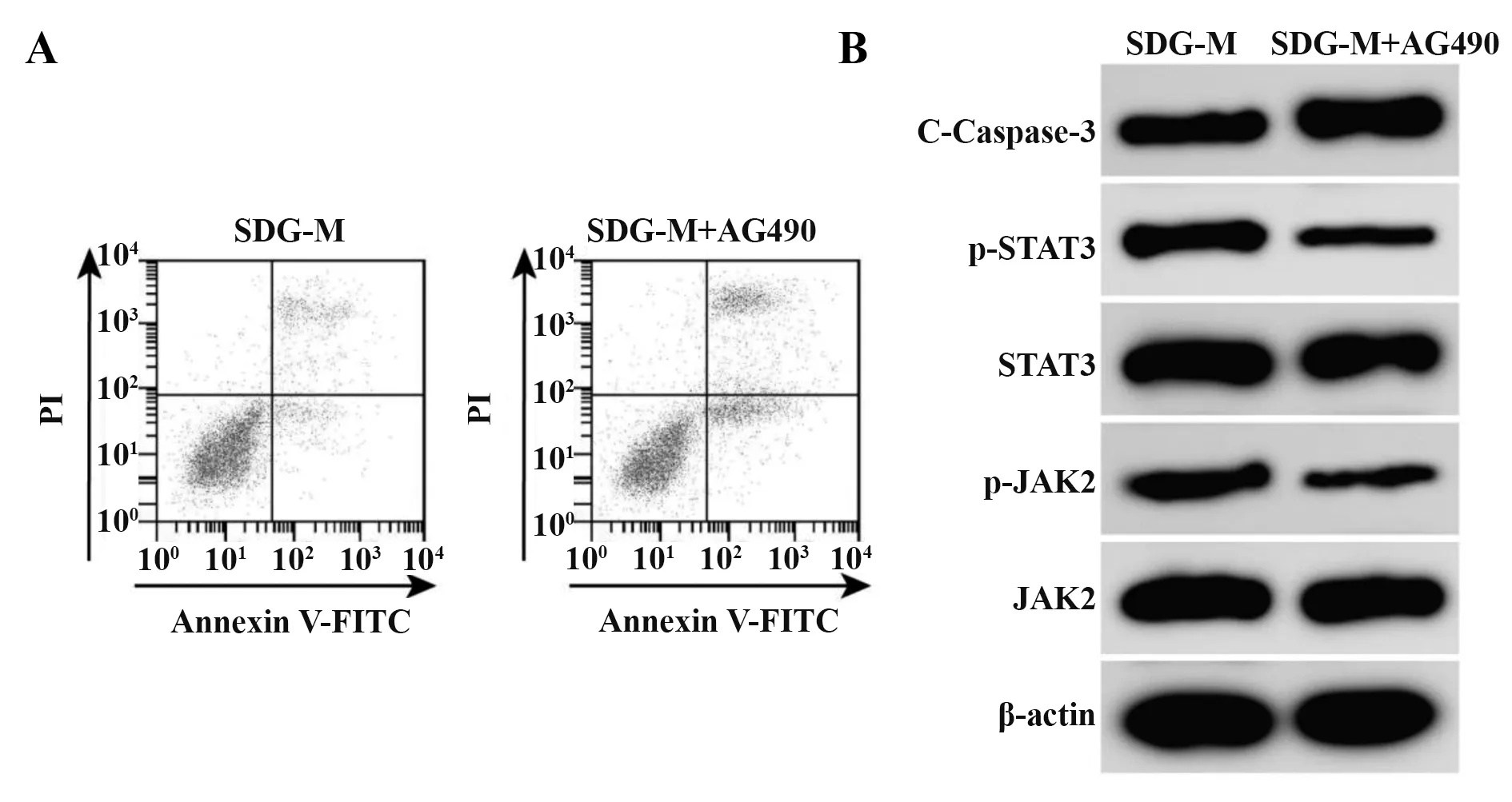
图3 JAK2/STAT3 抑制剂AG490 对SDG 处理的心肌细胞凋亡和C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达的影响Fig.3 Effect of JAK2/STAT3 inhibitor AG490 on apoptosis and protein expressions of C-Caspase-3,JAK2,p-JAK2,STAT3 and p-STAT3 of cardiomyocytes after SDG treatment
表6 SDG 和JAK2/STAT3 抑制剂AG490 处理后各组心肌细胞存活率、LDH 释放率、凋亡率、MDA、ROS、SOD 水平及C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达(±s)Tab.6 Cardiomyocytes survival rate,LDH release rate,apoptosis rate,MDA,ROS,SOD levels and C-Caspase-3,JAK2,p-JAK2,STAT3,p-STAT3 protein expressions after SDG and JAK2/STAT3 inhibitor AG490 treatment in each group(±s)
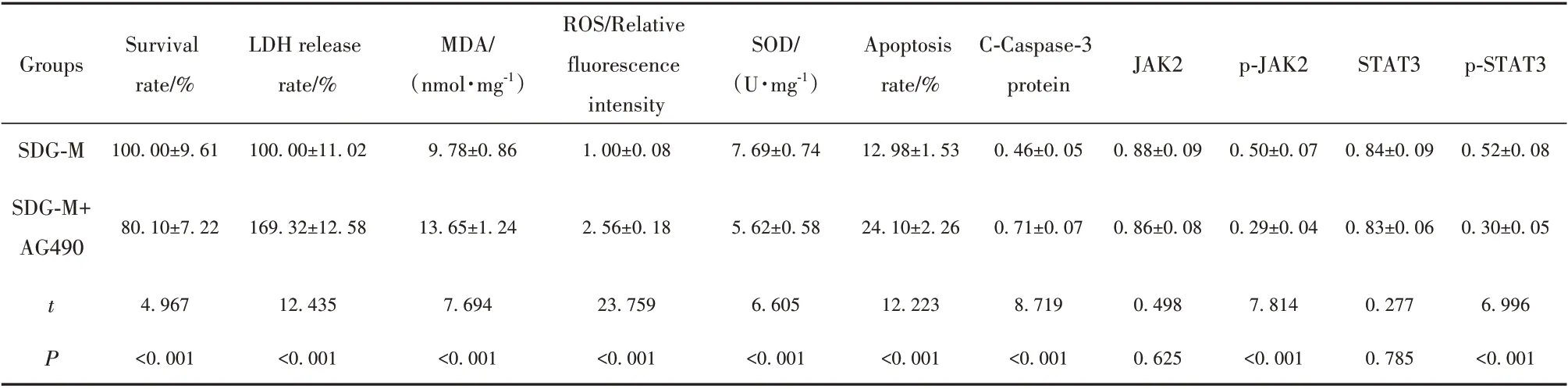
表6 SDG 和JAK2/STAT3 抑制剂AG490 处理后各组心肌细胞存活率、LDH 释放率、凋亡率、MDA、ROS、SOD 水平及C-Caspase-3、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达(±s)Tab.6 Cardiomyocytes survival rate,LDH release rate,apoptosis rate,MDA,ROS,SOD levels and C-Caspase-3,JAK2,p-JAK2,STAT3,p-STAT3 protein expressions after SDG and JAK2/STAT3 inhibitor AG490 treatment in each group(±s)
Groups Survival rate/%LDH release rate/%MDA/(nmol·mg-1)SOD/(U·mg-1)Apoptosis rate/%C-Caspase-3 protein JAK2 p-JAK2 STAT3 p-STAT3 SDG-M SDG-M+AG490 100.00±9.61 100.00±11.02 9.78±0.86 ROS/Relative fluorescence intensity 1.00±0.08 7.69±0.74 12.98±1.53 0.46±0.05 0.88±0.09 0.50±0.07 0.84±0.09 0.52±0.08 80.10±7.22 169.32±12.58 13.65±1.24 2.56±0.18 5.62±0.58 24.10±2.26 0.71±0.07 0.86±0.08 0.29±0.04 0.83±0.06 0.30±0.05 tP 4.967 12.435 7.694 23.759 6.605 12.223 8.719 0.498 7.814 0.277 6.996<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.625<0.001 0.785<0.001
3 讨论
TGF-β1是常见的心肌细胞损伤因子,在心脏相关疾病中表达上调[8]。TGF-β1 可诱导心肌细胞凋亡和氧化损伤[3]。研究显示,心肌细胞受外界因素刺激后,ROS 无法被及时清除,导致ROS 在细胞内过度积累[2]。正常情况下,机体内低水平的ROS 对细胞信号转导具有重要作用,当ROS 水平异常升高时,可引起细胞内脂质过氧化,而脂质是细胞膜主要成分,导致原本存在于细胞内的LDH 被释放至细胞外,因此检测LDH 释放率能够反映细胞损伤程度[9]。MDA 是脂质过氧化产物[10]。机体内ROS 动态平衡受氧化系统和抗氧化系统双重作用,其中抗氧化酶如SOD 是抗氧化系统的关键组成部分,其活性降低后细胞内ROS 水平升高[11]。另外,细胞内ROS 异常聚集除引起氧化损伤外,还可激活细胞内Caspase凋亡级联反应,诱导细胞凋亡[12]。Caspase-3是Caspase 蛋白家族下游因子,在静息情况下以无活性的酶原形式存在,被剪切活化后才能不可逆地促进细胞凋亡[13]。本研究发现,TGF-β1刺激后的心肌细胞增殖活性降低,LDH 释放率升高,凋亡率升高,细胞中ROS 和MDA 水平升高,SOD 活性降低,C-Caspase-3 蛋白表达升高,提示TGF-β1 可诱导心肌细胞损伤,与既往研究结论相符。
多种植物均含有木酚素,而亚麻籽中木酚素含量最高,SDG 又称为开环异落叶松酚葡萄苷,具有改善肠道、促进成骨分化、抗氧化、抗肿瘤等功效[14]。研究显示,SDG 对心血管系统疾病也有改善作用[15]。SDG 灌胃后的慢性间歇性低氧小鼠心肌损伤明显改善,SDG 还可降低心肌组织中MDA 含量[16]。SDG 可减少离体缺血再灌注损伤模型心肌细胞凋亡水平,改善心肌梗死的心脏功能[17]。铁超载诱导的心肌损伤中发现,SDG 能够降低心肌细胞Caspase-3 活化水平,提高SOD 活性,减少细胞凋亡[6]。以上研究证实了SDG强大的抗氧化和抗细胞凋亡功能。本研究发现,SDG可提高TGF-β1诱导的心肌细胞增殖活性,减少LDH 释放,降低细胞凋亡水平,提高SOD 活性,降低ROS 和MDA 水平,抑制C-Caspase-3 蛋白表达,说明SDG 可改善TGF-β1 诱导的心肌细胞损伤,与既往研究结论一致,提示SDG在心肌损伤中发挥保护作用。
研究发现,SDG 作用发挥与调控信号转导和基因表达有关[16]。SDG 抑制氧化应激条件下心肌细胞凋亡的机制与激活JAK2/STAT3 信号有关[7]。JAK2/STAT3信号通路在机体内发挥多种作用,对组织生长、能量代谢、神经损伤、细胞生长等均有调控功能[18-20]。JAK2/STAT3发挥作用与JAK2、STAT3磷酸化有关,二者磷酸化水平升高是JAK2/STAT3 信号通路激活的标志[21-22]。研究表明,JAK2/STAT3 信号通路在心肌损伤中激活水平降低,且激活JAK2/STAT3信号通路可改善心肌损伤[7,23]。本研究表明,SDG 可提高TGF-β1 的诱导心肌细胞p-JAK2、p-STAT3 蛋白表达,且JAK2/STAT3 信号通路抑制剂可逆转SDG 的作用,说明SDG 通过JAK2/STAT3 信号通路发挥作用。
综上,SDG 可改善TGF-β1 的诱导心肌细胞损伤,可抑制心肌细胞凋亡和氧化损伤,其机与激活JAK2/STAT3 信号通路有关,为SDG 治疗心肌损伤的临床应用提供了理论基础,为阐明SDG 的作用机制提供了参考,课题组将继续研究SDG 下游的具体靶向机制。

