lncRNA MALAT1调控miR-487a-3p抑制H2O2诱导的神经细胞凋亡和炎症反应及其机制研究
李国静 张 振 赵 霞 (滨州医学院烟台附属医院神经内科,烟台 264100)
退行性神经系统疾病包括阿尔茨海默病、帕金森氏病、脊髓损伤和亨廷顿氏症等,近年来发病患者逐年增多,给患者家庭和社会带来严重的困扰[1-3]。越来越多的结果显示,细胞凋亡、氧化应激和炎症反应密切地参与退行性神经系统疾病的发生与发展[3-5]。研究表明,在神经系统发病期间,细胞凋亡属于正常现象,是维持细胞稳态的基本生理过程,退行性神经系统疾病与β-淀粉样蛋白有关,在体外可导致皮质神经元发生凋亡,由于自身染色质凝聚,膜起泡和凋亡小体等结构变化[6]。炎症因子中各种白细胞亚群参与退行性神经系统疾病,或小胶质细胞激活,导致退行性神经系统疾病的炎症反应增加[7-8]。因此,抑制细胞凋亡和炎症因子诱导的神经系统损伤是治疗退行性神经系统疾病的途径之一。
长链非编码RNA(long-non coding RNA,lncRNA)可调控微小RNA(microRNA,miRNA),miRNA 和蛋白质进而发挥其生物学作用,可通过细胞凋亡、炎症反应等参与退行性神经系统疾病的发展[3,9]。越来越多的研究证明,MEG3、TUG1 和MALAT1 等在神经细胞中表达上调,从而发挥生物学作用[10-12]。miRNA 在神经退行性疾病中发挥关键作用,可通过氧化应激、细胞凋亡等导致阿尔茨海默病的发生[13]。目前关于miR-487a-3p 研究相对较少,因此,本研究通过不同浓度的H2O2刺激PC12 神经细胞,检测MALAT1 和miR-487a-3p 相对表达量,探讨MALAT1调控miR-487a-3p对H2O2诱导的PC12神经细胞凋亡和炎症反应的影响,分析其作用机制,旨在为退行性神经系统疾病提供新的临床治疗方向和作用靶点。
1 材料与方法
1.1 材料 PC12大鼠肾上腺嗜铬细胞瘤细胞株由中国科学院细胞库提供;H2O2由江苏凯基生物技术有限公司提供;DMEM 培养基、0.25%胰酶均由上海源培生物科技有限公司提供;10%胎牛血清、Lipofectamine2000 试剂盒均由美国Invitrogen 公司提供;引物由南京金斯瑞公司合成;RNA 总试剂盒、反转录试剂盒、PBS、binding buffer RIPA 裂解液均由北京Solarbio 公司提供;Annexin V-FITC、PI 均由上海碧云天生物技术有限公司提供;Bcl-2抗体、Bax抗体、GAPDH 抗体均由美国Abcam 公司提供;TNF-α、IL-6、IL-1β 试剂盒均由南京建成生物工程研究所提供。
1.2 方法
1.2.1 细胞培养和转染 将大鼠神经细胞PC12置于含10%胎牛血清的DMEM培养基中,每2 d换1次培养基,37 ℃、5%CO2培养箱孵育。待细胞密度融合至70%~80%时,使用0.25%胰酶消化,离心弃上清,传代培养。取对数生长期的PC12 细胞,按照3×104个/孔接种到6孔板内,待细胞密度融合至75%时,按照Lipofectamine2000 试剂盒将si-NC、si-MALAT1、miR-NC、miR-487a-3p、anti-miR-NC 和miR-487a-3p 转染至PC12 细胞,以200 µmol/L H2O2进行培养,对照组H2O2浓度为0 µmol/L 进行培养。培养24 h后,收集PC12细胞以进行后续试验。
1.2.2 qRT-PCR 检测MALAT1 和miR-487a-3p 表达 收集各组PC12 细胞,PBS 洗涤,采用试剂盒提取总RNA,并检测RNA 浓度,采用反转录试剂盒反转录合成cDNA,将合成cDNA 为模板进行qRTPCR。MALAT1 正向引物为5'-GGCGGAATTGCTG⁃GTAGTTT-3',反向引物为5'-AGCATAGCAGTA⁃CACGCCTT-3';GAPDH 正向引物为5'-GGTT⁃GTCTCCTGCGACTTCA-3',反向引物为5'-TGGTC⁃CAGGGTTTCTTACTCC-3';U6 正向引物为5'-CTC⁃GCTTCGGCAGCACA-3',反向引物为 5'-AAC⁃GCTTCACGAATTTGCGT-3';miR-487a-3p 正向引物为5'-GGCGAATCATACAGGGACATC-3',反向引物为5'-CAGTGCGTGTCGTGGAGT-3'。采用2-ΔΔCt法计算MALAT1和miR-487a-3p表达相对表达量。
1.2.3 流式细胞术检测细胞凋亡水平 取各组对数生长期PC12 细胞,采用PBS 洗涤,加入binding buffer重悬悬浮细胞,待充分混匀后,再加入10µl的Annexin V-FITC和5µl PI溶液,使其充分混匀,避光孵育15 min,流式细胞仪检测细胞凋亡率。
1.2.4 Western blot 检测Bcl-2 和Bax 蛋白表达水平 取各组对数生长期PC12 细胞,PBS 洗涤2 遍,加入RIPA 裂解液裂解细胞,冰浴20 min 震碎细胞,收集细胞,提取总蛋白。经凝胶电泳处理细胞后,转膜,加入一抗稀释,4 ℃过夜孵育,再加入二抗孵育,室温孵育2 h,使用Quantity One软件分析条带的灰度值,计算Bcl-2和Bax蛋白相对表达量。
1.2.5 ELISA 检测TNF-α、IL-6 和IL-1β 表达水平取各组对数生长期PC12 细胞,转移至离心管中,离心,弃上清,按照TNF-α 试剂盒、IL-6 试剂盒和IL-1β试剂盒说明书检测其含量。
1.2.6 双荧光素酶实验验证MALAT1和miR-487a-3p靶向关系 采用在线软件预测MALAT1 和miR-487a-3p 的3'UTR 端存在互补结合位点,然后构建MALAT1 的野生型(MALAT1-WT)和突变型(MALAT1-MUT)报告载体,分别于miR-NC 和miR-487a-3p 共转染至PC12 细胞,培养48 h 后使用荧光素酶试剂盒检测荧光素酶活性的变化。
2 结果
2.1 不同浓度H2O2对MALAT1表达的影响 如表1所示,随着H2O2的增加,MALAT1的相对表达量呈剂量依赖性增加,其中,H2O2浓度为200µmol/L 时,效果较为明显。
2.2 不同浓度H2O2对miR-487a-3p 的表达影响如表2 所示,随着H2O2浓度的增加,miR-487a-3p 的相对表达量呈剂量依赖性降低,其中,H2O2浓度为200 µmol/L 时,效果较为明显。因此,综合表1 结果,选择H2O2浓度为200µmol/L进行后续实验。

表1 不同浓度H2O2下MALAT1的表达Tab.1 Expressions of MALAT1 at different concentra⁃tions of H2O2
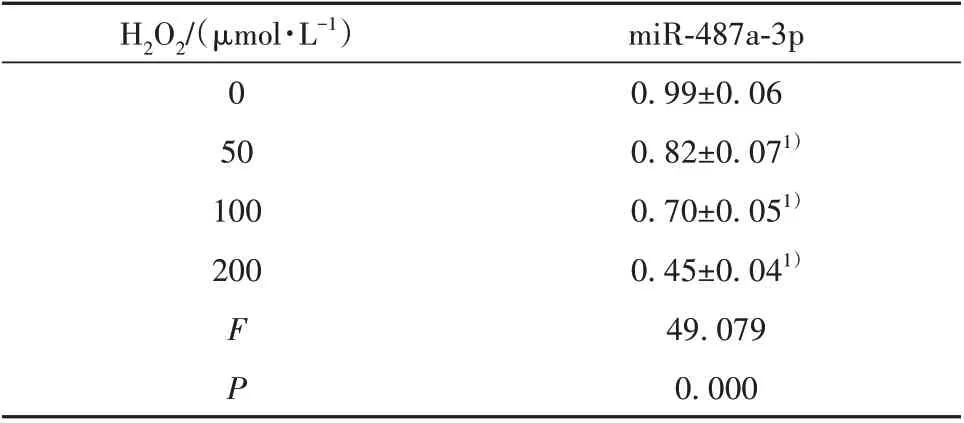
表2 不同浓度H2O2下miR-487a-3p的表达Tab.2 Expressions of miR-487a-3p at different concentra⁃tions of H2O2
2.3 抑制MALAT1 的表达对H2O2诱导神经细胞凋亡和炎症因子的影响 qRT-PCR结果显示,与Control组相比,H2O2组MALAT1表达量明显升高(P<0.05);与H2O2+si-NC 组相比,H2O2+si-MALAT1 组MALAT1表达量明显降低(图1A,P<0.05)。如图1B~F所示,与Control 组相比,H2O2组凋亡率、Bax 蛋白表达、TNF-α、IL-6 和IL-1β 表达水平明显升高(P<0.05),Bcl-2蛋白表达明显降低(P<0.05);与H2O2+si-NC组相比,H2O2+si-MALAT1 组凋亡率、Bax 蛋白表达、TNF-α、IL-6 和IL-1β 表达水平明显降低(P<0.05),Bcl-2蛋白表达明显升高(P<0.05)。
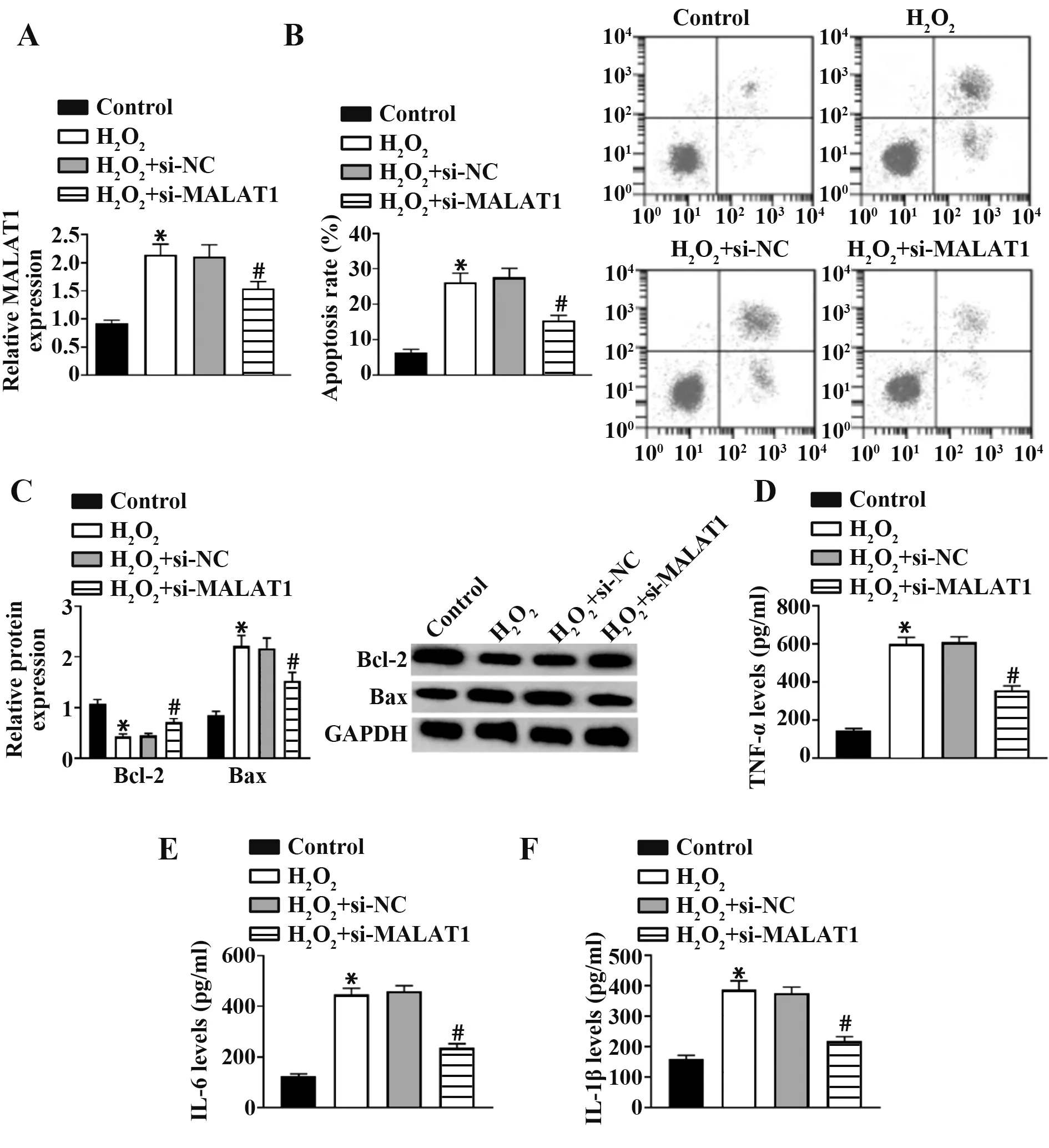
图1 抑制MALAT1 表达对H2O2诱导神经细胞凋亡和炎症因子的影响Fig.1 Effects of inhibiting expressions of MALAT1 on H2O2-induced neuronal apoptosis and inflammatory factors
2.4 过表达miR-487a-3p 对H2O2诱导神经细胞凋亡和炎症因子的影响 qRT-PCR结果显示如图2A所示,与Control 组相比,H2O2组miR-487a-3p 表达量明显升高;与H2O2+miR-NC 组相比,H2O2+miR-487a-3p组miR-487a-3p 表达量明显降低(P<0.05)。如图2B~F 所示,与Control 组相比,H2O2组凋亡率、Bax 蛋白表达、TNF-α、IL-6 和IL-1β 表达水平明显升高,Bcl-2 蛋白表达明显降低(P<0.05);与H2O2+miR-NC组相比,H2O2+miR-487a-3p 组凋亡率、Bax 蛋白表达、TNF-α、IL-6和IL-1β表达水平明显降低,Bcl-2蛋白表达明显升高(P<0.05)。
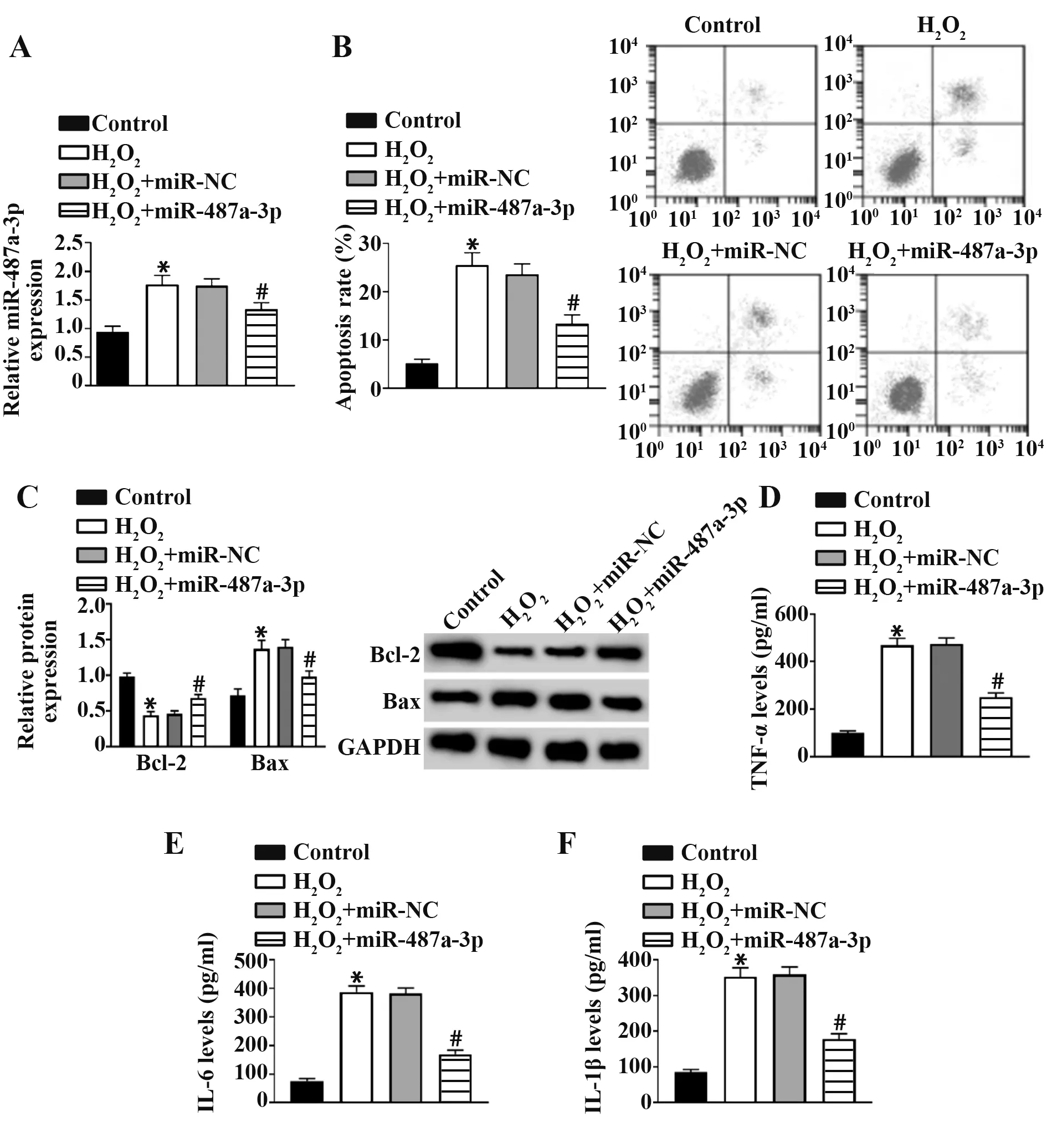
图2 过表达miR-487a-3p对H2O2诱导神经细胞凋亡和炎症因子的影响Fig.2 Effects of overexpression of miR-487a-3p on H2O2-induced neuronal apoptosis and inflammatory factors
2.5 MALAT1 靶向miR-487a-3p 如图3 所示,通过在线软件预测了MALAT1 与miR-487a-3p 存在结合位点。通过双荧光素酶报告实验进一步验证MALAT1 与miR-487a-3p 靶向关系,结果显示,与miR-NC 相比,miR-487a-3p 组野生型MALAT1-WT荧光酶活性明显降低(P<0.05),而MALAT1-MUT荧光酶活性无明显变化(表3)。表4 结果显示,与pcDNA 组相比,过表达MALAT1组NEAT1表达水平显著升高。表5结果显示,与pcDNA组相比,过表达MALAT1 组明显降低miR-487a-3p 表达水平(P<0.05);与si-NC 比较,抑制MALAT1 明显升高miR-487a-3p表达水平(P<0.05)。
表3 双荧光素酶实验(±s)Tab.3 Double luciferase assay(±s)
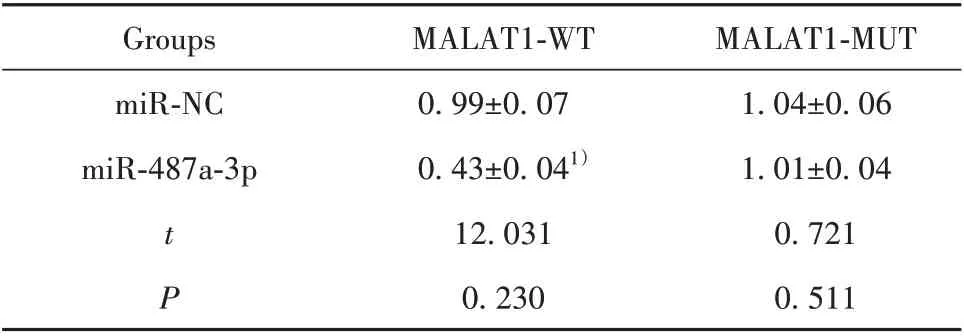
表3 双荧光素酶实验(±s)Tab.3 Double luciferase assay(±s)
Note:Compared with miR-NC group,1)P<0.05.
MALAT1-MUT 1.04±0.06 1.01±0.04 0.721 0.511 Groups miR-NC miR-487a-3p tP MALAT1-WT 0.99±0.07 0.43±0.041)12.031 0.230
表4 过表达MALAT1的转染效率(±s)Tab.4 Transfection efficiency of overexpression of MALAT1(±s)

表4 过表达MALAT1的转染效率(±s)Tab.4 Transfection efficiency of overexpression of MALAT1(±s)
Note:Compared with pcDNA group,1)P<0.05.
NEAT1 1.03±0.05 3.45±0.261)15.831 0.000 Groups pcDNA MALAT1 tP
表5 MALAT1调控miR-487a-3p的表达(±s)Tab.5 MALAT1 regulates expression of miR-487a-3p(±s)

表5 MALAT1调控miR-487a-3p的表达(±s)Tab.5 MALAT1 regulates expression of miR-487a-3p(±s)
Note:Compared with pcDNA group,1)P<0.05;compared with si-NC group,2)P<0.05.
miR-487a-3p 1.07±0.08 0.52±0.041)0.98±0.05 3.31±0.282)210.943 0.000 Groups pcDNA MALAT1 si-NC si-MALAT1 FP
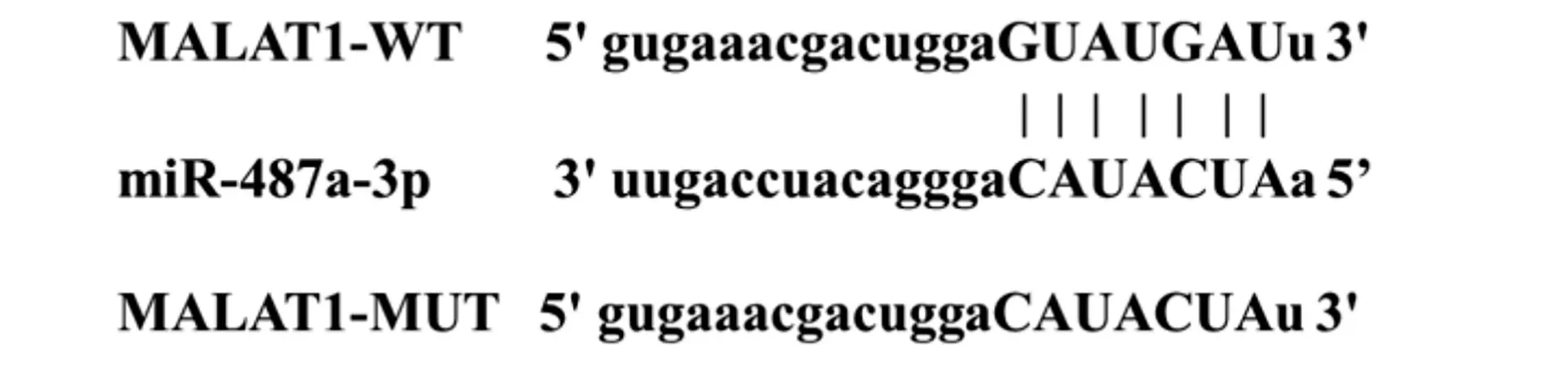
图3 MALAT1与miR-487a-3p结合位点Fig.3 Binding site of MALAT1 and miR-487a-3p
2.6 抑制miR-487a-3p 可逆转抑制MALAT1 对H2O2细胞凋亡和炎症因子的影响 流式细胞术、Western blot和ELISA实验如图4结果显示,与Control组相比,H2O2组凋亡率、Bax 蛋白表达、TNF-α、IL-6和IL-1β 表达水平明显升高(P<0.05),Bcl-2 蛋白表达明显降低(P<0.05);与H2O2+si-NC 组相比,H2O2+si-MALAT1 组凋亡率、Bax 蛋白表达、TNF-α、IL-6 和IL-1β 表达水平明显降低(P<0.05),Bcl-2 蛋白表达明显升高(P<0.05);与H2O2+si-MALAT1+anti-miR-NC组相比,H2O2+si-MALAT1+miR-487a-3p组的凋亡率、Bax蛋白表达、TNF-α、IL-6和IL-1β 表达水平明显升高(P<0.05),Bcl-2蛋白表达明显降低(P<0.05)。

图4 抑制miR-487a-3p 可逆转抑制MALAT1 对H2O2细胞凋亡和炎症因子的影响Fig.4 Inhibition of miR-487a-3p reverses effects of MALAT1 inhibition on H2O2 cell apoptosis and inflammatory factors
3 讨论
退行性神经系统疾病主要是由神经元结构和功能丧失引起的认知和行为障碍一类疾病的统称,近年来,随着我国老龄化发展迅速,我国将成为全球退行性神经系统疾病发病率最高、增长速度最快的国家[14]。细胞凋亡和炎症反应是退行性神经系统疾病发生的主要原因,神经细胞在受到炎症因子白细胞亚群刺激后,引起神经细胞发生凋亡,进而破坏神经细胞功能[8]。PC12 大鼠细胞是一种形态和结构等与神经元较为相似的一种细胞系,多被研究报道用于神经细胞功能研究[15]。刘旭东等[16]研究发现,H2O2诱导PC12 细胞导致细胞活力降低、TNF-α 和IL-1β 的表达水平降低,凋亡率增加,这与本研究结果相似。本研究中,用H2O2处理PC12 细胞后,凋亡率、促凋亡蛋白Bax 和TNF-α、IL-6 和IL-1β 表达水平增加,抑凋亡蛋白Bcl-2 降低,说明H2O2诱导神经细胞凋亡和炎症反应,表明模型构建成功。
近年来,关于lncRNA 和miRNA 相互作用的研究不断深入,ZHAO 等[17]研究结果表明,ANRIL 通过靶向负调控miR-7来减轻H2O2诱导肿瘤细胞的氧化损伤、细胞活力和凋亡,可能与激活mTOR 和MEK/ERK 信号通路有关。LI 等[18]在研究脊髓损伤中的结果显示,通过下调ANRIL可增加H2O2诱导的PC-12细胞损伤,ANRIL 可靶向调控miR-125a 表达,干扰miR-125a可以逆转下调ANRIL对H2O2诱导的PC-12细胞损伤的作用。SUN 等[19]研究发现,H2O2处理神经细胞后,下调EPIC1 的表达,沉默EPIC1 可抑制神经细胞的凋亡。研究发现,在低氧或炎症因子处理肿瘤细胞后,发现H19和HULC 存在差异表达,进行H2O2短期氧化应激反应刺激细胞系后,H19 和HULC 通过炎症反应促进癌症细胞的转移[20]。下调MALAT1 可增加H2O2诱导的肿瘤细胞死亡、凋亡和氧化应激水平,这与本研究结果相似[21]。本研究结果发现,H2O2处理调神经细胞后,下调MALAT1的表达,这与SUN 等[19]的研究结果相似;另外,抑制MALAT1的表达可明显降低H2O2诱导的神经细胞凋亡率、促凋亡蛋白Bax 和TNF-α、IL-6和IL-1β表达水平增加,抑凋亡蛋白Bcl-2降低,这说明抑制MALAT1的表达可缓解H2O2诱导神经细胞凋亡和炎症反应。目前,miR-137-3p、miR-422a、miR-9a-5p、miR-146a、miR-34a-5p 等参与H2O2处理PC12 细胞后引起的细胞损伤,分析其主要原因可能与细胞活力、凋亡率、氧化应激水平等有关[22-26]。研究结果发现,H2O2处理PC12 细胞后,上调miR-146a 的表达,且miR-146a靶向调控SOD2 的表达,这与本研究结果相反[25]。miR-487a-3p 已在胰腺癌、前列腺和肾癌等肿瘤中报道,关于miR-487a-3p在退行性神经系统疾病的研究相对较少[27-29]。本研究结果发现,H2O2处理PC12细胞后,miR-487a-3p表达下调,且过表达的miR-487a-3p可明显降低细胞的凋亡和炎症反应,这说明过表达miR-487a-3p可缓解H2O2诱导神经细胞凋亡和炎症反应。进一步实验表明,MALAT1可以靶向负调控miR-487a-3p,抑制miR-487a-3p 的表达可逆转抑制MALAT1 对H2O2细胞凋亡和炎症反应,这说明,MALAT1 通过调控miR-487a-3p 的表达可减缓H2O2诱导神经细胞凋亡和炎症反应。
综上所述,MALAT1在H2O2处理PC12细胞中表达上调,抑制MALAT1 表达可以缓解H2O2诱导的神经细胞凋亡和炎症反应,其作用可能与靶向负调控miR-487a-3p有关,为临床进一步研究退行性神经系统疾病提供合理的依据。

