槲皮素基于EGFR信号通路减轻大鼠气道黏液高分泌①
邬勋平 陶禹至 刘 琳 韩 婧 刘维佳 (贵州大学医学院,贵阳 550025)
气道黏液高分泌是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、支气管哮喘和囊性纤维化(cystic fibrosis,CF)等气道炎症性疾病进展过程中的一个重要的病理生理特征,是影响COPD、支气管哮喘及CF 病情和预后的独立危险因素[1-4]。越来越多的研究表明表皮生长因子受体(epithelial growth factor receptor,EGFR)在气道黏液高分泌的信号转导通路中居于中心地位,当EGFR被激活时,会产生过量的黏液,导致气道受阻[5]。目前治疗气道黏液高分泌的祛痰药物众多,大多为化学合成类药物,由于其毒副作用在临床应用上受到一定的限制,因此寻找毒副作用小,祛痰效果显著的天然药物成为研究重点之一。槲皮素作为一种植物天然来源的药物,具有抗炎、抗氧化、抗癌等生物学活性,但槲皮素是否能够减轻气道黏液高分泌及其分子调控机制目前仍不清楚。本研究通过脂多糖(lipopolysaccharide,LPS)诱导大鼠气道黏液高分泌模型,探讨槲皮素对气道黏液高分泌的作用以及对EGFR信号通路调控情况。
1 材料与方法
1.1 材料
1.1.1 实验动物 经过贵州省人民医院伦理委员会批准(审查批号:202019-010),选择SPF 级6~8 周龄雄性SD 大鼠36 只,购自辽宁省实验动物质量检测中心,体质量(180±20)g。饲养环境温度(25±1)℃,湿度45%~55%;自由进食饮水,适应性喂养1周。
1.1.2 主要试剂 槲皮素、LPS 购自美国Sigma 公司;小鼠单克隆抗EGFR、p-EGFR、MUC5AC 抗体购自美国Santa Cruz 公司;小鼠单克隆PI3K抗体、兔多克隆抗PKC 抗体购自武汉三鹰;兔多克隆抗NF-κB p65 抗体购自北京博奥森公司;兔多克隆抗p-PI3K、p-PKC、AKT、p-AKT 抗体购自上海艾比玛特公司;HRP 标记的山羊抗小鼠二抗、HRP 标记的山羊抗兔二抗购自美国Abcam;黏蛋白5AC(MUC5AC)ELISA试剂盒购自武汉云克隆;Trizol 试剂购自美国Invitrogen 公司;逆转录试剂盒、荧光定量PCR 试剂盒购自日本TaKaRa 公司;HE 染色试剂盒、AB-PAS试剂盒购自北京索莱宝公司。
1.2 方法
1.2.1 气道黏液高分泌大鼠模型的建立与分组将SD大鼠随机分为6组,每组6只,对照组(Control)、脂多糖组(LPS)、槲皮素低剂量组(Que-L)、槲皮素中剂量组(Que-M)、槲皮素高剂量组(Que-H)、AG1478组;所有实验大鼠用4%戊巴比妥(50 mg/kg)腹腔内注射麻醉后,在颈部环状软骨下方做皮肤切口,钝性分离暴露气管,LPS 组、Que-L 组、Que-M 组、Que-H 组、AG1478 组用2 mg/ml 的LPS 按3 mg/kg 气管内缓慢注入,Control 组用相同体积的0.9%氯化钠气管内注入。气管给药前1 h Que-L、Que-M、Que-H剂量组分别给予50、100、200 mg/kg槲皮素溶液灌胃,AG1478 组气管给药前30 min 于腹腔注射AG1478 20 mg/kg,Control 组和LPS 组气管给药前1 h 灌胃相应体积的0.9%氯化钠,1次/d,连续4 d。
1.2.2 HE 染色观察肺组织病理学变化及肺组织炎症积分 将大鼠用4%戊巴比妥腹腔麻醉后,暴露心脏,取右中肺组织于4%多聚甲醛进行固定24 h,干燥脱水,石蜡包埋后切成3 µm 厚的组织切片。HE 染色观察肺组织病理学变化。参照文献
[6]采用双盲法,根据炎症浸润累及的支气管细支气管数量和浸润程度、支气管细支气管管腔渗出的程度、炎症浸润的血管数量以及肺实质炎症的程度等5 个方面(积分:0~26 分)对肺组织病理学改变进行评定,计算肺组织炎症积分。
1.2.3 AB-PAS 染色检测杯状细胞的增生和黏液的分泌 将3µm厚的肺组织切片常规脱蜡至水,阿利新兰染液浸染15 min,水洗3 次,氧化剂氧化8 min,Schiff Reagent 浸染20 min。常规脱水、透明、封片。利用Image Pro Plus 图像分析软件统计每组的阳性着色面积。
1.2.4 ELISA 检测肺组织MUC5AC 含量 称取肺组织30 mg,剪碎,加入1 ml 裂解液,在冰上裂解10 min,10 000 g、4 ℃离心5 min,取上清待用。加样:分别设空白孔,标准品孔,待测样品孔。依次加入100 µl 样品,37 ℃孵育1 h;甩干,加检测溶液A 100 µl,37 ℃孵育1 h;洗板3 次,加待测溶液B 100 µl,37 ℃孵育30 min;洗板5 次,加TMB 底物90 µl,37 ℃孵育15 min;加终止液50 µl,立即于450 nm处读数。
1.2.5 IHC检查MUC5AC、EGFR、PKC、NF-κB的表达 取3µm 厚的肺组织切片,常规脱蜡复水,高压修复10 min,3%过氧化氢阻断内源性过氧化物酶活性10 min,山羊血清封闭2 h,MUC5AC(1∶200)、EGFR(1∶200)、PKC(1∶100)、NF-κB(1∶100)4 ℃孵育过夜,二抗(1∶200)37 ℃孵育2 h,DAB 显色,苏木素染核2 min,自来水洗返蓝15 min,常规脱水,中性树胶封片。在光镜下观察阳性染色呈棕黄色,利用Image Pro Plus 图像分析软件统计每组的平均光密度值。
1.2.6 实时荧光定量PCR 法检测肺组织MUC5AC、EGFR mRNA 表达 使用Trizol 提取总RNA,RNA/DNA 紫外可见光度法检测总RNA 的浓度和纯度,按照反转录试剂盒操作说明将RNA 逆转录成cDNA,再按扩增试剂盒操作说明进行cDNA 扩增。通过GAPDH 校正并使用公式x=2-ΔΔCt计算各组基因相对表达量。引物由上海生工生物技术有限公司设计合成,引物序列见表1。
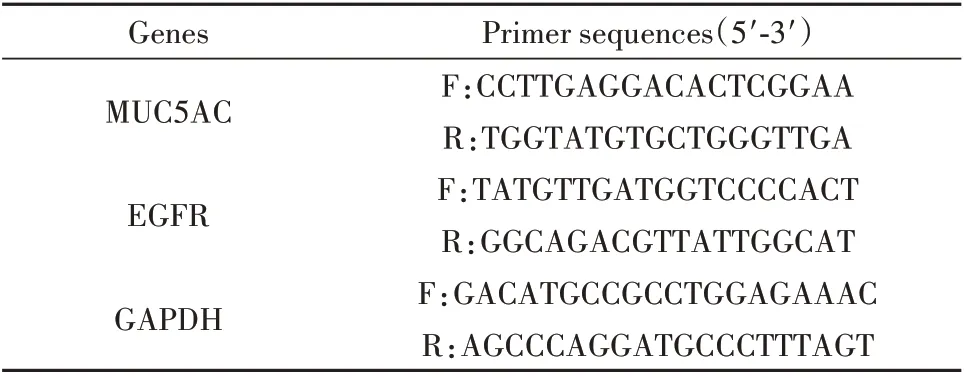
表1 实时定量PCR 检测的基因引物序列Tab.1 Sequence of gene primers for real-time quantita⁃tive PCR detection
1.2.7 Western blot 检测EGFR 信号通路相关蛋白表达 称取肺组织30 mg,剪碎,加入250 µl RIPA裂解液,在冰上裂解30 min,12 000 r/min,4 ℃离心10 min 取上清冻存于-80 ℃待用,利用BCA 试剂盒检测蛋白浓度。将各组蛋白取20 µg 上样后进行SDS聚丙烯酰胺凝胶电泳,转膜至PVDF膜,5%脱脂奶粉室温封闭2 h。按照所测蛋白的分子量裁剪PVDF膜,然后分别孵育相应抗体,4 ℃过夜。TBST洗膜后加辣根过氧化物酶标记山羊抗兔二抗(1∶20 000)及山羊抗小鼠二抗(1∶10 000),冰上孵育2 h,洗膜,显影。使用图像分析软件Image J 测定目的条带与内参条带的光密度值(OD 值),以目的条带OD 值比内参条带的OD值表示目的蛋白的相对含量。
1.3 统计学处理 使用SPSS22.0软件对本实验数据进行统计学分析,正态分布计量资料以±s表示。两组间差异比较采用t检验,多组间差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠情况 在开始建模前所有大鼠精神状态良好,体质量增长均匀,食欲好,无任何显著性差异。大鼠气管注入LPS后精神状态差,活动少,呼吸急促,食欲下降,体质量减轻。AG1478 及槲皮素Que-L、Que-M、Que-H 剂量组干预后上述症状逐渐减轻。
2.2 各组大鼠肺组织病理学检查 HE 染色在光镜下观察对照组支气管上皮结构清晰,周围未见或偶见炎症细胞;LPS组支气管上皮增厚,杯状细胞及黏膜下腺体增生肥大,支气管管壁和周围肺组织有大量炎症细胞浸润,管腔发生不完全阻塞,肺组织炎症积分显著升高(P<0.05);Que-L、Que-M、Que-H剂量组以及AG1478 干预后上述病理症状改变减轻,肺组织炎症积分逐渐下降(P<0.05,图1、表2)。
表2 肺组织炎症积分(±s,n=6)Tab.2 Lung inflammation score(±s,n=6)

表2 肺组织炎症积分(±s,n=6)Tab.2 Lung inflammation score(±s,n=6)
Note:Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with Que-L group,3)P<0.05;com⁃pared with Que-M group,4)P<0.05.
Score 2.11±0.83 12.17±2.201)10.22±2.501)8.28±2.121)2)5.00±1.251)2)3)4)3.78±1.062)3)4)Groups Control LPS Que-L Que-M Que-H AG1478

图1 各组大鼠肺组织病理变化(×400)Fig.1 Pathological changes of rat lung tissue in each group(×400)
2.3 各组大鼠肺组织杯状细胞增生和黏液的分泌情况 AB-PAS 染色在光镜下观察到大鼠气道上皮的杯状细胞增生以及一些黏液物质被染成蓝色,阳性染色主要见于气管、支气管黏膜上皮、管腔和黏膜下腺体。与Control 组相比,LPS 组可见支气管气道上皮大量蓝色杯状细胞增生,阳性着色面积显著增大,而Que-L、Que-M、Que-H 剂量组干预后,杯状细胞增生逐渐减少,阳性染色面积也相应减少(P<0.05,图2、表3)。
表3 AB-PAS阳性着色面积百分比(±s,n=6)Tab.3 AB-PAS staining percentage(±s,n=6)

表3 AB-PAS阳性着色面积百分比(±s,n=6)Tab.3 AB-PAS staining percentage(±s,n=6)
Note:AB-PAS staining percentage. Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with Que-L group,3)P<0.05;compared with Que-M group,4)P<0.05.
Percentage/%4.38±1.20 26.11±8.101)24.46±6.321)18.18±4.421)2)10.60±1.942)3)4)8.54±2.622)3)4)Groups Control LPS Que-L Que-M Que-H AG1478
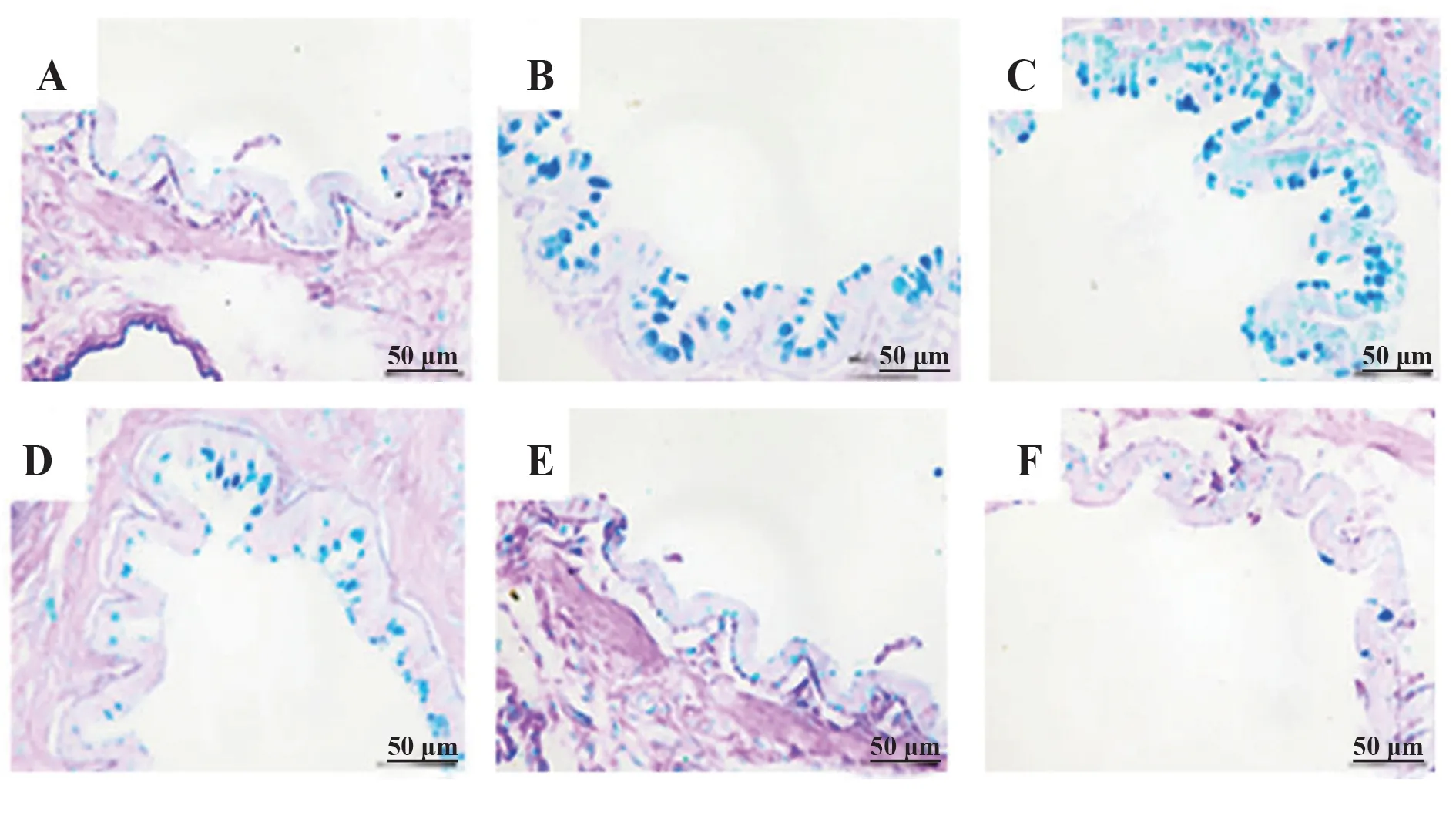
图2 各组大鼠肺组织黏液分泌情况(×400)Fig.2 Mucus secretion in lung tissue of rats in each group(×400)
2.4 不同浓度的槲皮素对大鼠肺组织中MUC5AC的影响 IHC结果显示MUC5AC、EGFR、PKC、NF-κB的阳染颗粒主要见于气道上皮,部分在黏膜下腺体;与对照组相比,LPS 组MUC5AC、EGFR、PKC、NF-κB 表达显著增多,Que-L、Que-M、Que-H 剂量组干预后,上述蛋白表达逐渐减少(P<0.05);ELISA检测MUC5AC 的表达与免疫组化结果一致,差异具有统计学意义(P<0.05,图3、表4)。
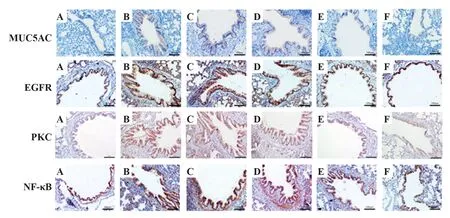
图3 各组大鼠肺组织中MUC5AC、EGFR、PKC、NF-κB的表达(×200)Fig.3 Expressions of MUC5AC,EGFR,PKC and NF-κB in lung tissues of rats in each group(×200)
表4 各组大鼠MUC5AC、EGFR、PKC、NF-κB的表达(±s,n=6)Tab.4 Expressions of MUC5AC,EGFR,PKC and NF-κB in rats(±s,n=6)
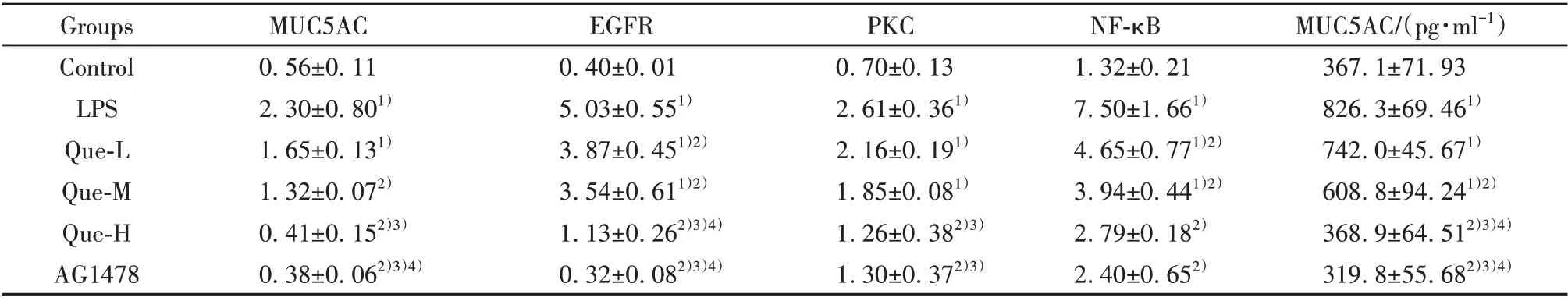
表4 各组大鼠MUC5AC、EGFR、PKC、NF-κB的表达(±s,n=6)Tab.4 Expressions of MUC5AC,EGFR,PKC and NF-κB in rats(±s,n=6)
Note:Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with Que-L group,3)P<0.05;compared with Que-M group,4)P<0.05.
MUC5AC/(pg·ml-1)367.1±71.93 826.3±69.461)742.0±45.671)608.8±94.241)2)368.9±64.512)3)4)319.8±55.682)3)4)Groups Control LPS Que-L Que-M Que-H AG1478 MUC5AC 0.56±0.11 2.30±0.801)1.65±0.131)1.32±0.072)0.41±0.152)3)0.38±0.062)3)4)EGFR 0.40±0.01 5.03±0.551)3.87±0.451)2)3.54±0.611)2)1.13±0.262)3)4)0.32±0.082)3)4)PKC 0.70±0.13 2.61±0.361)2.16±0.191)1.85±0.081)1.26±0.382)3)1.30±0.372)3)NF-κB 1.32±0.21 7.50±1.661)4.65±0.771)2)3.94±0.441)2)2.79±0.182)2.40±0.652)
2.5 各组大鼠肺组织中MUC5AC、EGFR 的mRNA表达水平 与Control 组相比,LPS 组MUC5AC 及EGFR 的mRNA 水平显著升高(P<0.05);与LPS 组相比,Que-L、Que-M、Que-H 剂量组干预后MUC5AC及EGFR 的mRNA 水平逐渐降低;Que-H 剂量组和阳性对照AG1478 组能显著降低MUC5AC 及EGFR的mRNA水平(P<0.05,表5)。
表5 肺组织MUC5AC、EGFR mRNA水平(±s,n=6)Tab.5 MUC5AC,EGFR mRNA levels in lung tissue(±s,n=6)

表5 肺组织MUC5AC、EGFR mRNA水平(±s,n=6)Tab.5 MUC5AC,EGFR mRNA levels in lung tissue(±s,n=6)
Note:RT-qPCR. Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with Que-L group,3)P<0.05;compared with Que-M group,4)P<0.05.
EGFR mRNA 1.00±0.33 3.82±0.081)2.88±0.251)2)1.76±0.071)2)3)1.29±0.022)3)1.30±0.182)3)Groups Control LPS Que-L Que-M Que-H AG1478 MUC5AC mRNA 1.00±0.21 4.42±0.451)3.16±0.151)2)2.42±0.311)2)1.26±0.272)3)4)1.30±0.182)3)4)
2.6 EGFR 信号转导通路在肺组织中的表达情况与Control 组相比,LPS 组p-EGFR/EGFR、p-PI3K/PI3K、p-PKC/PKC、p-AKT/AKT、NF-κB 的表达显著增多(P<0.05),与LPS 组相比,槲皮素高剂量组和AG1478 组能够显著下调EGFR、PI3K、PKC、AKT 的磷酸化水平,抑制NF-κB表达(P<0.05,表6,图5)。
表6 不同浓度槲皮素对EGFR信号通路的影响(±s,n=6)Tab.6 Effects of different doses of quercetin on EGFR signaling pathway(±s,n=6)
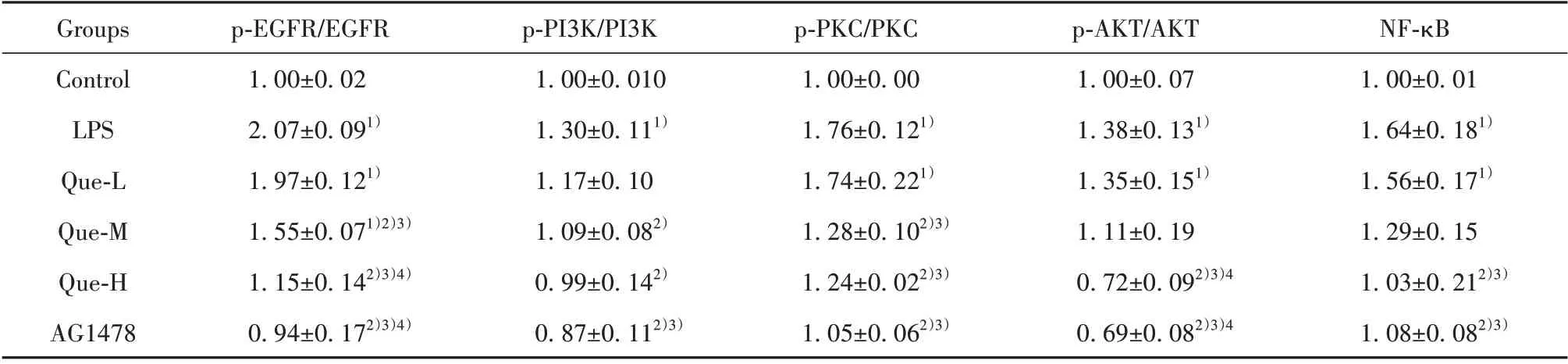
表6 不同浓度槲皮素对EGFR信号通路的影响(±s,n=6)Tab.6 Effects of different doses of quercetin on EGFR signaling pathway(±s,n=6)
Note:Western blot.Compared with control group,1)P<0.05;compared with LPS group,2)P<0.05;compared with Que-L group,3)P<0.05;compared with Que-M group,4)P<0.05.
NF-κB 1.00±0.01 1.64±0.181)1.56±0.171)1.29±0.15 1.03±0.212)3)1.08±0.082)3)Groups Control LPS Que-L Que-M Que-H AG1478 p-EGFR/EGFR 1.00±0.02 2.07±0.091)1.97±0.121)1.55±0.071)2)3)1.15±0.142)3)4)0.94±0.172)3)4)p-PI3K/PI3K 1.00±0.010 1.30±0.111)1.17±0.10 1.09±0.082)0.99±0.142)0.87±0.112)3)p-PKC/PKC 1.00±0.00 1.76±0.121)1.74±0.221)1.28±0.102)3)1.24±0.022)3)1.05±0.062)3)p-AKT/AKT 1.00±0.07 1.38±0.131)1.35±0.151)1.11±0.19 0.72±0.092)3)4 0.69±0.082)3)4
3 讨论
气道黏液高分泌是慢性气道炎症疾病主要的临床表现和病理特征之一,出现气道黏液高分泌症状的慢性气道炎症性疾病患者具有较差的肺功能,因此出现高住院率与病死率[7]。在正常生理条件下,气道黏液物质作为呼吸系统固有免疫的重要组成部分,可黏附吸入的颗粒物,通过纤毛清除运动运输至体外,对机体起到保护作用;但在吸烟、细菌以及病毒等多种致病因素作用下,黏液分泌过多,气道纤毛清除功能下降导致黏液清除率下降,可加重细菌定植,出现慢性肺部感染与急性加重。因此明确气道黏液高分泌与气道炎症性疾病之间的关系,深入探究气道黏液高分泌的发病机制,对于气道黏液高分泌的祛痰治疗具有重要作用。
LPS 作为革兰氏阴性细菌细胞壁外壁的组成成分,当进入气道时会诱发气道炎症,从而产生过多的黏液,常被用来诱导一些气道炎症和黏液分泌过多[8-9]。MUC5AC 是黏液中最主要的蛋白之一,主要由杯状细胞产生,MUC5AC mRNA 或MUC5AC 可作为气道杯状细胞增生、化生的标志,气道分泌物中MUC5AC 的含量和气道上皮MUC5AC 的转录水平可反映气道黏液产生分泌的强度。本研究以SD 大鼠为研究对象,向气管中滴注LPS,以肺组织病理学、肺组织炎症积分、黏液分泌3个参数建立气道黏液高分泌大鼠模型。与对照组相比,LPS 组大鼠气道上皮增厚,杯状细胞及黏膜下腺体增生肥大,炎症细胞浸润,管腔发生不完全性阻塞,肺炎症积分和AB-PAS 黏液阳性着色面积也明显增加,并且MUC5AC 的表达上调。以上结果表明,LPS 气管内注入能成功诱导大鼠气道黏液高分泌。
近年来,植物来源的药物越来越受重视,在临床上的应用也越来越广泛。槲皮素是一种多羟基黄酮类化合物,广泛存在于植物的花、叶、果实,由于含有许多酚类羟基,具有较强的抗炎和抗氧化性能,现研究已证实槲皮素是最有前途的用于预防和治疗炎症相关性的慢性疾病的天然药物之一[10-11]。在肺部疾病的研究中发现,槲皮素能显著改善肺部炎症和黏液分泌过多[12-13]。本研究结果表明槲皮素能以剂量依赖性方式显著降低LPS 诱导的炎症损伤;在槲皮素干预后,炎症细胞浸润和气道上皮增厚的病理变化得到改善,杯状细胞增生和黏液分泌减少,肺组织炎症积分以及AB-PAS 阳性着色面积降低;并进一步分析了肺组织中MUC5AC 的表达,结果发现槲皮素能够明显抑制MUC5AC 的表达。提示槲皮素对LPS诱导的大鼠气道黏液高分泌具有保护作用,而其机制需要进一步探讨。
EGFR 属于ErbB 受体家族的一种,属于酪氨酸激酶型受体,位于细胞膜表面,在气道黏液高分泌的信号转导通路中居于中心地位,多种刺激因素均可通过活化EGFR 及其下游通路诱导杯状细胞增生和化生,导致过量黏蛋白的合成,引起气道炎症[14];如吸烟会诱导大量的活性氧和蛋白酶的产生从而引起EGFR 磷酸化进而激活其下游信号通路,而EGFR 酪氨酸激酶抑制剂AG1478 则可抑制EGFR活化所引起的杯状细胞增生和MUC5AC 的表达增多[15-16]。现研究较明确EGFR下游通路之一是PI3K/PKC/AKT/NF-κB 信号通路。有研究发现槲皮素能够通过抑制EGFR/NF-κB 的磷酸化从而减少由香烟所诱导的黏液高分泌[13],据文献报道,槲皮素等天然黄酮或异黄酮化合物还是EGFR 小分子抑制剂[17-18]。为了进一步明确槲皮素对气道黏液高分泌作用的机制,本研究采用AG1478 作为阳性对照药物,槲皮素进行干预,对EGFR 通路相关蛋白进行研究,结果发现给予槲皮素干预后EGFR 及MUC5AC的mRNA 水平和EGFR 蛋白磷酸化水平剂量依赖性降低,其下游分子PI3K、PKC、AKT 蛋白磷酸化水平也相应剂量依赖性降低,NF-κB 蛋白表达剂量依赖性减少。给予AG1478 后,EGFR 及MUC5AC 的mRNA 水平显著降低,EGFR 及其相应下游蛋白磷酸化水平降低,NF-κB 蛋白表达下调。提示槲皮素可能通过抑制EGFR 信号转导通路的激活,下调MUC5AC的表达来发挥作用的。
综上所述,槲皮素具有强大的抗炎作用,对气道黏液高分泌治疗具有潜在的应用价值,其发挥作用的途径可能与调节EGFR/PI3K/PKC/AKT/NF-κB信号通路有关。但是槲皮素由于其水溶性差在临床上的应用受限,并且其生物学功能多,在体内发挥功能的信号通路比较复杂,需要进一步明确其相关信号转导机制并选择关键靶点分子才能为精准治疗气道黏液高分泌提供指导。

