丙酮酸脱氢酶E1α亚单位、转录激活反应RNA 结合蛋白1 在表皮生长因子受体突变晚期非小细胞肺癌中的表达及对患者预后的影响
吕晶晶,邹明雷,付培彪
河南理工大学第一附属医院/焦作市第二人民医院肿瘤内科,河南 焦作4540000
肺癌是中国乃至全球恶性肿瘤死亡的主要原因,其中最常见的组织学类型为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1-2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)突变能够经由多种通路增强肿瘤细胞的侵袭、转移并抑制其凋亡,在NSCLC 患者中,EGFR突变患者达到了50%[3-4]。早期肺癌多无典型临床症状,多数患者就诊时肿瘤已发展至晚期,手术完整切除的难度较大,化疗疗效欠佳且不良反应明显,靶向治疗逐渐成为临床治疗的首选,其中以吉非替尼为代表的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)对EGFR突变的NSCLC 疗效确切,且不良反应相对较小[5-6]。尽管随着医学技术的迅速发展,NSCLC 的诊断及治疗技术日益升高,但晚期NSCLC 患者的预后仍不理想,因此,研究参与肺癌细胞增殖、浸润的主要基因及蛋白,探索其与患者预后的关系有重要的临床价值。丙酮酸脱氢酶E1α 亚 单 位(pyruvate dehydrogenase complex E1α subunit,PDHA1)可促使有氧糖酵解转变为氧化磷酸化,抑制肿瘤的发生发展[7]。转录激活反应RNA结合蛋白1(transcriptional activation RNA binding protein 1,TARBP1)可结合部分RNA干扰因子,调节磷酸化及抑癌基因的表达[8]。近年来,有研究报道PDHA1、TARBP1 与肿瘤发生发展密切相关,但与EGFR突变NSCLC患者预后关系的研究却较少[9-10]。本研究探讨PDHA1、TARBP1 在EGFR突变NSCLC中的表达及对患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2016 年5 月至2018 年5 月在焦作市第二人民医院接受靶向治疗的EGFR突变晚期NSCLC患者。纳入标准:①符合《NCCN 非小细胞肺癌临床实践指南》[11]中关于肺癌的诊断标准,经纤维支气管镜获取肿瘤组织,经病理学检查确诊为NSCLC;②TNM 分期为Ⅲ~Ⅳ期;③基因检测证实存在EGFR突变,接受靶向药物治疗;④入院前未接受过手术、放化疗等任何抗肿瘤治疗;⑤病历资料完整。排除标准:①既往存在其他部位肿瘤;②合并严重感染、血液系统疾病及自身免疫性疾病;③合并严重的肝肾功能障碍、心血管系统等严重疾病;④未规律复诊或随访失访。根据纳入和排除标准,本研究共纳入95 例EGFR突变晚期NSCLC 患者,其中男52 例,女43 例;年龄51~76岁,平均(63.43±9.18)岁;病理类型:腺癌61 例,鳞状细胞癌34 例;TMN 分期:Ⅲ期41 例,Ⅳ期54 例;淋巴结转移76 例,无淋巴结转移19 例;基因检测EGFR突变位点:E19del突变51例,L858R突变44例。
1.2 治疗方法
所有患者均给予靶向药物治疗,吉非替尼250 mg口服,每天1 次,患者出现耐药表现时,再次行基因检测更换靶向药物继续治疗;若患者出现脑转移,予以辅助放疗。
1.3 免疫组化法检测PDHA1、TARBP1 蛋白表达情况
所有患者均经纤维支气管镜取肿瘤组织,石蜡包埋,切片后脱蜡、水化,滴入柠檬酸缓冲液,微波加热,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤,置于3%过氧化氢溶液中10 min 以阻断非特异性染色,PBS 再次洗涤,山羊血清封闭。分别滴加PDHA1、TARBP1 一抗,室温孵育1 h,滴加二抗,室温孵育30 min。二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,脱水、透明后封片观察。将相同浓度且与相应抗体同源的非特异性球蛋白作为阴性对照,将已知的阳性表达的切片作为阳性对照。
由2 名病理科主任医师进行结果判定。PDHA1 主要定位于细胞质,细胞质出现黄色颗粒判定为阳性细胞,依据染色强度和阳性细胞所占比例进行评分:无着色计0 分,淡黄色染色计1 分,中等黄色染色计2 分,棕黄色染色计3 分;无阳性细胞计0 分,阳性细胞所占比例≤10%计1 分,阳性细胞所占比例为11%~50%计2 分,阳性细胞所占比例为51%~80%计3 分,阳性细胞所占比例>80%计4 分;将染色强度评分和阳性细胞所占比例评分相乘,0~4 分判定为PDHA1 表达阴性,5~12 分为PDHA1 表达阳性。TARBP1 主要定位于细胞质,细胞质呈棕黄色判定为阳性,否则判定为阴性。
1.4 随访
患者出院后进行为期3 年的随访,2 年内每3个月到院复查1 次,2 年后每6 个月到院复查1 次,以患者死亡或随访结束为随访终点,记录患者的总生存率。复查内容包括患者主诉、体征、血清肿瘤标志物检测、胸腹部CT 检查、头部CT 或MRI 检查,必要时行全身骨显像检查等。
1.5 统计学方法
采用SPSS 17.0 软件对所有数据进行统计处理,计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验;NSCLC 患者预后的影响因素采用Cox 风险比例回归模型分析;以P<0.05为差异有统计学意义。
2 结果
2.1 PDHA1、TARBP1 表达情况的比较
95例NSCLC患者肿瘤组织中,PDHA1阳性表达率为45.26%(43/95),PDHA1 阴性表达率为54.74%(52/95);TARBP1 阳性表达率为74.74%(71/95),TARBP1 阴性表达率为25.26%(24/95)。
2.2 不同临床特征NSCLC 患者肿瘤组织中PDHA1、TARBP1 表达情况的比较
不同性别、年龄、TMN 分期、病理类型、EGFR突变位点NSCLC 患者肿瘤组织中PDHA1、TARBP1 蛋白的阳性表达率比较,差异均无统计学意义(P>0.05)。分化程度为中低分化、淋巴结转移NSCLC 患者肿瘤组织中PDHA1 阳性表达率分别低于高分化和无淋巴结转移患者,差异均有统计学意义(χ2=6.805、7.743,P<0.05);分化程度为中低分化、淋巴结转移NSCLC 患者肿瘤组织中TARBP1 阳性表达率分别高于高分化和无淋巴结转移患者,差异均有统计学意义(χ2=4.915、23.429,P<0.05)。(表1)
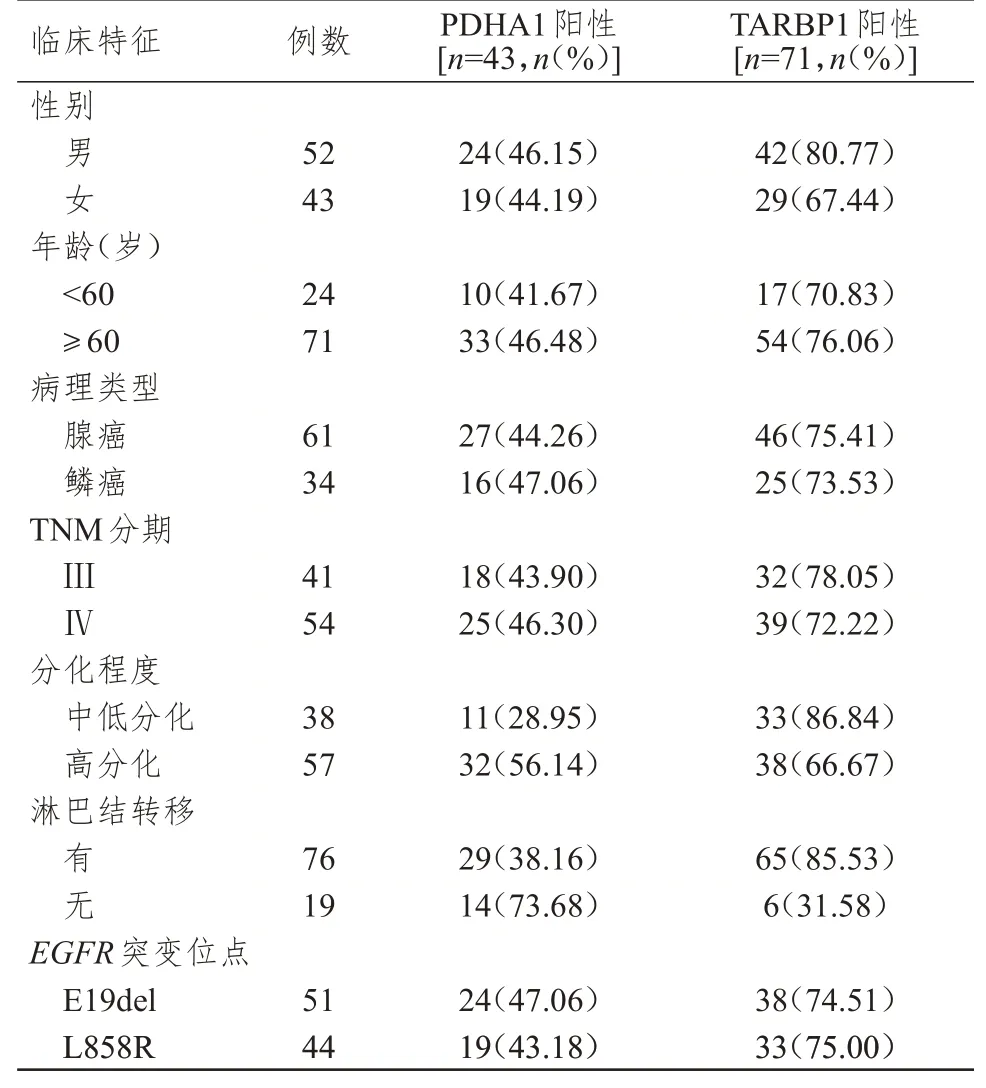
表1 不同临床特征NSCLC 患者肿瘤组织中PDHA1、TARBP1 表达情况的比较(n=95)
2.3 不同PDHA1、TARBP1 表达情况NSCLC 患者预后情况的比较
至随访结束,95 例NSCLC 患者病死67 例,生存28 例。PDHA1 阳性表达患者总生存率为44.2%,明显高于PDHA1 阴性表达患者的17.3%,差异有统计学意义(χ2=7.875,P=0.005)。TARBP1阳性表达患者的总生存率为18.3%,明显低于TARBP1 阴性表达患者的62.5%,差异有统计学意义(χ2=13.744,P=0.000)。(图1、图2)
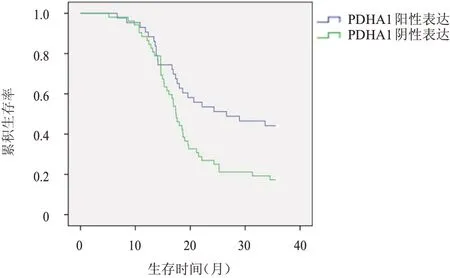
图1 PDHA1阳性表达(n=43)和PDHA1阴性表达(n=52)NSCLC患者的总生存曲线
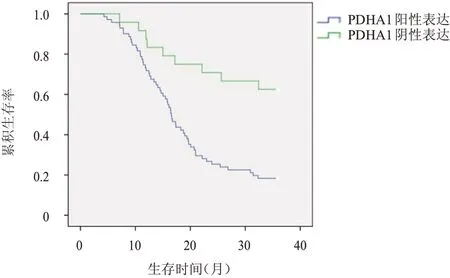
图2 TARBP1阳性表达(n=71)和TARBP1阴性表达(n=24)NSCLC患者的总生存曲线
2.4 NSCLC 患者预后影响因素的单因素和多因素分析
单因素分析结果显示,年龄、TNM 分期均可能与NSCLC 患者的预后无关(P>0.05),分化程度、淋巴结转移情况、吉非替尼耐药情况、PDHA1 表达情况、TARBP1 表达情况均可能与患者的预后有关(P<0.05)。多因素Cox 回归分析结果显示,分化程度为中低分化、有淋巴结转移、PDHA1 表达阴性、TARBP1 表达阳性均是NSCLC 患者预后的独立危险因素(P<0.05)。(表2)

表2 NSCLC 患者预后影响因素的单因素和多因素分析
3 讨论
随着环境恶化及人们生活习惯的改变,肺癌的发病率日益增长[12-13]。多数患者就诊时肺癌已进展至晚期,NSCLC 是其中最常见的类型,且多数患者合并EGFR突变[14]。临床主要采用TKI 治疗EGFR突变的晚期NSCLC 患者,其疗效显著,且不良反应相对较轻[15]。尽管如此,多数晚期NSCLC患者的预后仍不尽如人意。恶性肿瘤的发生发展与细胞增殖、浸润相关的主要基因及蛋白的表达密切相关,由此可见,研究与EGFR突变晚期NSCLC 相关的生物学指标对评估患者的预后有重要价值。宁瑞玲等[16]研究显示,血清糖类抗原125、癌胚抗原水平可为接受靶向治疗的EGFR突变晚期NSCLC 患者的预后提供可靠参考依据。
本研究结果显示,95 例NSCLC 患者肿瘤组织中,PDHA1 阳性表达率为45.26%,阴性表达率为54.74%;TARBP1 阳性表达率为74.74%,阴性表达率为25.26%。表明EGFR突变的NSCLC 患者以PDHA1 阴性表达和TARBP1 阳性表达为主。同时,本研究结果显示,性别、年龄、病理类型、TNM分期、EGFR突变位点均可能与NSCLC 患者肿瘤组织中PDHA1、TARBP1 的表达无关,而分化程度为中低分化、有淋巴结转移的NSCLC 患者肿瘤组织中PDHA1 阳性表达率较低、TARBP1 阳性表达率较高。提示肿瘤组织中PDHA1 阴性表达、TARBP1 阳性表达患者的恶性程度更高,且此类患者的预后较差。本研究选取患者均为晚期,数据具有一定偏倚,PDHA1、TARBP1 表达与可反映肿瘤恶性程度的另一指标TNM分期未见明显相关性。
本研究结果显示,PDHA1 阳性表达患者总生存率为44.2%,明显高于PDHA1 阴性表达患者的17.3%;TARBP1 阳性表达患者的总生存率为18.3% ,明显低于TARBP1 阴性表达患者的62.5%。表明PDHA1 阴性表达、TARBP1 阳性表达患者的预后较差。机体正常细胞获取能量的途径是线粒体氧化磷酸化及糖酵解,而肿瘤细胞的明显特征之一就是以有氧糖酵解为主,PDHA1可促使有氧糖酵解转变为氧化磷酸化,对肿瘤新生血管生成有一定的抑制作用,当PDHA1 表达及活性下调时,肿瘤细胞将快速分裂,更具有侵袭性[17]。此外,有学者发现,PDHA1基因可能参与了肿瘤细胞线粒体呼吸链e 相关反应,进而诱发细胞死亡[18]。TARBP1 可通过JNK/促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)通路调控其相关蛋白磷酸化,同时可结合干扰素诱导的双链RNA(double-stranded RNA,dsRNA)活化蛋白激酶来调节其激活基因与肿瘤抑制基因的表达[19]。近年来,有研究在人类恶性肿瘤中检测出了TARBP1突变[20]。同时,本研究结果显示,分化程度为中低分化、有淋巴结转移、PDHA1 表达阴性、TARBP1 表达阳性均是NSCLC 患者预后的独立危险因素(P<0.05)。表明肿瘤分化程度、淋巴结转移情况、PDHA1 表达和TARBP1 表达均与患者的预后密切相关,肿瘤分化程度低、有淋巴结转移、PDHA1 表达阴性、TARBP1 表达阳性患者的生存时间可能相对较短。
综上所述,接受靶向治疗的EGFR突变晚期NSCLC 患者肿瘤组织中PDHA1 阴性表达率较低、TARBP1 阳性表达率较高,且PDHA1 阴性表达、TARBP1 阳性表达患者的预后较差,分化程度为中低分化、有淋巴结转移、PDHA1 表达阴性、TARBP1表达阳性均是NSCLC 患者预后的独立危险因素。

