癌胚抗原、甲状腺转录因子-1 在评价表皮生长因子受体-酪氨酸激酶抑制剂治疗肺腺癌疗效和预后中的价值
豆亚伟,陈耀华,田伟,王宏涛,吕珊珊
1陕西省人民医院胸外科,西安710068
2空军军医大学第一附属医院西京医院心血管外科,西安7100320
肺癌是呼吸科常见的恶性肿瘤,近年来其发病率逐渐升高,且趋于年轻化,肺腺癌是肺癌中常见的一种病理类型。肺腺癌患者早期症状较为隐匿,大多数患者发现时已经是中晚期,错失了最佳治疗时机,增加了治疗难度,导致患者生存率降低。除早期诊断外,肺腺癌患者治疗方式的选择也与预后有着密切的联系。肺腺癌的治疗方式包括外科手术治疗、放化疗等,随着医学技术的不断发展,恶性肿瘤的治疗逐渐趋向于多学科协作,分子靶向治疗也以高效低毒的优势在临床中崭露头角[1]。分子靶向治疗可有效抑制肿瘤细胞活性及新生血管生成,从而达到治疗的目的。表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)是EGFR基因突变肺腺癌患者的首选治疗方式,其具有使用方便、不良反应小、患者接受度高等优势[2]。然而,临床实践中发现,EGFR-TKI 治疗效果存在明显的个体差异,因此,研究与EGFR-TKI 治疗效果有关的分子标志物对肺腺癌患者的临床治疗具有重要意义。肿瘤标志物可参与肿瘤的发生、发展过程,其水平变化可为临床早期诊断肿瘤及评估治疗效果提供参考依据。血清癌胚抗原(carcinoembryonic antigen,CEA)、甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)对肺腺癌的诊断及鉴别诊断均有一定的价值,但有关两者在肺腺癌治疗效果和预后评估中应用价值的研究较少[3-4]。基于此,本研究分析EGFR-TKI 治疗前后肺腺癌患者的CEA、TTF-1 水平,探讨CEA、TTF-1 在肺腺癌治疗效果和预后评估中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2019 年1 月至2020 年1 月陕西省人民医院收治的肺腺癌患者的病历资料。纳入标准:①经病理学或细胞学检查确诊为肺腺癌;②接受EGFR-TKI 治疗;③临床分期为Ⅲb 期或Ⅳ期;④治疗前美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分为0~3 分[5];⑤经影像学检查,可评估近期疗效;⑥临床资料完整。排除标准:①合并其他恶性肿瘤;②入院前接受过放化疗等抗肿瘤治疗;③合并凝血功能障碍、重度贫血;④妊娠期女性;⑤EGFR-TKI 治疗药物不耐受。依据纳入和排除标准,本研究共纳入158 例患者。其中,男81 例,女77 例;年龄38~75 岁,平均(58.26±4.55)岁;临床分期:Ⅲb 期49 例,Ⅳ期109例;采用聚合酶链反应检测EGFR突变情况:19 号外显子缺失86 例,21 号外显子错义突变72 例。
1.2 治疗方法
所有患者均接受EGFR-TKI 治疗:口服250 mg吉非替尼或口服150 mg 厄洛替尼,每天1 次,21 天为1 个周期,至少治疗2 个周期。
1.3 临床疗效评价
治疗2 个周期后进行头颅、胸腹部影像学检查,采用世界卫生组织(WHO)实体瘤疗效评价标准[6]评价患者的临床疗效:完全缓解,肿瘤病灶完全消失,至少持续1 个月;部分缓解,肿瘤病灶最大直径与最大垂直直径的乘积缩小≥50%,至少持续1 个月;疾病稳定,肿瘤病灶最大直径与最大垂直直径的乘积缩小<50%或增大<25%;疾病进展,肿瘤病灶最大直径与最大垂直直径的乘积增大≥25%或出现新病灶。客观缓解率=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
1.4 血清CEA、TTF-1 水平检测
治疗前及治疗后4周分别抽取患者静脉血3 ml,3000 r/min 离心10 min,离心半径为10 cm,获取上清液待检。采用电化学发光免疫法检测CEA 水平,正常参考值为0~3.4 ng/ml;采用酶联免疫吸附试验检测TTF-1 水平,正常参考值为0~13.6 μg/L。
1.5 随访方法
所有患者出院后均以电话、门诊、短信等方式进行随访,随访截止时间为2022 年1 月1 日。患者出现疾病进展或死亡为预后不良,生存且无疾病进展为预后良好。
1.6 观察指标
记录患者的临床疗效,比较治疗前后肺腺癌患者的CEA、TTF-1 水平,比较治疗后疾病控制与疾病进展肺腺癌患者的CEA、TTF-1 水平,分析EGFR-TKI 治疗后肺腺癌患者预后的影响因素。
1.7 统计学方法
采用SPSS 20.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Logistic 回归模型分析EGFR-TKI 治疗后肺腺癌患者预后的影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
158 例患者经EGFR-TKI 治疗后4 周,完全缓解4 例(2.53%),部分缓解36 例(22.78%),疾病稳定69 例(43.67%),疾病进展49 例(31.01%),客观缓解率为25.32%(40/158),疾病控制率为68.99%(109/158)。
2.2 治疗前后肺腺癌患者CEA、TTF-1 水平的比较
治疗后肺腺癌患者的CEA、TTF-1 水平均明显低于治疗前,差异均有统计学意义(P<0.01)。(表1)
表1 治疗前后肺腺癌患者CEA、TTF-1 水平的比较(±s)
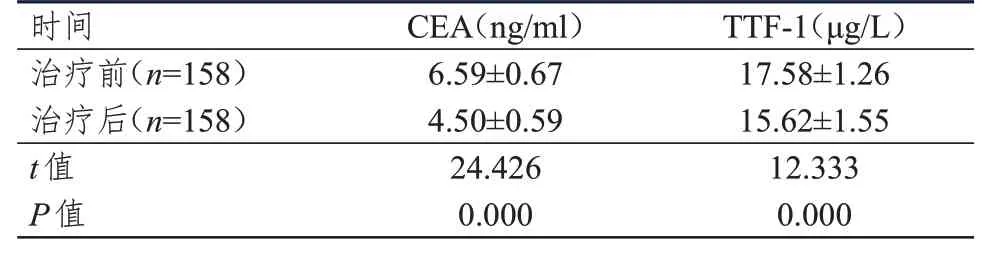
表1 治疗前后肺腺癌患者CEA、TTF-1 水平的比较(±s)
?
2.3 治疗后疾病控制与疾病进展患者CEA、TTF-1水平的比较
治疗后疾病控制肺腺癌患者的CEA、TTF-1 水平均明显低于疾病进展患者,差异均有统计学意义(P<0.01)。(表2)
表2 治疗后疾病控制与疾病进展患者CEA、TTF-1水平的比较(±s)

表2 治疗后疾病控制与疾病进展患者CEA、TTF-1水平的比较(±s)
?
2.4 EGFR-TKI治疗后肺腺癌患者预后影响因素的单因素分析
158 例患者均未失访,其中预后良好107 例,预后不良51 例。预后良好与预后不良肺腺癌患者的性别、年龄、吸烟史、EGFR突变情况比较,差异均无统计学意义(P>0.05)。预后良好与预后不良肺腺癌患者的临床分期、肿瘤转移情况、CEA 水平、TTF-1 水平比较,差异均有统计学意义(P<0.05)。(表3)
2.5 EGFR-TKI治疗后肺腺癌患者预后影响因素的多因素分析
以表3 中差异有统计学意义的因素作为自变量,以肺腺癌患者预后作为因变量进行Logistic 回归分析,结果发现,临床分期为Ⅳ期、肿瘤转移、CEA 水平≥3.4 ng/ml、TTF-1 水平≥13.6 μg/L 均是EGFR-TKI 治疗后肺腺癌患者预后的独立危险因素(P<0.05)。(表4)
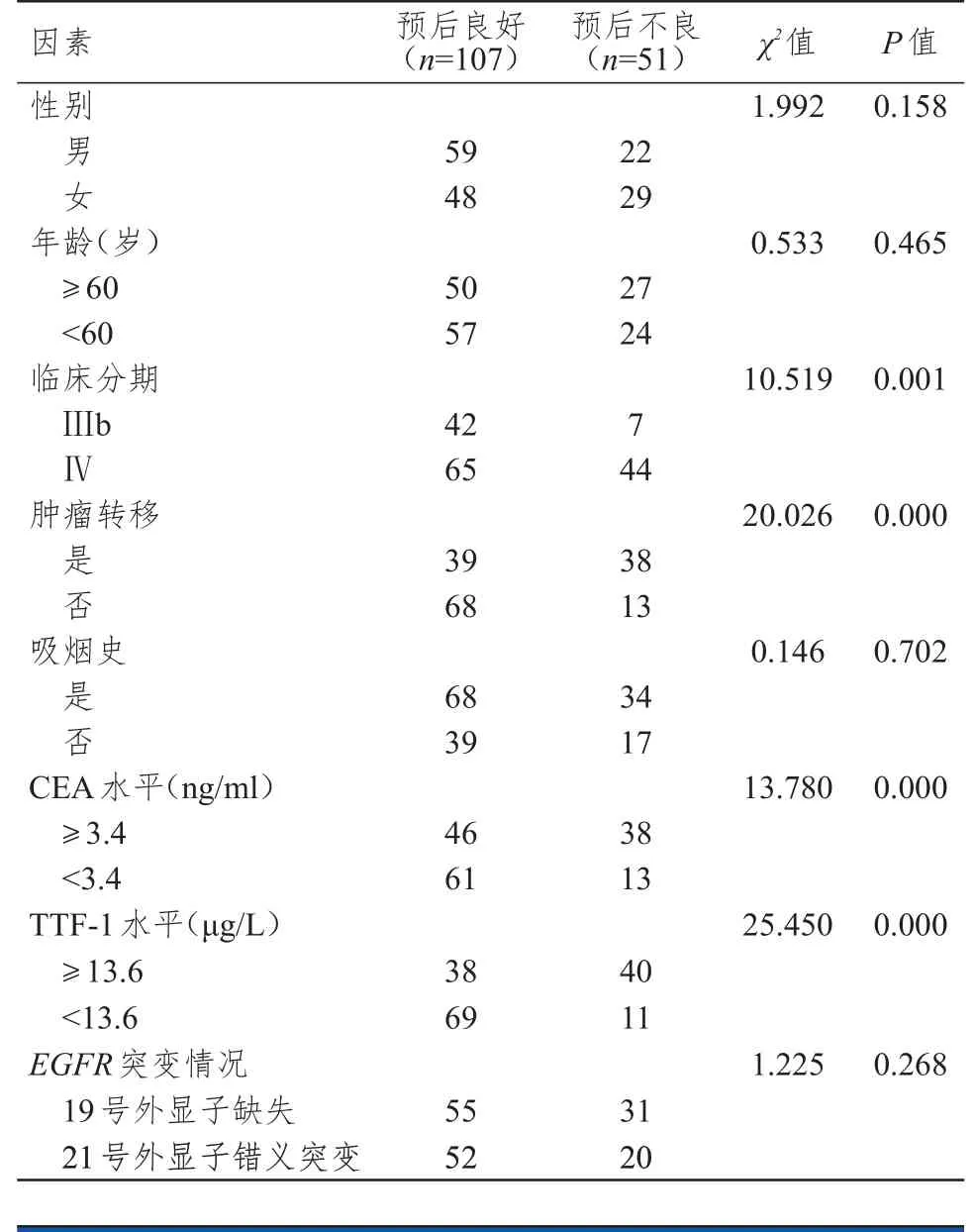
表3 EGFR-TKI 治疗后肺腺癌患者预后影响因素的单因素分析

表4 EGFR-TKI 治疗后肺腺癌患者预后影响因素的多因素分析
3 讨论
实体瘤疗效评价标准对肿瘤治疗效果的评价具有一定的临床价值,但是无法对存在胸腔积液、弥漫性病灶、无法测量病灶的患者进行评价,对是否存在肿瘤组织更是无法评估,难以反映真实的治疗效果[7]。因此,选择更有效的指标来评估肺腺癌患者的治疗效果具有重要的临床意义,而且能够在一定程度上减少患者经济负担。EGFR-TKI可以阻断EGFR 信号通路,发挥分子靶向药物的抗肿瘤作用[8]。以往研究显示,EGFR-TKI 的抗肿瘤作用多表现为促进肿瘤坏死及空洞形成,较少会导致肿瘤体积发生变化,在患者无明显肿瘤体积缩小的情况下能够延长患者的生存期,抑制疾病进展[9]。采用实体瘤疗效评价标准评估EGFR-TKI的治疗效果不佳,往往会低估其治疗效果。
肿瘤标志物是反映肿瘤生长与存在的有效指标,广泛应用于肿瘤患者的疗效及预后评估中。有研究发现,血清肿瘤标志物水平异常多早于影像学改变,尤其对于无症状的患者,检测肿瘤标志物有助于肿瘤的早期诊断,且肿瘤标志物可于体外进行检测,操作简便、无创伤、重复性好,在多种肿瘤的筛查、诊断、预后评估中具有较好的应用前景[10]。CEA 是一种与细胞黏附有关的糖蛋白,最初在胚胎发育过程中产生,在出生后停止分泌,一般在健康人群中表达水平很低[11]。CEA 存在于恶性肿瘤和胚胎组织中,最初作为结肠癌的诊断标志物应用于临床检测,后来发现其在肺癌中也呈高表达,在肺腺癌患者中升高尤其显著,因此也常作为肺腺癌的辅助诊断依据。有研究显示,经吉非替尼治疗的非小细胞肺癌患者,若CEA 水平升高,预示着预后不良,生存时间较短,CEA 可作为肺腺癌患者病理分型、临床分期、疗效判断、预后评估的有效指标[12]。也有研究表明,非小细胞肺癌患者经EGFR-TKI 治疗4 周后,CEA 水平出现变化,且与患者的影像学改变、生存情况密切相关[13]。
TTF-1 是甲状腺增强子结合蛋白,是一种相对分子量为40 kD 的核蛋白,主要表达于细胞核,因此其在免疫细胞化学的定位分析上具有技术上的特异性。即使只存在极少量的异型细胞,也能很好地表达TTF-1。在Ⅱ型肺泡上皮细胞、肺Clara细胞、支气管上皮的基底细胞等肺组织中均可见TTF-1 表达。临床中发现,原发性肺腺癌患者中TTF-1 阳性表达多见,且TTF-1 单独诊断肺腺癌的灵敏度、特异度均较高,同时可与其他指标联合,评估转移性肺腺癌的原发病灶。此外,TTF-1 在非小细胞肺腺癌和鳞状细胞癌的鉴别诊断中也有较好的应用价值。研究显示,TTF-1 与EGFR基因突变存在着较强的相关性,其在临床中可用于肺癌的诊断[14]。另有研究显示,经EGFR-TKI 治疗后血清TTF-1 高表达肺腺癌患者的3 年总生存率明显低于TTF-1 低表达患者[15]。也有研究显示,TTF-1阴性肺腺癌患者的疾病控制率明显高于TTF-1 阳性患者,总生存时间明显长于TTF-1 阳性患者[16]。
本研究结果显示,经EGFR-TKI 治疗后,158 例肺腺癌患者的客观缓解率为25.32%,疾病控制率为68.99%,临床疗效较好。对比治疗前后肺腺癌患者的CEA、TTF-1 水平,结果发现,治疗后肺腺癌患者的CEA、TTF-1 水平均明显降低,且疾病控制患者的CEA、TTF-1 水平均明显低于疾病进展患者,与以往研究结果一致[17]。说明CEA、TTF-1 可能与肺腺癌的发生发展有关,监测其水平变化有助于评估治疗效果,对患者治疗方案的调整具有重要的参考价值。对患者进行随访,结果发现,预后良好与预后不良肺腺癌患者的临床分期、肿瘤转移情况、CEA 水平、TTF-1 水平比较,差异均有统计学意义(P<0.05),临床分期越高、出现肿瘤转移、CEA 和TTF-1 水平越高的患者,其预后不良的可能性越高。多因素分析结果显示,临床分期为Ⅳ期、肿瘤转移、CEA 水平≥3.4 ng/ml、TTF-1 水平≥13.6 μg/L 均是EGFR-TKI 治疗后肺腺癌患者预后的独立危险因素(P<0.05),与以往的研究结果相符[18]。提示CEA、TTF-1 与肺腺癌患者的疾病进展有关,检测两者水平变化可能对病情及临床治疗效果的评估具有一定的参考价值。临床中需要重视存在危险因素的患者,加强治疗前后的相关护理,提高患者治疗过程中的依从性,对提高治疗效果具有积极意义。对于CEA、TTF-1 高表达的肺腺癌患者,可进行分子靶向治疗,但有关其治疗药物的应用有待深入研究。但本研究也存在一定的局限,纳入的样本量较小,而且未分析患者的远期生存情况,仍需要进一步研究。
综上所述,CEA、TTF-1 与肺腺癌患者EGFRTKI 治疗的临床疗效及预后有关,有可能成为判断疗效及预后的标志物。

