抑瘤素M在脓毒症诊断及预后评估中的作用
包志远, 李从圣, 张 琳, 胡承志, 宋秋鸣, 武道荣
脓毒症是由于宿主对感染的反应失调引起的危及生命的多器官功能障碍[1]。脓毒症是全世界范围内感染致死的最主要原因,严重威胁人类健康[2]。据统计,全球脓毒症的总体发病率在每年3000万例,2017年全球4890万脓毒症患者中,有1100万患者死亡[3-4]。近年来,尽管抗感染治疗和器官功能支持技术的发展,但脓毒症的病死率仍高达30%~40%[4]。而脓毒症早期干预可以显著降低脓毒症患者住院病死率[5],因此,早诊断、早治疗对于脓毒症患者的预后至关重要。
抑瘤素 M(oncostatin M, OSM) 是白细胞介素-6 (IL-6) 细胞因子家族的成员[6],由单核细胞、巨噬细胞、T 细胞、中性粒细胞和树突细胞等多种细胞产生[7]。在IL-6家族成员中,OSM可通过2种受体发出信号:1型受体是白血病抑制因子受体β和膜糖蛋白130的复合体;2型受体则是OSM受体β链和膜糖蛋白130的复合体[8]。因此,OSM在抗炎、代谢功能、再生和造血方面具有多种其他 IL-6 家族细胞因子不具备的独特作用[9]。研究表明,OSM与骨髓炎[10]、哮喘[11]、中枢神经炎症性疾病[12]、细菌性肺炎[13-14]等多种疾病有关。但OSM在脓毒症的诊断及预后中的作用还没有得到详细的阐述,本文将探讨OSM在脓毒症诊断及预后评估中的作用。
1 资料与方法
1.1研究对象及分组 采取前瞻性队列研究,选择2020年9月至2021年8月合肥市第一人民医院急诊、急诊ICU及综合ICU新发脓毒患者41例为实验对象。纳入标准:符合2016年制定的脓毒症3.0诊断标准,感染或高度怀疑感染并SOFA评分≥2分即可诊断脓毒症[1]。排除标准:①患者或家属非自愿参加本研究;②年龄<18周岁;③入院24 h内死亡或不足24 h;④孕产妇;⑤合并恶性肿瘤、血液系统及免疫缺陷疾病;⑥入院前使用抗生素及患严重心、肝、肾疾病;⑦正在使用抗凝剂或激素。根据实验分为脓毒症组及脓毒性休克组(充分液体复苏后仍需使用血管升压药维持血压≥65 mm Hg或血乳酸>2 mmol/L)[1]。选取同期健康体检中心年龄、性别相似的健康者40人为对照组。本研究由医院伦理委员会审批通过[伦研批第2019(21)号]。
1.2临床资料 收集患者的临床资料,包括年龄、性别、白细胞、降钙素原(PCT)、C反应蛋白和IL-6等相关信息,计算患者入院时急性生理和慢性健康状况评分Ⅱ(APACHEⅡ)及序贯器官衰竭评分(SOFA),观察时间设定为28 d,根据患者的生存情况分为生存组和死亡组。
1.3血清OSM检测 在患者入院后1 h内采集外周静脉血5 mL,EDTA抗凝,3000 r/min离心5 min,取上层血清于EP管中,-80 ℃冰箱内保存,避免反复冻融。采用酶联免疫吸附法(ELISA)测定患者血清中OSM水平,OSM试剂盒由江苏晶美生物科技有限公司提供,操作严格按照说明书执行。
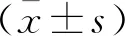
2 结果
2.1一般临床资料 对照组、脓毒症组和脓毒性休克组年龄、性别构成比等差异无统计学意义(P>0.05),脓毒症组、脓毒性休克组患者血清OSM水平均高于对照组(Z分别为-2.819、-4.425,P<0.05)。脓毒症组与脓毒性休克组血清OSM比较差异有统计学意义(Z=-2.556,P<0.05)。见表1。
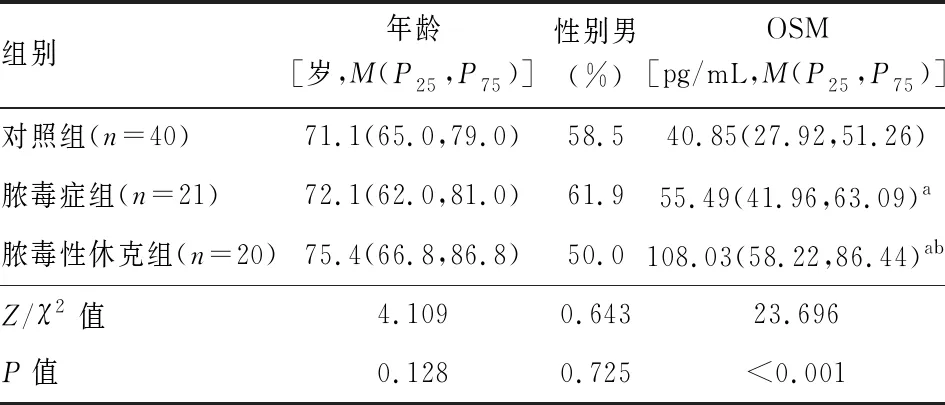
表1 实验组和对照组一般资料、血清OSM水平比较
2.2血清OSM对脓毒症的诊断效能 计算各个坐标约登指数,可以确定血清OSM约登指数最大时,其截断值为52.85 pg/mL,此截断值对诊断脓毒症的敏感度63.4%,特异度80.5%,ROC曲线下面积为0.785(95%CI0.688,0.882)。见图1。
2.3脓毒症预后效能分析 死亡组和生存组PCT、IL-6、APACHEⅡ评分、SOFA评分、OSM差异有统计学意义(P<0.05),年龄、性别差异无统计学意义(P>0.05)。见表2。

表2 死亡组和生存组相关指标比较
2.4ROC曲线分析各指标对脓毒症预后的预测价值 根据ROC曲线分析显示,IL-6预测脓毒症预后最佳,敏感度为85.7%,特异度为80.0%,其次为SOFA评分和血清OSM。见图2、表3。

表3 各指标预测脓毒症预后ROC分析
2.5预后危险因素 以脓毒症患者是否生存(生存=0,死亡=1)、生存时间为因变量,以IL-6、SOFA评分、OSM等为自变量进行多因素Cox回归分析,结果显示IL-6、SOFA评分和血清OSM为脓毒症预后的危险因素(P<0.05)。见表4。

表4 脓毒症预后危险因素分析
2.6生存曲线分析 生存分析显示,血清OSM>65.55 pg/mL脓毒症患者28 d病死率高于血清OSM≤65.55 pg/mL的脓毒症患者(P<0.001)。见图3。
3 讨论
脓毒症作为常见的急危重症之一,因发病的隐匿性和病情进展的迅速性,使其成为威胁人类健康主要原因之一。目前,脓毒症因无特异性临床表现,在早期诊断上尚无明确的统一标准,但脓毒症的早识别、早治疗可以降低患者病死率。临床上常见的指标,如白细胞和C反应蛋白虽能明显反映出机体感染,但其特异性较差,非细菌性感染时也会升高。因此,寻找敏感度、特异度高的生物标志物一直是脓毒症研究的重要方向。
OSM因其抑制A375黑色素瘤细胞生长的能力而得名[15],作为IL-6细胞因子家族的一员,OSM在炎症、组织损伤等方面具有多种作用。既往研究表明,OSM在骨髓炎[10]、哮喘[11]、中枢神经炎症性疾病[12]、细菌性肺炎[14]和炎症性肠病[16]等多种炎症性疾病中发挥重要作用。同时有研究[17]表明,OSM可调节促炎细胞因子如 IL-6的产生,促进其在炎症发挥作用。由于OSM在全身炎症反应中的作用,OSM可能在脓毒症的炎症信号传导中发挥重要作用。但是,目前关于OSM在脓毒症中的作用相关研究较少,仅部分研究表明OSM在脓毒性休克的患者也可以检测到明显升高[18]。OSM基因表达也在脓毒症早期明显上升[19],虽然OSM在脓毒症中的具体机制目前尚未完全清晰,但OSM与脓毒症的发生发展存在密切联系。
本研究发现,血清OSM在健康者、脓毒症患者及脓毒性休克患者中差异有统计学意义,且在脓毒症患者中明显升高。结合ROC曲线分析,OSM对脓毒症诊断的敏感度和特异度分别为63.4%、80.5%,表明血清OSM水平可能对脓毒症诊断具有一定的价值。与此同时,可以观察到脓毒性休克组血清OSM水平较脓毒症组升高,这提示高血清OSM水平可能与疾病严重程度相关。Pothoven等[20]研究表明,低浓度OSM水平可以发挥机体保护作用,控制炎症的发生和发展,而高浓度OSM水平作用却相反,不仅促进炎症反应发生发展,而且破坏机体原有的屏障功能。本研究的结果与其一致。本研究还发现,死亡组血清OSM水平明显高于生存组。Cox回归分析显示,血清OSM为脓毒症预后的危险因素,且血清OSM>65.55 pg/mL患者28 d病死率明显高于血清OSM<65.55 pg/mL患者,这可能与高水平血清OSM可以加重患者组织损伤,促进炎症反应等作用相关。因此OSM可作为预测脓毒症预后的标志物。
综上所述,血清OSM对脓毒症诊断具有一定的价值,OSM作为脓毒症预后的危险因素,对脓毒症的严重程度及预后具有提示和预测作用。

