氯化镉对小鼠肝脾系数及病理组织学变化影响的研究
张玉媛, 芈静, 鲁静
镉是一种应用广泛的有毒重金属元素,它有多种暴露途径,如职业性暴露、生活性暴露(饮水、吸烟、食物)等[1],这种环境污染物在生物体内的半衰期超过了20年[2],一旦进入机体,镉能够在体内很多器官蓄积进而发挥其毒性损伤作用,如神经系统、免疫系统等[3]。肝脏是机体新陈代谢的重要器官,也是这种环境污染物的主要靶器官,镉能够对肝脏造成毒性损伤[4],但是肝毒性机制至今都还没有分析透彻,仍需继续进行实验研究[5]。脾是与造血、免疫功能调节相关的器官,也是镉毒作用的主要靶器官之一,镉能够引起胸腺萎缩和脾肿大,进而损伤免疫系统[6-7],其损伤机制可能与金属硫蛋白、炎症等有关,有待于进一步探讨[8]。
本实验采用腹腔连续注射染毒方式,通过对成年小鼠连续染毒14 d,观察不同剂量的CdCl2(0.5、1.0、2.0 mg/kg)对成年小鼠的影响,通过脏器系数的改变观察氯化镉暴露对小鼠肝脏和脾脏的影响,通过病理学检查观察小鼠肝脏和脾脏的病理学变化,同时通过对血清中CAT、GSH的检测了解实验动物氧化应激水平,通过氯化镉对小鼠肝脏、脾脏的变化和氧化应激水平的改变,初步探讨氯化镉对小鼠肝脾毒性及作用机制,为进一步研究提供思路和方向。
1 材料与方法
1.1 主要试剂 氯化镉(CdCl2)分析纯购自国药集团化学试剂有限公司,本实验所用试剂盒(过氧化氢酶(CAT)、谷胱甘肽(GSH))均购自南京建成生物工程研究所。
1.2 实验动物 SPF级ICR小鼠24只,体质量24~26 g,雌雄各半,购自常州卡文斯实验动物有限公司,动物合格证号:SCXK(苏)2011-0003,实验前适应性喂养1周[标准饲料喂养,正常饮食,每天循环8:00起照明12 h, 20:00起黑暗12 h,温度20~25 ℃,湿度(50±5)%]。本实验遵循“NIH实验用动物管理和使用指南”,禁止虐待实验动物,所有操作程序按照蚌埠医学院动物伦理委员会相关要求进行。
1.3 实验动物处理及分组 24只实验动物按照随机数字表法分为4组,每组6只,分别是氯化镉染毒组和对照组,CdCl2溶解于0.9%的生理盐水中,4组分别是CdCl20.5、1.0、2.0 mg/kg和NS对照组。实验动物每天称量后经腹腔注射(10 mL/kg)相应剂量的CdCl2。
1.4 体质量及脏器质量 每次实验动物处理前均严格称量体质量,分别在染毒14 d后取材,实验动物颈椎脱臼处死后冰上取出肝脏和脾脏称量计算肝脏和脾脏系数。脏器系数=脏器质量(g)×100/体质量(g)。
1.5 血清中CAT及GSH检测 末次染毒后小鼠经眼球采血,全血室温静置1 h后经4 000 r/min、离心10 min,收集上清后进行相关指标的测定。实验操作流程严格遵循试剂盒要求进行,其中GSH含量的测定采用分光光度法,CAT活力的测定采用可见光法。
1.6 组织病理学检查 末次染毒后,取部分肝脏和脾脏称重后置于4%多聚甲醛固定48 h后,常规脱水进行石蜡包埋、连续切、展片、脱蜡、HE染色,Olympus DP73荧光显微镜镜下观察。

2 结果
2.1 各组小鼠体质量比较 染毒期间实验动物染毒部位无明显炎症性反应,实验组小鼠无死亡现象,但实验中发现,CdCl22.0 mg/kg组小鼠活动度稍低,精神较萎靡,体质量增长缓慢,连续染毒14 d后,各处理组体质量增加程度不同(F=4.096,P<0.05),CdCl22.0 mg/kg组增加(0.23±1.1)g,低于NS对照组(1.7±0.7)g和CdCl20.5 mg/kg组(1.7±0.9)g。
2.2 各组小鼠肝脏的比较
2.2.1 各组小鼠肝脏系数比较 经观察发现,暴露14 d后,各暴露组肝脏系数均显著增加,高于对照组,但各暴露组间比较差异无统计学意义。见表1。

表1 氯化镉对小鼠肝脏系数的影响
2.2.2 各组小鼠肝脏组织形态的光镜观察 镉暴露组小鼠肝脏肿大,经HE染色后镜下观察发现,各组肝小叶均结构清晰,肝细胞索排列规整,但是镉暴露能够引起部分肝细胞坏死、炎细胞浸润、肝细胞脂肪变性。CdCl22.0 mg/kg组镜下白色箭头所指处可见小灶性肝细胞坏死伴炎细胞浸润,同时可见肝小叶内点状坏死(黑色箭头),高倍镜下,可见肝细胞有不同程度的水肿(白虚圈),部分肝细胞核稍大(白圈),同时部分肝细胞内有脂肪变性(黑圈)。见图1。

1A CdCl2 2.0 mg/kg(HE染色×200) 1B CdCl2 2.0 mg/kg(HE染色×400)
2.3 各组小鼠脾脏的比较
2.3.1 各组小鼠脾脏系数比较 镉暴露组脾脏明显增大、水肿、脏器增重明显,CdCl20.5 mg/kg、1.0 mg/kg和2.0 mg/kg组脾脏系数均高于对照组,同时2.0 mg/kg组高于0.5 mg/kg组。见表2。
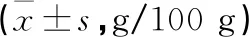
表2 氯化镉对小鼠脾脏系数的影响
2.3.2 各组小鼠脾脏组织形态的光镜观察 各镉暴露组小鼠脾脏均明显增重,脾脏出现不同程度的代偿性增生,以CdCl22.0 mg/kg组脾脏增重最为明显。镜下检查发现,生理盐水对照组小鼠脾脏红髓、白髓边界清楚,淋巴细胞排列紧密;2.0 mg/kg剂量组巨核细胞增大、数量增多。组织形态学变化如图2所示。

2A CdCl2 2.0 mg/kg(HE染色×200) 2B CdCl2 2.0 mg/kg(HE染色×400)
2.4 各组小鼠血清GSH及CAT水平比较 与对照组比较,2.0 mg/kg组GSH和CAT水平均下降(P<0.05);与0.5 mg/kg组比较,2.0 mg/kg组CAT表达水平下降(P<0.05)。见表3。
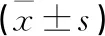
表3 氯化镉对小鼠血清中GSH、CAT的影响
3 讨论
镉是一种重要的环境污染物之一,其暴露途径广泛,既有职业性暴露,也有生活性的接触,这种重金属进入机体后可引起机体多个部位和脏器发生损伤,镉暴露是人群不良健康结局的一个危险因素[1]。本次实验通过连续性氯化镉腹腔注射染毒14 d,观察不同剂量氯化镉对小鼠肝脏和脾脏系数的影响,同时观察其对小鼠肝脾的病理学改变,通过检测血清中抗氧化酶GSH和CAT的活性了解机体氧化应激水平。
结果显示,实验小鼠在染毒前、染毒14 d体质量均无显著差别,但是也发现CdCl22.0 mg/kg组小鼠精神状态较差,活动度减少,同时各组在染毒期间体质量增加程度不同,CdCl22.0 mg/kg组体质量增加低于NS对照组和CdCl20.5 mg/kg组,这些现象提示镉对机体的正常的生命活动产生了一定的影响[9]。
实验动物在染毒后肝脏、脾脏的脏器系数有了一定的改变,但是改变的程度不同。脏器系数能够反映化学毒物对脏器的毒害作用,脏器系数的改变可以间接指示机体的损伤情况,机体在正常时脏器系数比较稳定,因此,观察实验动物脏器系数的改变可以观察外源性化学物对机体的损伤程度[10]。肝脏对于化学毒物具有很强的结合能力,也是镉毒作用的靶器官之一,本实验剂量下,暴露组小鼠肝脏在染毒14 d后变大、水肿,肝脏系数高于对照组,结合肝脏HE镜下观察,肝脏组织中发生细胞坏死、炎症反应、水肿甚至脂肪变性,提示本实验剂量下持续性镉暴露对小鼠造成肝脏损伤,肝脏质量增加,出现肝细胞炎症、坏死等损伤表现,有文献指出,肝脏持续的的炎症反应可以造成肝脏的慢性炎症性改变,继而加重肝脏组织的损伤[11]。目前关于镉诱导肝损伤机制包括了氧化应激、炎症反应、细胞凋亡等等,但是其确切的损伤机制仍有待于进一步探讨和研究[5]。
免疫系统具有重要的防御能力,脾脏是重要的外周免疫器官,是免疫系统中不可缺少的一部分。本实验选用小鼠的脾脏作为观察对象,实验结果发现,染毒小鼠脾脏发生水肿、增生肥大等一系列的反应,各染毒组脾脏系数均显著增高,这些结果提示氯化镉暴露对小鼠的脾脏有一定的毒性损伤作用。脾脏是与造血、免疫功能调节相关的器官,也是镉毒作用的靶器官之一[6],脾脏的结构和脾脏系数的变化反映了机体的免疫功能[12],也是衡量机体免疫功能的一个初步指标[13]。正常情况下,骨髓以外的组织出生后不再参与造血,但是在某些病理状态下,譬如当小鼠骨髓造血机能损伤后,脾脏可代偿性髓外造血,并造成器官的相应肿大,所以通过脾脏系数的变化可间接了解小鼠的造血能力[14-15],在本实验中,各暴露组脾脏系数显著高于对照组,这说明在本实验剂量下,镉可致小鼠脾质量显著增加,诱发小鼠脾脏肿大;同时病理检查也发现各染毒组脾脏出现不同程度代偿性病变,这些现象提示在本实验剂量下,氯化镉对小鼠脾脏产生了一定的影响。
实验数据提示镉暴露组抗氧化体系如GSH和CAT的表达有一定水平的下降,GSH和CAT主要发挥抗氧化作用[16],镉的毒性损伤与氧化损伤有关[17],本实验结果提示镉能够影响机体氧化还原平衡,打破了机体氧化和抗氧化系统之间的平衡,细胞内源性抗氧化应激能力下降,造成机体的毒性损伤。
综上所述,镉损伤了肝脏和脾脏的基本结构和功能,其对肝脏和脾脏等脏器的损伤可能通过多种途径,譬如氧化应激、炎症反应等,本研究内容比较肤浅,至于这种环境污染物引起脏器损伤的分子机制及其相关作用关系还有待于进一步探讨。

