基于生物信息学方法筛选扩张型心肌病相关基因并分析潜在药物
施展,张步春
扩张型心肌病(dilated cardiomyopathy,DCM)是一种表现为左室或双室室腔增大并伴有舒张或收缩功能障碍的心肌病,是引发心力衰竭、心律失常和猝死的常见心肌病[1]。到目前为止,已发现多个编码肌节蛋白、细胞骨架、核膜、肌膜、离子通道和细胞间连接分子的相关基因参与了DCM的发病机制[2]。编码肌联蛋白(TTN)的基因突变被认为是DCM的最常见原因。此外,LMNA基因(核纤层蛋白)、FLNC(丝蛋白C)、Des(结蛋白)、PLN(磷蛋白)、SCN5A等位基因突变已被确认为DCM的恶性原因[2]。但DCM患者的个体化风险预测和治疗仍然具有挑战性,根据当前指南建议的最佳药物治疗构成了DCM治疗的基础,然而,目前对DCM心衰的治疗与一般的心衰治疗没有什么不同,疾病修饰药物对DCM离子和结构改变的影响还没有得到很好的描述[1,3]。因此,得益于分子生物学及统计学的发展,本研究将运用生物信息学手段基于GEO数据库着重于DCM的差异表达基因及由此探讨可能的治疗方案。
1 材料与方法
1.1 数据材料收集 从GEO数据库(https://www.ncbi.nlm.nih.gov/)下载了基于GPL570平台的2个基因芯片数据集(GSE17800和GSE19303),其中GSE17800数据集包括接受免疫吸附后行IA/IgG治疗之前的DCM活检标本40例和用于对照的活检标本8例;GSE19303包括接受IA/IgG治疗之前和之后6个月收集的33对DCM患者样本和8例用于对照的活检标本。为了得到的结果更具有参考价值,本研究的标准仅纳入未经IA/IgG治疗的DCM患者心肌样本和正常心脏的心肌样本,共得到来源于GSE17800数据集的接受IA/IgG治疗之前的DCM患者标本40例和正常心脏标本8例,以及来源于GSE19303数据集的接受IA/IgG治疗之前DCM患者标本33例及正常心脏标本8例。
1.2 数据的处理与基因筛选 对上述2个数据集运用R语言分别进行主成分分析(PCA),对比组别间的分布情况,并设置|Log2FC|>1,adj.P<0.05作为筛选条件分析各数据集并确定DEGs。得到的2张基因芯片中共同DEGs会包括上下调不一致的基因,如果直接将2张芯片得到的共同DEGs混在一起进行分析,可能会混入假阳性结果,且相对于正常样本表达上调的基因显然更具有意义,因此我们只分析共同差异基因中表达上调的基因。运用R语言对上述2个数据集获得的DEGs分别绘制热图,并对2个数据集筛选得到的差异表达上调基因运用韦恩图(Venn Diagramm)取交集,获得与DCM相关的候选差异基因。
1.3 共同DEGs的GO、KEGG及GSEA富集分析 提取上述共同的上调DEGs,运用R语言进行GO功能分析和KEGG通路分析,设置P<0.1和adj.P<0.2为筛选条件,筛查差异基因的主要富集功能和通路,并据此进行了可视化,并对2张芯片分别进行了GESA富集分析探究DCM的主要信号通路。
1.4 共同的DEGs的蛋白互作网络分析(PPI) 运用STRING在线数据库(https://cn.string-db.org/)对上述共同DEGs进行蛋白互作网络分析(PPI),并运用Cytoscape软件对其进行分析,运用MCODE插件筛选出重要基因。
1.5 差异基因-药物相互作用分析 将上述得到的差异基因输入DGIdb(https://dgidb.genome.wustl.edu/)在线数据库挖掘潜在靶向治疗药物,并将得到的差异基因与GeenCards(https://www.genecards.org/)在线数据库中DCM相关基因取交集,得到相关基因。
2 结果
2.1 DCM相关的差异基因的筛选 经过筛选,我们得到来源于GSE17800数据集的接受IA/IgG治疗之前的DCM患者标本40例和正常心脏标本8例,来源于GSE19303数据集的接受IA/IgG治疗之前DCM患者标本33例及正常心脏标本8例。采用R语言进行主成分分析(PCA),通过PCA图观测样本分组间聚类情况。见图1A、1B。2组数据集出现了高度一致的聚类结果。通过R语言我们分别筛选出了2组数据集的差异基因。
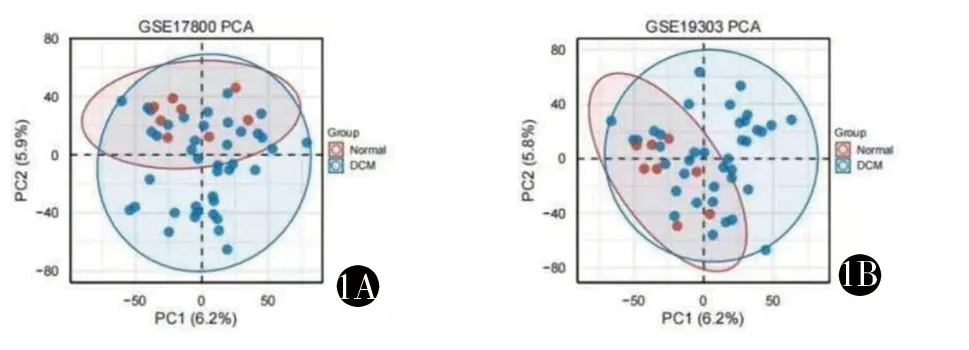
1A GSE17800主成分分析图 1B GSE19303主成分分析图
上述结果包括有关DCM的上调基因,经过筛选,我们从GSE17800数据集中得到表达上调的DEGs68个,GSE19303数据集中得到表达上调的表达基因65个,将这些根据筛选条件得到的有意义的结果用热图进行展示,由此可以看出各组样本的差异基因表达较为一致。见图2A、2B。绘制韦恩图得到2个数据集的共同差异表达上调基因,得到 60个与DCM相关的共同差异表达上调基因。见图2C。

2A GSE17800热图 2B GSE19303热图 2C 表达差异上调基因韦恩图
2.2 DCM的功能聚类-GSEA分析 为了进一步探索DCM相关的信号通路,我们分别对GSE17800和GSE19303进行了GSEA富集分析,根据FDR<0.05 和adj.P<0.05筛选出与DCM相关的通路,从数据集GSE17800得到了相关信号通路42条,从数据集GSE19303得到了相关信号通路12条,仅选择P值最小的5条通路并据此绘制了山峦图。见图3。从图3中可以看出,GSE17800数据集表明DCM主要与上皮间充质转化、早期雌激素反应、肌发生、紫外线反应、血管生成等有关。GSE19303数据集表明DCM主要与上皮间充质转化、凝血、干扰素α应答、氧化磷酸化、肌发生等有关。由此我们可以看出上皮间充质转化、肌发生等可能与DCM有着密切的关联。
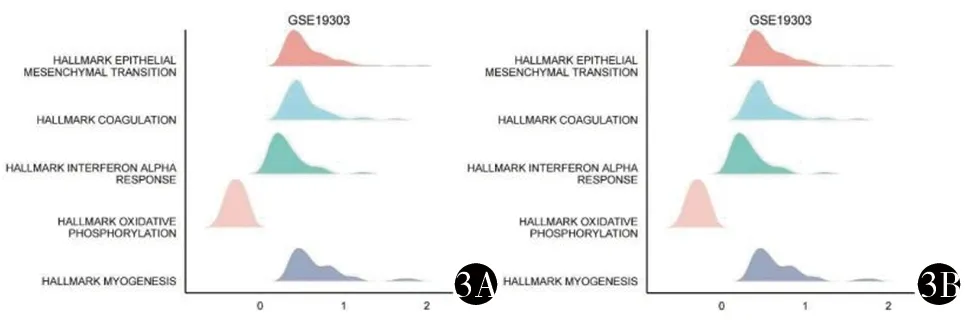
3A GSE17800山峦图 3B GSE19303山峦图
2.3 共同DEGs的GO与KEGG富集分析 对筛选得到的60个共同DEGs进行GO富集分析,得到生物学过程(BP)共有39条,细胞组分(CC)共有5条,分子功能(MF)共有2条,结果显示:差异蛋白在生物学过程方面主要与药物反应、神经递质运输正反馈调节过程、药物转运、cGMP-PKG信号通路有关;细胞组成主要分布于胞外囊泡、突触囊泡、胞外囊泡膜和突触囊泡膜;分子功能主要与精氨酸N甲基化转移酶的活性相关。见图4。对上述差异基因进行KEGG富集分析,共得到4条通路,分析结果显示:DCM与血管平滑肌收缩、产热、朊病毒、 cGMP-PKG信号通路有关。见图5。

图4 GO富集分析 图5 KEGG富集分析
2.4 共同DEGs的蛋白互作网络构建及模块分析 对得到的共同DEGs利用在线网站STRING进行蛋白互作网络构建,并将得到的结果输入Cytoscape 软件进行可视化分析与筛选,得到图6A,并运用MCODE插件进行聚类分析,得到2个得分较高的富集序列,并得到22个重要节点。见图6B、6C。
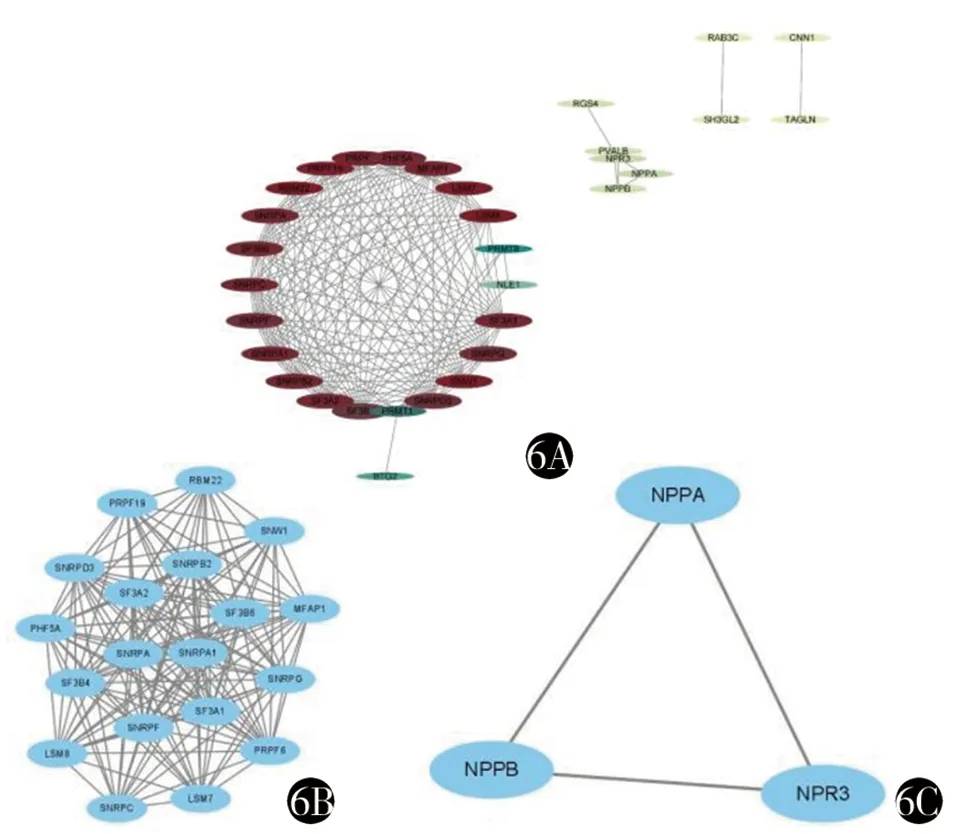
图6 蛋白互作网络图
2.5 差异基因-药物相互作用分析 将上述得到的22个差异基因输入DGIdb数据库,获得了治疗DCM的3种潜在药物氯噻酮、氨氯地平和奈西利肽。将得到的差异基因与GeenCards在线数据库中DCM相关基因取交集得到2个相关基因,即NPPA和NPPB。
3 讨论
既往研究[4]认为DCM的发生和发展与一系列复杂的调节因子和信号通路有关,这些因素包括高血糖、胰岛素抵抗、线粒体功能障碍、内皮功能障碍、过度氧化应激/活性氧(ROS)积累、内质网应激、晚期糖基化终产物(AGEs)升高、炎症、细胞外基质(ECM)沉积、纤维化、细胞内钙处理受损、肾血管紧张素-醛固酮系统(RAAS)激活、心脏自主神经病变、微血管功能障碍以及心脏代谢异常。然而DCM发病机制复杂,对其发病分子机制和特异性信号通路尚缺乏系统深入研究。基于生物信息学角度来研究疾病的分子机制具有重要意义,有助于设计药物的新分子靶点或者为疾病的早期诊断提供特异标志物。
本研究选取了来源于GEO数据库的2块芯片,GSE17800和GSE19303,以接受IA/IgG治疗前的DCM患者心肌样本为实验组,正常心脏的心肌样本为对照组,筛选出上调的相关差异基因60个,对筛选得到的相关差异基因进行了GO及KEGG富集分析,结果表示DCM的发生发展主要与胞内钙处理受损与血管舒张的调控有关。为了进一步探究DCM发生发展的信号通路,因此我们进行了GESA富集分析,得到的结果表明DCM的发生发展极有可能与上皮间充质转化、肌发生相关。为了进一步探究DCM的可能的治疗方案,将所得到的差异基因进行了蛋白互作网络的构建,并导入了Cytoscape软件进行了相关分析,得到了关键基因22个。
GO分析表明,DCM的发生发展与细胞外囊泡有关。据报道[5],Exoc1是胞外囊泡定位所必需的蛋白质,在男性扩张型心肌中显著升高,这与我们得到的生信分析结果较为一致,对这一过程的研究可能有助于深入了解DCM的发病机制。KEGG富集分析结果表明,DCM的发生发展与血管平滑肌的收缩密切,与朊病毒密切相关。实验[6]表明,DCM患者心肌收缩能力低,容易发生血栓栓塞症。组织病理学改变大多是非特异性的,包括心肌细胞肥大和变性,并伴有不同程度的纤维化。其病原学和致病机制涉及基因突变、病毒性心肌炎和自身免疫性疾病。据此,关于改善DCM患者的心肌收缩功能及抑制心室重构的研究可能有助于提高DCM的治疗。其次,结果表明cGMP-PKG信号通路在DCM的发生发展中也有重要的作用。研究[7]表明,内皮细胞在内皮型一氧化氮合酶(ENOS)的催化作用下合成一氧化氮,然后激活其胞内受体--可溶性鸟苷环化酶(SGC),导致第二信使环鸟苷一磷酸(cGMP)的释放。cGMP进一步激活cGMP依赖的蛋白激酶(PKG),调节许多生理功能。SGC-cGMP-PKG信号被发现作为一种常见的心脏保护递质发挥作用,这一途径参与了糖尿病条件下收缩和舒张期功能障碍的调节[8]。越来越多的证据[8-10]也支持sGC-cGMP-PKG通路在糖尿病心肌病心脏纤维化重构、肥厚、氧化应激和细胞凋亡中发挥关键作用。关于这一通路是否在DCM的发生发展中有着同样至关重要的作用有待进一步证实。
在GESA富集分析中,上皮间充质转化、肌发生与DCM的发生发展有着密切关联。我们已知特发性DCM是一种病因不明的原发心肌疾病,以心肌细胞丢失和成纤维细胞增多为特征,是心力衰竭的重要原因。间充质干细胞(MSCs)是多能的成体干细胞,存在于骨髓微环境中,在体内,MSCs直接注射到梗死心脏被证明可以诱导心肌再生和改善心功能,植入通过产生血管内皮生长因子(VEGF)诱导大鼠后肢缺血模型的治疗性血管生成[6]。因此MSCs移植可能有助于DCM的治疗。
将得到的差异基因与GeenCards在线数据库中DCM相关基因取交集得到2个相关基因,即NPPA和NPPB。根据文献[11]报道,合并心力衰竭的DCM患者会产生低水平的心脏选择性丝氨酸蛋白酶(corin),而钠尿肽前体的裂解和活性形式的生成中有丝氨酸蛋白酶的参与,因此 corin 和钠尿肽家族的成员作为临床上心力竭的常用的心脏损伤标志物,可以用来提示DCM失代偿期的发生及心力衰竭症状的严重程度[11],与我们得到的生物信息预测结果相一致。全基因组关联研究证实NPPA是血压发育的一个致病因素,心钠肽(ANP)是由NPPA编码的一种血管扩张激素,可促进盐的排泄,而在人类中,ANP水平被认为是盐敏感性的指标[12]。因此,严格限制钠盐的摄入量及控制高血压有可能成为预防DCM发生发展的一个重要方法。同时研究[13]发现,注射用重组人脑利钠肽治疗DCM合并心力衰竭患者可有效降低患者的血清脑利尿钠肽(BNP)、BNP前体(NT-proBNP)、 血管紧张素II(AngⅡ)等指标,改善心室重构。
我们将得到的DEGs输入DGIdb数据库,获得了治疗DCM的3种潜在药物,氯噻酮、氨氯地平和奈西利肽作为治疗DCM的可能药物,据报道[14],氨氯地平可预防心室受快速刺激时的扩大及舒张期出现限制型充盈的发生。DCM患者采用倍他乐克联合地高辛治疗效果显著,可有效改善患者左心室功能,因此塞氯酮及奈西利肽对左心功能的改善可能有利于DCM的治疗[15]。由于上述结果仅立足于我们生信分析得到的结果,具体疗效应当在临床药物试验中得到进一步验证。
综上所述,基于生物信息学方法我们得到了与DCM可能相关的基因,并将上述候选基因输入在线药物验证数据库,得到了可能的治疗药物氯噻酮、氨氯地平和奈西利肽,为临床预后的判断及治疗提供有意义的研究线索及方向。有关DCM的治疗是一个个性化的治疗方案,应进一步进行临床试验进行深入探究。

