基于环磷酸鸟苷-腺苷合成酶/膜蛋白干扰素基因刺激因子通路探讨奥拉西坦对脑出血大鼠神经功能的影响
张涛,谢红兵,高安举,杨清成
脑出血指脑血管破裂,引起血肿在脑组织中形成,而导致的脑组织非创伤性损伤[1]。脑出血具有较高的发病率及死亡率[2]。消除脑出血后血肿造成的周围神经损伤,是目前研究的热点之一[3]。奥拉西坦(ORC)为4羟基2酮1吡咯烷乙酰胺类药物,有研究[4]证实,其具有改善脑血管微循环障碍、促进神经细胞可塑性修复、改善高血压脑出血患者大脑认知功能和生活自理能力等作用。近来临床报道[5]发现ORC也可缓解脑出血患者组织血肿、改善脑出血认识功能损伤。但其发挥脑保护的具体分子生物学途径还不清楚。大量文献[6-7]报道,组织中DNA损伤后,可促进环磷酸鸟苷-腺苷合成酶(cGAS)激活,并通过活化干扰素基因刺激因子(STING)表达,来调控炎性因子表达及趋化,从而介导免疫、炎性及凋亡反应。另外,已有研究[8]证实,cGAS/STING通路可参与缺血性脑损伤神经元炎性、氧化应激、凋亡等生物学过程,来影响脑损伤后神经功能的恢复进程。预示cGAS/STING也可能参与脑出血后血肿周围组织神经元损伤过程。本研究建立大鼠脑出血模型,从cGAS/STING通路方面探究并验证ORC发挥脑出血后血肿周围组织神经元恢复的可能机制,以期为脑出血后神经功能恢复的治疗提供可靠的实验资料。
1 材料与方法
1.1 材料
1.1.1 动物及细胞来源 SPF级SD大鼠90只,健康雄性,7~8周龄,200~220 g,购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2020-0004。本实验由本院动物使用伦理委员会(IACUC)批准(批号IACUC-105092),符合3R原则。
1.1.2 主要试剂与仪器 ORC(货号:H78980,上海吉至生化科技有限公司);cGAS抑制剂(RU.521)(货号:HY-114180,购自MCE公司)、2.5-己酮可可碱(Vadimezan,DMXAA,STING激活剂)(货号:HY-10964,购自MCE公司);原位缺口末端标记法(TUNEL)染色、特恩布尔(TURNBULL)铁染色试剂盒(货号:ty-16893,yzy-gm4049,购自天津舍为斯生物技术有限公司、焦作云之羽生物科技有限公司);兔抗大鼠cGAS多克隆抗体(货号:QG12097,上海圻明生物科技有限公司);STING(货号:227704)、TNF-α(ab109322)、IL-12(ab106270)、半胱氨酸天冬氨酸蛋白水解酶3(caspase3)(货号:ab184787)、B淋巴细胞瘤-2基因(Bcl-2)(货号:ab194583)、转铁蛋白(Tf)(货号:ab181137)、转铁蛋白受体(Tf R)(货号:ab80194)、水通道蛋白4(APQ4)(货号:ab259821)等兔抗大鼠多克隆抗体均购自美国abcam公司。TEM透射电镜购自南京博恩生物技术有限公司。
1.2 方法
1.2.1 模型建立及分组给药 参照文献[9]麻醉大鼠,在脑立体定向仪下,于尾状核部位用二次注血退针法,注入自体血80 μl,建立脑出血模型,术后6 h,大鼠成活,Berderson神经功能缺损评分>1,视为造模成功。共造模成功75只,随机分为模型组、ORC组(50 mg/kg)、RU.521组(cGAS抑制剂,50 mg/kg)、DMXAA组(STING激活剂,25 mg/kg)、ORC+DMXAA组,每组15只。另取15只大鼠,只于尾状核部位刺针,不注入血液,作为假手术组。各组均于术后6 h开始给药,ORC参照文献[10]设置剂量并经腹腔注射给药;RU.521组及DMXAA组参照文献[11-12]设置剂量,并经尾静脉注射给药;模型组及假手术组经腹腔注射给予等量生理盐水,各组均连续给药3 d,1次/d。给药期间观察大鼠死亡及活动状况。
1.2.2 大鼠神经功能缺损评分 参照文献[13]用Berderson神经功能缺损评分法对大鼠神经功能缺损症状进行评分。具体评分标准:提尾悬空1 m,观察3~5 min。0分:双前肢不完全伸展;1分:一侧肢体长时间弯曲;2分:大鼠放于垫子上,抓住尾巴向不同方向拖拽滑动,瘫痪侧抵抗力下降;3分:在2分基础上伴自主转圈行为。
1.2.3 大鼠脑含水量的检测 随机取6只大鼠,麻醉、断头处死,冰上开颅取脑,去除嗅球、小脑及延髓,吸净组织表面血液。称取湿重后,于60 ℃烘箱内烘干至恒重后称取干重。根据公式:含水量=(湿重-干重)×100%,计算脑含水量。
1.2.4 大鼠血肿周围组织电镜检测 取剩余大鼠,麻醉后断头取脑,取距血肿中心区外缘1 mm处,剪取0.5 cm×0.5 cm×0.1 cm组织块并分成三部分,一部分置于-80 ℃冰箱保存,一部分迅速置于4%多聚甲醛中固定24 h,另一部分送电镜室处理后镜检。
1.2.5 大鼠血肿周围组织TUNEL染色、TURNBULL铁染色检测 取1.2.3项下,4%多聚甲醛中固定24 h的组织,透明、浸蜡、包埋后,切成5 μm切片,取部分切片,脱蜡、水化后,按TUNEL染色、TURNBULL铁染色说明书的方法染色、封片后,在光镜下观察组织神经元凋亡及组织铁沉积的状况。TUNEL染色切片用Image-pro plus软件系统检测阳性染色为棕黄色的凋亡细胞数目,细胞凋亡率=凋亡细胞数/细胞总数×100%。铁染色切片,取5个不重叠区高倍(×400)视野,用IMAGE 6.0图像分析系统分析铁沉积的平均光密度值。
1.2.6 免疫组织化学法测血肿周围组织cGAS阳性表达 取1.2.4中剩余石蜡切片,脱蜡、水化及抗原修复后,加入一抗(cGAS,1∶200)4 ℃孵育过夜,加入山羊抗兔二抗(1∶800)室温孵育1.5 h,苏木精复染、封片后,光镜下观察拍照,用Image Pro-Plus 6.0软件分析测量单位面积内阳性染色的平均光密度值。
1.2.7 Western blotting法检测血肿周围组织STING、TNF-α、IL-12、caspase3、Bcl-2、Tf、Tf R、APQ4的表达 取1.2.3项下-80 ℃冻存的血肿周围组织,4 ℃解冻后,冰上匀浆、裂解及轴提蛋白、二喹啉甲酸(BCA)法测蛋白浓度后,取100 μg蛋白样品,行电泳及转膜反应,加入一抗STING、TNF-α、IL-12、caspase3、Bcl-2抗体(1∶1 500),内参β-actin(1∶2 000),4 ℃湿盒孵育过夜,辣根过氧化物酶二抗(1∶2 000)室温孵育1.5 h,增强化学发光法显影,化学发光成像仪分析系统曝光拍照,以Image J系统检测蛋白相对表达水平。

2 结 果
2.1 ORC对脑出血大鼠一般行为状况、神经功能缺损的影响 假手术组大鼠无死亡,饮食及活动正常,神经功能缺损行为评分0分。与假手术组相比,模型组及ORC+DMXAA组大鼠均有2只死亡,饮食活动减少,且出现无自主意识、偏瘫及侧旋转等神经功能缺损行为,神经功能缺损行为评分[(2.16±0.23)分、(2.01±0.24)分]明显升高(均P<0.05);ORC组及RU.521组大鼠无死亡,饮食活动有所增加,神经功能缺损评分明显降低[(1.08±0.12)分、(1.06±0.13)分](均P<0.05);DMXAA组大鼠有4只死亡,饮食活动量进一步减少,神经功能缺损评分明显升高[(2.99±0.20)分](P<0.05)。
2.2 ORC对脑出血大鼠血肿周围组织cGAS/STING通路蛋白表达的影响 见图1、表1。免疫组化显示,cGAS在血肿周围组织神经元细胞胞浆中呈弱阳性表达。与假手术组相比,模型组大鼠血肿周围组织cGAS阳性表达、STING蛋白表达均明显升高(均P<0.05)。ORC组及RU.521组大鼠血肿周围组织cGAS阳性表达、STING蛋白表达均明显降低(均P<0.05);DMXAA组大鼠血肿周围组织cGAS阳性表达、STING蛋白表达均明显升高(均P<0.05)。与ORC组相比,ORC+DMXAA组大鼠血肿周围组织cGAS阳性表达、STING蛋白表达均明显升高(均P<0.05)。

图1 大鼠血肿周围组织cGAS图(免疫组化染色,×200)。cGASY 阳性表达呈黄棕色,假手术组黄色染色最浅,模型组黄棕色染色加深,DMXAA组染色最深,ORC与RU.521组染色变浅,ORC+DMXAA组染色较ORC组加深

表1 大鼠血肿周围组织cGAS阳性表达、STING蛋白表达的比较(x±s)组别只数cGAS(平均光密度/mm2)STING/β-actin假手术组90.21±0.031.03±0.09模型组71.56±0.13*1.97±0.19*ORC组91.03±0.10△1.50±0.15△RU.521组91.17±0.11△1.54±0.15△DMXAA组52.92±0.20△▲2.57±0.21△▲ORC+DMXAA组71.57±0.14▲1.98±0.19▲ 注:与假手术比较*P<0.05;与模型组比较△P<0.05;与ORC组比较▲P<0.05
2.3 ORC对脑出血大鼠血肿周围组织水肿的影响见表2、表3。与假手术组比,模型组大鼠脑含水量、血肿周围组织APQ4蛋白均明显升高(均P<0.05)。与模型组相比,ORC组及RU.521组大鼠脑含水量、血肿周围组织APQ4均明显降低(均P<0.05);DMXAA组大鼠脑含水量、血肿周围组织APQ4均明显升高(均P<0.05)。与ORC组相比,ORC+DMXAA组大鼠脑含水量、血肿周围组织APQ4表达均明显升高(均P<0.05)。
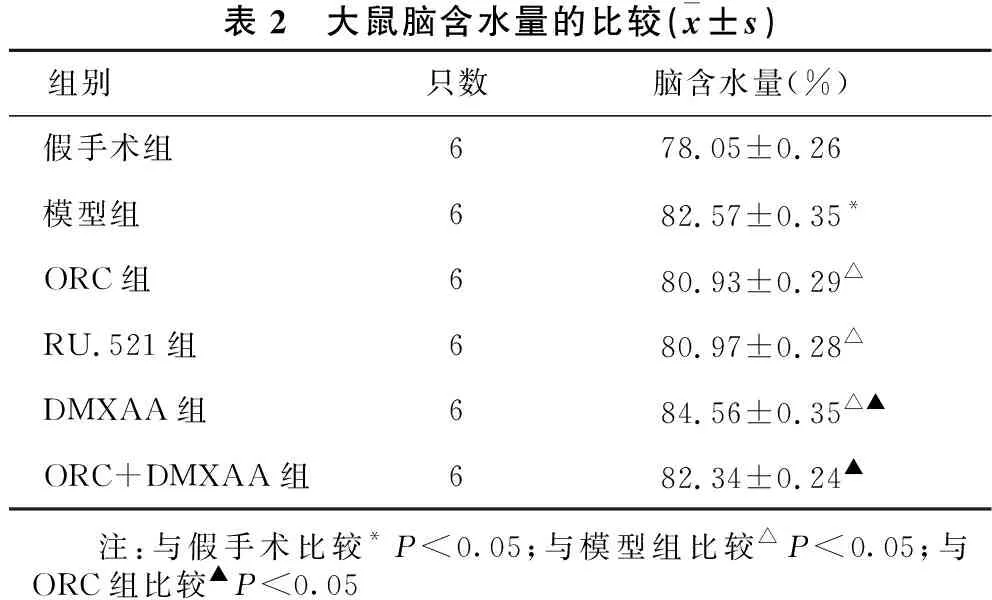
表2 大鼠脑含水量的比较(x±s)组别只数脑含水量(%)假手术组678.05±0.26模型组682.57±0.35*ORC组680.93±0.29△RU.521组680.97±0.28△DMXAA组684.56±0.35△▲ORC+DMXAA组682.34±0.24▲ 注:与假手术比较*P<0.05;与模型组比较△P<0.05;与ORC组比较▲P<0.05
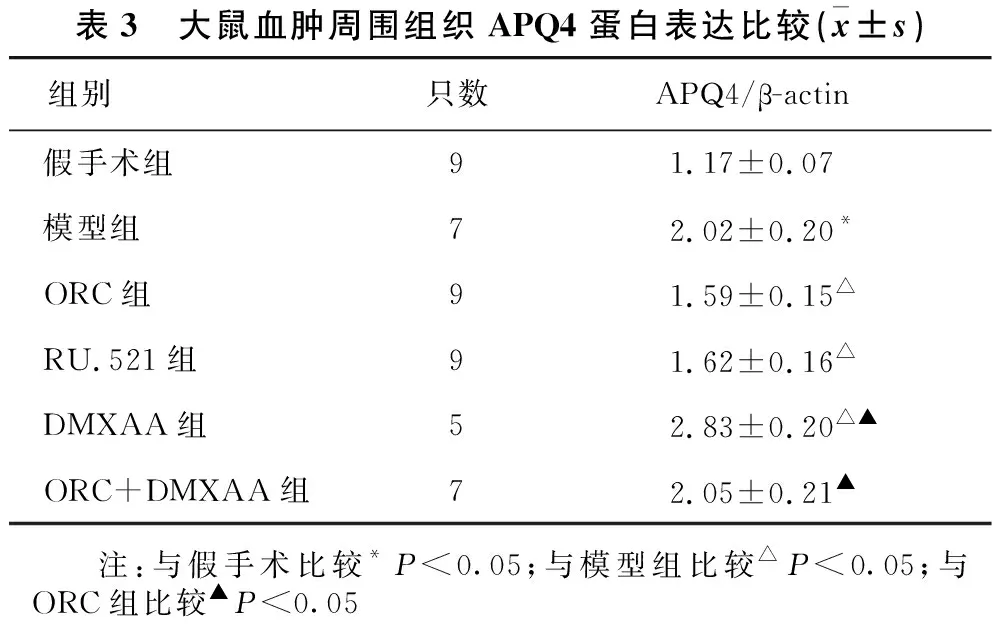
表3 大鼠血肿周围组织APQ4蛋白表达比较(x±s)组别只数APQ4/β-actin假手术组91.17±0.07模型组72.02±0.20*ORC组91.59±0.15△RU.521组91.62±0.16△DMXAA组52.83±0.20△▲ORC+DMXAA组72.05±0.21▲ 注:与假手术比较*P<0.05;与模型组比较△P<0.05;与ORC组比较▲P<0.05
2.4 ORC对脑出血大鼠血肿周围组织铁沉积的影响 见图2、表4。组织铁染色检测结果显示,假手术组大鼠血肿周围组织几乎未见铁沉积,模型组大鼠可见血肿周围组织棕褐色铁沉积加深。与假手术组相比,模型组大鼠血肿周围组织铁沉积平均光密度值、Tf、Tf R蛋白表达均明显升高(均P<0.05)。ORC组及RU.521组大鼠血肿周围组织铁沉积平均光密度值、铁调控相关蛋白-Tf、Tf R蛋白表达均明显降低(均P<0.05);DMXAA组大鼠血肿周围组织铁沉积平均光密度值、铁调控相关蛋白-Tf、Tf R蛋白表达均明显升高(均P<0.05)。与ORC组相比,ORC+DMXAA组大鼠血肿周围组织铁沉积平均光密度值、铁调控相关蛋白-Tf、Tf R蛋白表达均明显升高(均P<0.05)。

图2 大鼠血肿周围组织铁染色图(TURNBULL铁染色,×10)

表4 大鼠血肿周围组织铁沉积及Tf、Tf R蛋白表达比较(x±s)组别只数铁沉积(平均光密度/mm2)Tf/β-actinTf R/β-actin假手术组90.21±0.011.10±0.101.08±0.08模型组71.66±0.16*1.94±0.19*2.04±0.22*ORC组91.09±0.09△1.51±0.15△1.61±0.16△RU.521组91.10±0.10△1.54±0.14△1.64±0.15△DMXAA组51.96±0.18△▲2.58±0.21△▲2.78±0.21△▲ORC+DMXAA组71.67±0.17▲1.99±0.19▲2.07±0.22▲ 注:与假手术组比较*P<0.05;与模型组比较△P<0.05;与ORC组比较▲P<0.05
2.5 ORC对脑出血大鼠血肿周围组织结构损伤及凋亡的影响 见图3。电镜染色显示,模型组大鼠神经元水肿、核仁消失、细胞器减少、线粒体嵴及膜融合且模糊不清。TUNEL染色可见凋亡神经元染色加深。与假手术组[(3.05±0.16)%]相比,模型组[(29.57±1.05)%]神经元细胞凋亡率明显升高(P<0.05),大鼠血肿周围组织神经元水肿严重。ORC组[(16.93±0.59)%]及RU.521组[(16.97±0.48)%]凋亡率明显降低(P<0.05),大鼠血肿周围组织水肿缓解;DMXAA组[(35.56±0.95)%]凋亡率进一步明显升高(P<0.05),大鼠血肿周围组织水肿加重。与ORC组相比,ORC+DMXAA组[(28.94±0.99)%]凋亡率明显升高(P<0.05),大鼠血肿周围组织水肿加重。

图3 大鼠血肿周围组织电镜(×30 000)及TUNEL染色(×400)检测图
2.6 ORC对脑出血大鼠血肿周围组织STING通路相关蛋白TNF-α、IL-12、caspase3、Bcl-2表达的影响见图4、表5。与假手术组相比,模型组大鼠血肿周围组织TNF-α、IL-12、caspase3蛋白表达明显升高(均P<0.05),Bcl-2蛋白表达明显降低(P<0.05)。ORC组及RU.521组TNF-α、IL-12、caspase3蛋白表达明显降低(均P<0.05),Bcl-2蛋白表达明显升高(P<0.05);DMXAA组大鼠TNF-α、IL-12、caspase3蛋白表达明显升高(均P<0.05),Bcl-2蛋白表达明显降低(P<0.05)。与ORC组相比,ORC+DMXAA组大鼠TNF-α、IL-12、caspase3蛋白表达明显升高(均P<0.05),Bcl-2蛋白表达明显降低(P<0.05)。

图4 大鼠血肿周围组织TNF-α、IL-12、caspase3、Bcl-2蛋白表达免疫印迹图组

表5 大鼠血肿周围组织TNF-α、IL-12、caspase3、Bcl-2蛋白表达比较(x±s)组别只数TNF-α/β-actinIL-12/β-actincaspase3/β-actinBcl-2/β-actin假手术组91.08±0.091.07±0.071.01±0.071.04±0.08模型组71.83±0.18*1.94±0.19*1.77±0.19*0.44±0.04*ORC组91.49±0.12△1.58±0.21△1.41±0.11△0.71±0.07△RU.521组91.51±0.15△1.64±0.12△1.44±0.14△0.70±0.07△DMXAA组52.45±0.21△▲2.58±0.26△▲2.38±0.15△▲0.18±0.01△▲ORC+DMXAA组71.87±0.20▲1.99±0.19▲1.76±0.16▲0.49±0.04▲ 注:与假手术相比较*P<0.05;与模型组比较△P<0.05;与ORC组比较▲P<0.05
3 讨 论
脑出血为急性脑血管疾病中最严重的一种,也是导致中老年死亡的主要疾病之一。目前研究[14]发现,血肿周围水肿与脑出血患者生存及预后关系密切。大量文献[15]研究证实,脑出血患者超急性期,血浆蛋白可引起脑组织水肿的形成,另外血肿的破坏作用可引起周围组织血流量及代谢水平降低,导致血肿周围组织神经细胞缺失、变性及死亡,而加重脑损伤。Yogendrakumar等[16]通过动物实验发现,血肿周围水肿2 h后开始增多,在3~4 d时可达到高峰,7 d时仍然存在。郭纯等[9]发现,脑出血后3 d,血肿可导致红细胞破坏裂解,而释放大量血红素,血红素催化分解生成铁离子在脑组织中大量沉积,可加重脑组织损伤及神经细胞坏死,且脑出血后,铁离子沉积随着时间的延长而升高。本研究发现,模型组大鼠脑组织可见棕褐色铁沉积显著增加,水肿周围组织神经元水肿、变形及凋亡明显,大鼠脑含水量增加,且出现死亡、无自主意识、偏瘫及侧旋转等神经功能缺损行为,表示造模成功。
APQ4可介导水分子跨膜转运、调节脑组织水液代谢,其水平异常可反映脑水肿的形成与吸收状况[17];Tf可把铁结合到Tf R,来促使脑细胞摄取铁。Chen等[18]发现,脑出血后Tf R表达异常增加,可促进Tf进入到脑实质细胞中,从而促进铁转运进入脑组织中来损伤神经细胞。本研究也在模型组大鼠脑组织中检测到APQ4及Tf、Tf R蛋白表达升高,神经元凋亡率升高,进一步表明造模成功。ORC为促智类药,临床报道[19]发现其对改善高血压类脑出血患者神经功能损伤有较好的疗效。本研究发现,给予ORC干预治疗后,大鼠死亡及偏瘫、侧旋转等神经功能缺损行为减少,脑水肿、脑血肿周围组织神经元变性、死亡及凋亡明显缓解,APQ4及Tf、Tf R蛋白表达明显降低,铁染色分布也明显减少,提示ORC对脑出血后血肿周围组织神经元损伤有缓解作用,其可能为治疗脑出血后神经功能缺损的潜在药物,但其具体机制还需进一步探究。
近来研究[14]发现,脑出血后血液中的血浆蛋白、血红素、凝血酶等成分均可引起血肿周围组织发生炎性及氧化应激反应,而造成神经细胞毒性损伤。Rasmussen等[15]发现凝血酶能释放TNF-α、IL-12及IL-6等炎性因子来促进炎症反应,引起脑出血后血肿周围水肿形成,加重脑损伤。本研究也在模型大鼠血肿周围组织中检测到TNF-α、IL-12蛋白表达的升高,提示炎症反应也可能是引起脑出血后血肿周围组织损伤的重要机制。cGAS/STING是介导炎症反应、氧化应激反应,并参与神经元细胞凋亡的重要通路[20]。研究[7]证实,组织损伤、炎症应激反应、病毒感染等均可刺激胞质中的cGAS与dsDNA结合而活化,活化的cGAS可促进胞质中的STING与胞质中的DNA结合形成二聚体并转移至核周区域发生活化,从而调控TNF-α、IL-12等炎症因子的表达,参与免疫炎性反应、炎症与非炎症性疾病过程。另外cGAS/STING也与细胞凋亡关系密切。Wu等[21]发现,凋亡相关蛋白Bcl2样蛋白4可诱导线粒体DNA渗漏到细胞质中,激活cGAS/STING通路,引起器官组织炎症反应及衰竭、死亡。Kwon等[22]发现,抑制cGAS/STING介导的炎症反应,可清除谷氨酸毒性并防止神经胶质细胞的凋亡和线粒体损伤,并有望成为帕金森病和Alzheimer’s病的关键治疗机制。本研究发现,cGAS在模型大鼠血肿周围组织神经元细胞胞浆中呈强阳性表达,用RU.521阻断cGAS在胞浆中表达后,STING及炎症因子TNF-α、IL-12表达降低,血肿周围组织沉积、水肿、神经元损伤及凋亡均明显缓解,大鼠神经功能缺损症状也明显得到改善,反之,用DMXAA进一步激活STING表达后,cGAS及TNF-α、IL-12表达升高,大鼠死亡、铁沉积及神经功能损伤进一步加重。提示cGAS/STING通路活化可能参与脑出血大鼠血肿周围神经元炎症反应及凋亡过程。ORC组大鼠血肿周围组织中cGAS/STING通路、炎症反应、凋亡、铁沉积等均处于抑制状态,神经功能缺损也明显改善,提示ORC可能通过抑制cGAS/STING通路活化,缓解脑出血大鼠血肿周围神经元炎症损伤,继而缓解神经功能缺损。而STING激活剂DMXAA可逆转ORC上述作用。
综上所述,ORC可能通过抑制cGAS/STING通路活化,缓解脑出血大鼠血肿周围神经元炎症损伤及凋亡,减轻神经功能缺损。但cGAS/STING通路下游调控机制复杂,涉及多个靶蛋白多条途径共同调节,脑出血后血肿周围组织损伤机制也相当复杂,还涉及血-脑屏障的破坏。ORC发挥脑出血后神经功能改善的其他机制,还有待后续继续深入研究。

