1例老年骨髓增生异常综合征合并意义未明的单克隆免疫球蛋白血症并文献复习
邢明泉,葛洪峰,吴维霞,孙晓星,马兰
1亳州市人民医院血液内科,安徽亳州 236800;2亳州市人民医院影像中心,安徽亳州 236800;3亳州市人民医院感染内科,安徽亳州 236800
骨髓增生异常综合征(MDS)是一组源于造血干细胞且具有很强异质性的恶性克隆性疾病,其中位发病年龄约70岁[1]。骨髓病态造血及无效造血致外周血一系或多系细胞减少为其主要特征,主要表现为贫血、发热、出血等,并有转化为急性白血病的风险。意义未明的单克隆免疫球蛋白血症(MGUS)是浆细胞疾病的一种,属于来源于成熟B细胞的恶性疾病,是多发性骨髓瘤(MM)的发病前期阶段。MGUS临床常无明显症状,易被忽略,每年1%~3%的MGUS可通过浆细胞克隆性增殖演变为MM或者转化为其他骨髓造血系统恶性肿瘤[2]。MGUS通过单克隆蛋白沉积在组织与器官,造成多浆膜腔积液、肾脏损伤、血细胞损伤等临床表现。MDS及MGUS同属多发于老年人群的恶性血液系统疾病[3],MDS合并MGUS的发生概率较低,国内外文献以个案报道居多,国外一项研究统计了长达14年诊治的MDS患者,其中合并MGUS的患者较少[4]。两种疾病分别来源于髓系及B细胞的异常克隆性表达,其共同的发病机制可能为存在血液系统恶性肿瘤的固有易感性基因及致病条件,共同的骨髓微环境改变,骨髓生态位中的信号在骨骼和血液谱系的分化中促进两种异常克隆的形成[5]。现报告亳州市人民医院收治的1例MDS合并MGUS老年患者,以期提高对该病的认识,为广大临床医生做参考。
1 病例资料
1.1 基本资料 患者女,71岁,主因“头晕乏力伴胸闷气短1年余”于2021年9月入住亳州市人民医院血液内科。患者5年前行卵巢良性肿瘤手术,既往存在盆腔积液、胸腔积液。手术住院期间多次检查血常规,结果显示白细胞及血红蛋白减少、球蛋白增高、白球比例倒置;血清固定电泳+蛋白电泳显示单克隆免疫球蛋白(M蛋白)阴性,免疫球蛋白未见明显异常,乳酸脱氢酶及铁蛋白明显增高;骨髓检查可见少量单克隆增生的浆细胞,占有核细胞的1.72%,意义不明,骨髓活检见约占有核细胞5%的克隆性增生性浆细胞,染色体为正常核型;骨髓涂片未见原始细胞,考虑浆细胞疾病可能,但MGUS诊断证据不足。随着疾病进展,患者多次复查白细胞及血红蛋白,均进行性下降且白球比例倒置,头晕乏力伴胸闷症状明显,血红蛋白下降较前明显,输血效果变差。患者既往无高血压、糖尿病等慢性疾病。
1.2 实验室检查及诊断 入院时血常规检查结果显示:白细胞1.13×109/L,血红蛋白43 g/L,血小板80×109/L,白 球 比 例 为 1.02。 血 β2微 球 蛋 白3.37 mg/L,血钙正常。骨髓细胞学:原始细胞占有核细胞的5%,浆细胞占有核细胞的2%,骨髓增生活跃,粒系、红系、巨核系可见病态造血。骨髓流式细胞学:髓系区域细胞约占有核细胞的58.5%,据免疫表型分析,其中可见约1%的细胞表达CD38、CD56、CD19、CD27、CD138、clambda等,考虑异常的浆细胞;其余约57.5%为髓系细胞,未见明显发育异常。原始区域细胞约占有核细胞的4.5%,分布稍集中,主 要 表 达 HLA-DR、CD11b、CD13、CD15、CD33、CD34、CD117、CD123(图1)。骨髓病理诊断:造血组织容量为60 VOL(造血组织60%,脂肪组织40%),呈骨髓增生较活跃,造血组织粒系、红系增生,粒系、红系比例大致正常。粒系前体细胞可见,中晚阶段细胞散在或成堆可见。红系原、早阶段细胞偶见,以中晚阶段细胞为主,散在或小堆可见。巨核细胞2~6个/HPF,部分为多叶核,可见单圆核及多圆核,淋巴细胞可见,浆细胞可见,可见小堆,吞噬含铁血黄素颗粒细胞可见,纤维组织灶性增生(图2)。血清免疫固定电泳结果:ELP上有一条M蛋白带,与抗L形成的特异性反应沉淀带略显异常(图3)。尿本周氏蛋白电泳结果:ELP上有一条M蛋白带,与抗L和抗Lf形成特异性反应沉淀带(图4)。染色体为正常核型,白血病43种融合基因及MDS相关突变基因未见异常。综上,根据既往史、现病史及实验室检查结果,依据2019年《骨髓增生异常综合征诊断与治疗专家共识》[6]及《中国多发性骨髓瘤诊治指南(2017年修订)》[7],该患者诊断为:①MDS伴原始细胞增多(IPSS评分为中危-1;IPSS-R评分为高危;WPSS评分为高危);②MGUS。

图1 免疫分型
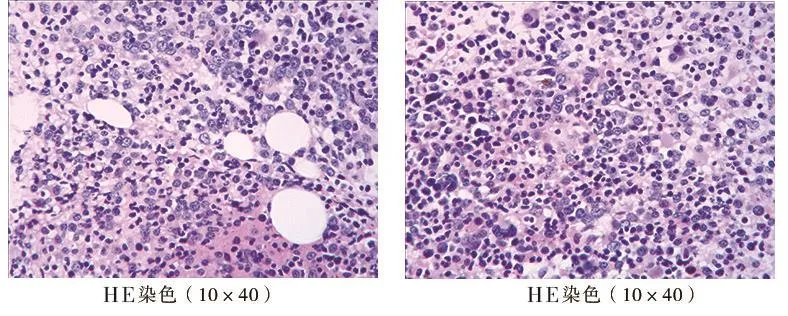
图2 骨髓病理检查

图3 血清免疫固定电泳结果
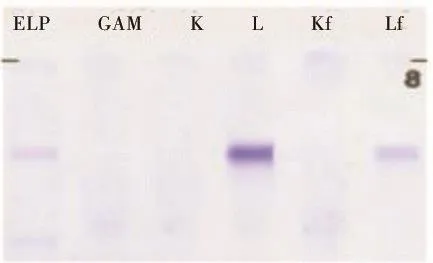
图4 尿本周氏蛋白电泳结果
1.3 治疗与预后 患者住院期间合并重症感染、败血症,予盐酸依替米星联合哌拉西林他唑巴坦抗感染治疗,沙利度胺100 mg,每日一次,长期服用;雄激素类十一酸睾酮促造血,起始剂量120 mg,每日一次,3周后改为80 mg,每日一次,长期服用。加强支持治疗,治疗过程中出现血红蛋白及血小板重度减少及其他不适时,给予成分输血及对症支持治疗。后患者感染得到控制,炎症指标较前明显下降,在无输血情况下连续1周血常规监测血红蛋白均高于60 g/L。患者为MDS高危患者,原始细胞较高,建议规律应用去甲基化联合阿糖胞苷的联合化疗方案,对于MGUS加强随访及评估,如发现M蛋白沉积相关症状及时临床干预。
患者拒绝化疗后出院,于2021年12月份再次对患者随访,患者病情稳定,院外多次复查血常规,白细胞均高于3×109/L,血红蛋白高于60 g/L,血小板在正常范围以内,再次建议患者定期联合化疗,定期复查骨髓象,家属仍拒绝。
2 讨论
患者自2017年9月至我院就诊,主因盆腔大量积液及胸腔积液、卵巢占位,后行手术切除治疗后证实为卵巢良性囊性病变。因查血常规白细胞及血红蛋白明显减少,白球比例倒置,于我科进一步完善骨髓穿刺检查,可见少量单克隆增生的浆细胞,占有核细胞的1.72%,意义不明,骨髓活检见约占有核细胞5%的克隆性增生性浆细胞,考虑浆细胞疾病可能。患者后多次于我科行输血及促造血等对症治疗,多次复查白球比例倒置,尿β微球蛋白阳性。患者2021年以来血细胞下降明显,感头晕、乏力伴胸闷症状加重,输血次数增多,故于我科再次完善骨髓相关检查,最终诊断为MDS合并MGUS,予调节免疫、促造血等治疗,患者血象及临床症状较前有改善,建议患者定期化疗,患者拒绝。
从患者近5年就医历程来看,患者首先出现异常浆细胞后异常浆细胞克隆演变为MGUS,后合并MDS。有研究表明,与普通人群相比,MGUS会增加MDS的发生风险,风险增加大约1.8倍,且这类患者预后往往较差[8]。该患者为MGUS在前MDS在后。对于高危MDS患者,应用去甲基化治疗会较传统治疗有更高的疾病缓解率和更高的生存期。尤其对于不适合行造血干细胞移植的老年患者更有应用价值[9]。该患者依从性较差,目前主要应用传统MDS治疗方案,虽短期内取得一定效果,但如不规律行联合化疗,则疾病进展可能性大,预后差。
MDS和MGUS均来源于骨髓造血细胞的恶性克隆性疾病,均进展缓慢,前者属于髓系造血干细胞来源的恶性增殖性疾病,后者属于成熟B细胞来源的恶性肿瘤,两种疾病均发生在同一患者身上较少见,国内外以个案报道居多,如栗瑞敏等[10]报道1例MDS合并 MGUS疾病;刘红娟等[11]也报道了 1例MDS合并MGUS疾病;智峰等[12]报道了1例MDS合并MM。目前研究没有发现此两种恶性疾病起源于同一种突变,但是近年来国内外研究认为相似的早期干细胞遗传性缺陷可能是其发病的主要原因[13]。有研究表明,MDS本质原因可追溯到免疫系统的异常,而长期异常的免疫系统抗原刺激也可能使浆细胞出现发育不良,致单克隆浆细胞的发生发展,而单克隆浆细胞反过来会分泌参与骨髓细胞分化发育的细胞因子如炎性因子白介素-6(IL-6)等,这些因子表达一方面会促进骨髓异常增生的发生发展,另一方面可以拮抗药物对骨髓瘤细胞的诱导凋亡[14],进而促进MDS的发生与转化,促使MGUS转化为MM。另外单克隆浆细胞也可分泌细胞因子,参与髓系细胞发育。如IL-6,其高表达会促进单核巨核系统的恶性增殖,进而导致MDS的发生。IL-6高表达还会对造血干细胞的生长发育产生影响,促进MDS的发生。其次,共同的致病因素下骨髓微环境的改变,骨髓生态位中的信号异常导致两种疾病相似的细胞遗传学和分子生物学改变如TP53基因突变,致两种疾病的发生[15]。
综上,MDS和MGUS临床较少同时发生,但两种疾病具有相互促进的内在机制及共同的致病因素,当MDS患者出现球蛋白异常等情况,要警惕MGUS的发生,尤其是老年男性患者。有研究表明,年龄的增长及男性是MGUS发病的高危险因素,即年龄越大其发病率越高[16]。同样,MGUS患者发生MDS概率也在增加,疾病过程中也要警惕MDS的发生。
最后,值得注意的是,大多数初诊MGUS均为老年人,在50岁以上老年人群中其发病率超过3%[17],常常有肾脏及骨骼病变或者胸腹腔积液,1%~1.5%的患者可以发展为MM[18],少数进展为其他类型的恶性血液病,如MDS、急性白血病、淋巴浆细胞淋巴瘤等。国内外研究表明,MGUS随年龄增长其发病率逐渐增加,在80岁以上的老年人中其发病率高达10%,这部分老年患者有部分患者会转化为MDS、MM、急性白血病等,预后往往较差[19]。这对于老年医学科是一个很大的挑战,尤其是对80岁以上老年男性MGUS患者更要提高警惕,以便早发现早治疗,改善老年患者的临床症状,延长老年患者的生存时间。

