可变剪接与成骨分化的研究进展
赵欣 龙臻黎 蔡林 谢远龙*
1.武汉大学中南医院,湖北 武汉 430072
2.武汉大学第一临床学院,湖北 武汉 430072
间充质干细胞(mesenchymal stem cells,MSCs)是不同诱导条件下具有多向分化潜能的多潜能干细胞,是体内外骨细胞、软骨细胞和脂肪细胞的重要来源。MSCs成骨分化是一个多步骤有序发生的过程,包括成骨细胞细胞系定向分化、前成骨细胞增殖、基质成熟、基质矿化。成骨分化需要多种转录因子协调参与,MSCs通过不同细胞因子、生长因子和激素的组合或外源性信号通路的平衡激活或抑制转录因子,转录因子在决定骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)的命运中起着关键作用[1]。
可变剪接(alternative splicing,AS)最早在1978年由Walter Gibert首先描述[2],是多细胞生物中广泛发生的一种调控机制[3]。mRNA前体(pre-mRNAs)通过AS产生不同的剪接异构体,最终形成不同功能和结构特征的蛋白质终产物。全基因组核糖核酸序列分析表明AS在MSCs中特异的表达模式有助于调控基因的表达格局,转换转录因子的活化状态。成骨分化过程中包括RUNX2、Sp7、Vegf-A和FosB等120余种主转录因子的pre-mRNAs发生AS[4]。AS控制主转录因子的pre-mRNAs产生多种蛋白质同种型在MSCs分化过程中发挥重叠、不同甚至相反的作用,精确控制分化过程有序发生,决定MSCs细胞命运和细胞终末分化成熟的方向[5-6],见表1。
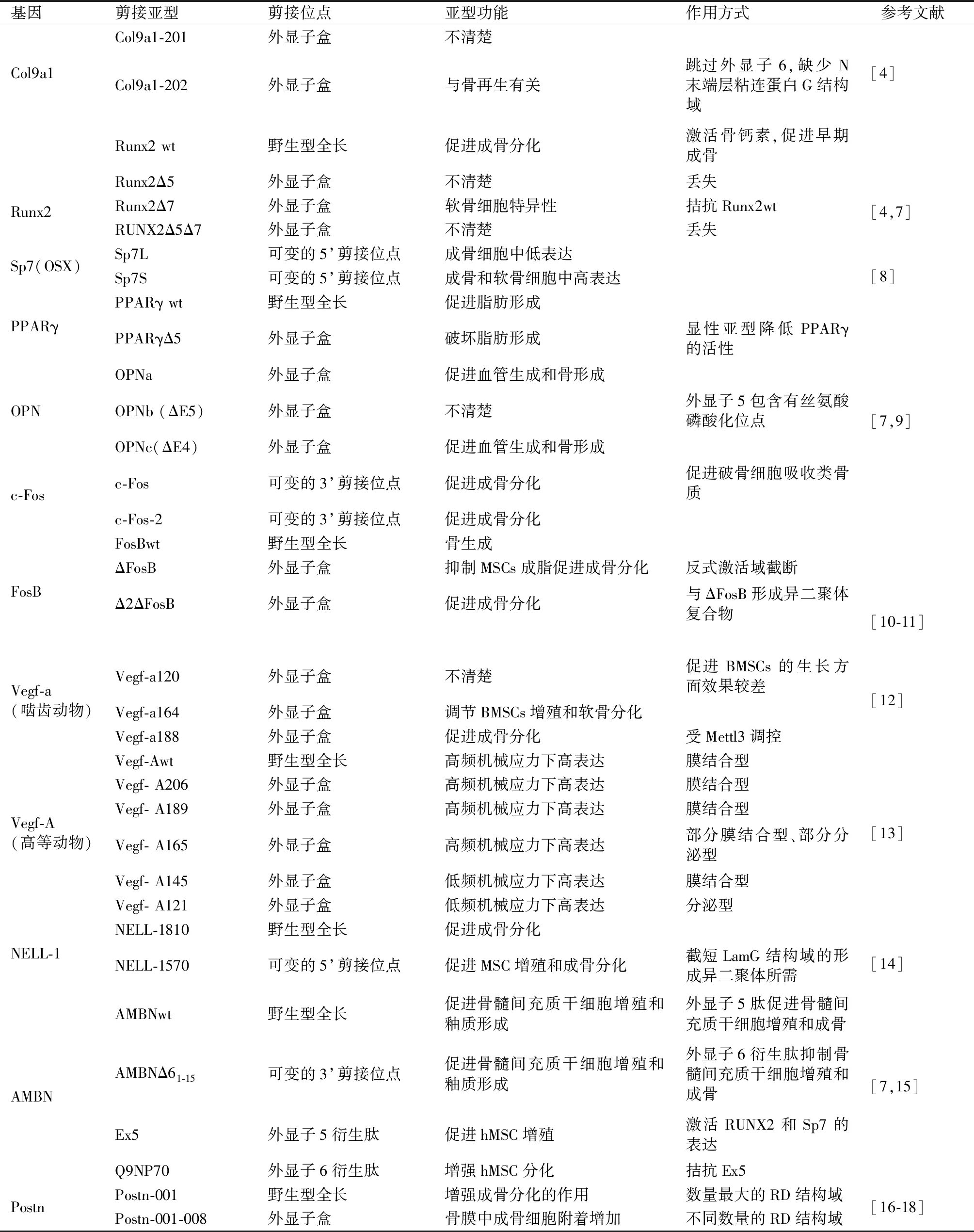
表1 成骨分化中发生AS的基因Table 1 Genes containing AS in osteogenic differentiation
1 AS的生物学过程
AS在动物的生长发育和生理代谢等过程中发挥着重要的调控作用。通过AS,特定外显子被包括或排除在成熟的mRNAs之外,同一基因产生不同的同种型来增加蛋白质组的多样性。它还通过改变mRNA的稳定性、翻译效率、microRNA的结合位点或信号定位来影响转录本。通常认为,AS有5种基本形式:(1)内含子保留;(2)可变的5’剪接位点;(3)可变的3’剪接位点;(4)外显子盒;(5)互斥外显子(只选择一组外显子中的一个)[19]。AS的剪接过程由多细胞动物中最大的分子复合物剪接体催化,同时受顺式作用元件和反式作用因子的调控。剪接体去除细胞内pre-mRNA的内含子而产生成熟的RNA[20]。RNA结合蛋白(RBP)以组织和发育特异性的方式表达从而决定mRNA内是否包含给定的外显子,以此决定同种型的比例,并通过发挥促进或抑制剪接体与反式作用因子的作用结合,辅助剪接体识别多种顺式作用元件实现AS。
2 AS与MSCs定向成骨分化
2.1 Runx2的可变剪接
Runx2是Runt转录因子家族的3个成员之一,转录因子Runx2的激活是建立早期成骨谱系的先决条件,并在骨细胞成熟的后期关闭。在BMSCs中Runx2通过对靶基因的调控实现早期激活成骨谱系抑制成脂谱系,在骨形成中发挥关键作用[21]。AS使人骨髓间充质干细胞(hMSCs)表达4种不同的Runx2可变剪接亚型,包括一种完整的同种型(Runx2 wt)和3种通过跳过外显子5或外显子7产生的可变剪接同种型(Runx2Δ5,Δ7和Δ5Δ7)。Runx2的两种截短形式(Runx2Δ5和Runx2Δ5Δ7)没有定位在细胞核中,并且已经失去了DNA结合活性[21]。研究发现,Runx2外显子5和外显子7都共有磷酸化位点但是遗漏了PY基序的共有序列,逃离了被泛素化降解的命运。因此Runx2可能通过被磷酸化修饰改变了原有的构象,产生4种有效的剪接体在成骨分化中起作用。
Runx2介导复杂的机制控制靶基因骨钙素(OC)基因的转录。骨钙素(OC)被认为在骨形成的后期对成骨细胞的分化和矿化起作用。Makita等[21]研究发现4种亚型中只有包含外显子5的剪接亚型,即只有Runx2 wt和Runx2Δ7才能上调骨肉瘤细胞系中的OC启动子活性,而Runx2Δ5或Runx2Δ5Δ7亚型不能使OC启动子的转录活性增强。此外,Runx2的各剪接体在成骨分化中的作用也受翻译后修饰过程的影响。相比于Runx2Δ7较少受其影响,Runx2 wt与共激活子(CBP,p300)和共阻遏子(HDAC)共表达时可以使OC启动子的转录活性大大增强。这些研究结果证实了Runx2的不同剪接体中,Runx2wt和Runx2Δ7亚型通过AS和翻译后修饰产生了不同的转录活性,介导包括OC基因的靶基因的上调和下调,调控成骨的发生。值得注意的是,软骨细胞和骨细胞两种同种型(Runx2 wt和Runx2Δ7)的表达模式不同。Sinha等[22]研究表明,Runx2 wt/Runx2Δ7的比例可能是hMSCs成骨或是成软骨细胞命运的关键决定因素。此外,二者比例可能作为骨细胞癌变的潜在生物标志物。
2.2 Sp7的可变剪接
Sp7蛋白是Sp家族的一员,Sp7受Runx2诱导调节成骨基因驱动前成骨细胞分化为成熟的成骨细胞,抑制软骨细胞分化,从而将骨祖细胞直接分化为成骨细胞[23]。Sp7通过5’位点处3个外显子中前两个外显子发生AS,产生431个氨基酸编码的长蛋白同种型(Sp7L)和氨基末端截短的413个氨基酸编码的短蛋白同种型(Sp7S)。Sp7L在成骨细胞中低表达,而Sp7S在成骨和软骨细胞中高表达。两种剪接体在不同细胞或组织相对丰度的不同可能与Sp7在启动子区域中存在的一些潜在的转录因子结合位点有关[12]。
Sp7S转录起始与骨钙素特异性元件2(OSE2)重叠[24-26]。OSE2的存在证明Runx2直接调节Sp7S的表达[26-27]。Sp7L转录起始与反向保守的CCAAT盒部分重叠[28]。CCAAT盒是潜在核因子Y(NF-Y)的结合位点,Sp7L可能受类似于骨唾液蛋白被NF-Y转录因子刺激的方式调节丰度[29]。值得注意的是,在发育的不同阶段,如胎儿和成人骨细胞中Sp7表达量的不同可能与AS在细胞或者不同分化阶段的生物学作用的差异有关[10]。
2.3 Sox9与PPARγ的可变剪接
Sox9是促进软骨形成和调节软骨外细胞基质的关键转录因子。最近研究发现,Sox9在转录和剪接中起着双重作用,并且独立于转录活性发挥AS作用。Sox家族共有的HMG结构域参与了Sox9对AS的调节[30]。转录因子Sox9通过与副核蛋白体上的RBP蛋白p54nrb相互作用而影响软骨形成的关键基因Col2A1的剪接[31]。PPARγ是成脂过程的关键转录因子,包括完整的同种型(PPARγ wt)和一个跳过外显子5的较短的同种型(PPARγΔ5)。PPARγΔ5作为显性亚型能够降低PPARγ的活性。研究发现,过表达PPARγΔ5改变了PPARγ诱导的转录网络从而降低MSCs成脂分化的能力[32]。MSCs早期形成前成骨细胞的关键是抑制成软骨和成脂发育,AS通过控制Runx2、Sox9、PPARγ等关键转录因子的AS,影响信号通路的传导方向,在这一过程中起着重要作用。例如著名的Wnt信号通路通过AS抑制PPARγ且激活Runx2有效亚型的产生,从而发挥抑制成脂激活成骨谱系。
3 AS与细胞增殖、基质成熟和基质矿化
3.1 OPN的可变剪接
骨桥蛋白(OPN)是骨基质中较丰富的非胶原蛋白之一,在类骨质形成和基质矿化中起着重要作用。OPN通过AS产生3种剪接亚型,包括全长同种型OPNa,缺失外显子5的OPNb (ΔE5)和缺失的外显子4的OPNc(ΔE4)[10]。Grace等[22]首次证实OPNa和OPNc在体内通过增加动脉生成不同程度地促进功能性缺血后新生血管的形成,促进成骨分化。
3.2 c-Fos的可变剪接
AP-1转录因子家族是由Fos- (c-Fos,FosB,ΔFosB,Fra-1 and Fra-2)和Jun相关(cJun,JunB and JunD)蛋白组成的二聚体复合物,通过与靶基因启动子上的特定序列相互作用来调节多种基因的转录[23],其中c-Fos是体内破骨-巨噬细胞谱系的关键调控因子。c-Fos通过AS产生两种剪接亚型,包括去掉内含子3的c-Fos和保留内含子3的c-Fos-2。c-Fos通过RANKL-RANK信号通路激活破骨细胞吸收类骨质使得成骨细胞在骨陷窝中形成骨[24]。研究发现c-Fos-2转录物在体内或体外以相当高的速率无处不在地合成,且数量高于或类似于编码其他Fos家族成员。同时内含子3赋予c-fos-2约6倍的显著的去稳定作用。值得注意的是,两种c-fos剪接体合成或降解速率的快速变化导致其相对比例的快速而短暂的变化,它们的协同微调与其在成骨分化中的生理功能相关还需进一步研究[25]。
3.3 FosB的可变剪接
FosB属于AP-1转录因子家族的成员之一,参与骨细胞增殖和分化的调节。FosB转录物通过在盒式外显子处的AS产生一种天然存在的FosB的截短形式ΔFosB。ΔFosB在转基因小鼠中过度表达时会抑制MSCs成脂分化,诱导整个骨骼的骨形成增加从而使得骨硬化,同时ΔFosB在骨细胞机械负荷诱导的信号通路中也很重要[26-27]。Δ2ΔFosB是FosB的另一个截短的同种型,它通过骨形态发生蛋白(BMP)信号通路增强信号的传递,并诱导整个骨骼中骨形成的增加[28]。研究证明[29]ΔFosB与Δ2ΔFosB通过形成的带有JunD的异二聚体复合物上调成骨细胞分化早期标志物、下调成脂细胞分化早期标志物的表达,发挥促进成骨分化的作用。
4 AS与其他成骨分化有关基因
4.1 Vegf-A的可变剪接
血管内皮生长因子A(Vegf-A)是一种多功能生长因子,它通过自分泌促进矿化和旁分泌促进血管生成的方式来促进BMSCs的成骨分化[30]。在啮齿动物中,Vegfa包含3种同源剪接变体:Vegf-a120、164和188[31]。Vegf-a120是最短的变体,在促进BMSCs的生长方面效果较差。Vegf-a164在促进BMSCs增殖和软骨分化方面起调节作用,而Vegf-a188在促进BMSCs成骨分化方面更有效[32]。Tian等[12]研究表明,啮齿动物Vegfa产生差异性生物活性剪接亚型与m6A甲基转移酶Mettl3有关,敲除Mettl3虽然不会显著改变Vegf-a120的基因水平,但Vegf-a164和188在内的与骨髓间充质干细胞的增殖和分化有关的基因水平显著降低。另一项研究显示[13],Vegf-A的可变剪接与机械应力相关,不同频率的机械应力控制Vegf-A在盒式外显子(6A、6B和7)处发生AS产生6种不同的剪接亚型。其中Vegf-Awt、Vegf-A206、189和165在高频机械应力下高表达,反之低频机械应力下高表达的Vegf-A145和121中Vegf-A121被分泌而Vegf-A145结合于基底膜。上述不同亚型的分布证明了高机械应力刺激膜结合的Vegf-A亚型上调,而低机械应力使得分泌的Vegf-A亚型上调。这为调节成骨分化提供了一种新的思路,即可以通过改变机械应力来改变Vegf-A亚型,达到局部微循环重建和血管密度增加以再生骨的目的,为骨的创伤愈合治疗提供了一个新的分子靶点。
4.2 NELL-1的可变剪接
NELL-1被称为神经表皮生长样(NEL)样因子1(NELL-1),在体内和体外促进MSCs成骨[33]。该基因有两种亚型,包括含有810个氨基酸的野生型NELL-1810和在外显子2的5’剪接位点处发生AS使N端截短240个氨基酸的亚型NELL-1570。虽然两种亚型都能够表现出成骨分化效应,但NELL-1810是在胚胎骨骼发育中起重要作用,而NELL-1570是在出生后表达并诱导成骨分化;野生型NELL-1810仅表现出对骨髓间充质干细胞增殖有限的刺激,而NELL-1570能够显著刺激多种BMSCs样群体的增殖和成骨分化[14]。然而,目前NELL-1可变剪接的分子机制仍不清楚,还有待进一步研究。
4.3 AMBN的可变剪接
成釉蛋白(AMBN)是一种在间充质和上皮细胞中表达的细胞外基质蛋白,是编码成骨分化的调节剂[34]。AMBN的pre-mRNA通过外显子6的3’剪接位点处发生AS,产生AMBNwt和截短15个氨基酸肽的AMBNΔ61-15,二者都具有促进MSCs增殖和釉质形成的功能[7]。最近研究表明,由AMBN外显子5序列衍生的合成肽(Ex5)可以促进hMSC增殖并激活Runx2和Sp7的表达。Ex5单独作为MSCs的增殖信号甚至比整个AMBNwt分子更有效。有趣的是,Ex5这种效应被外显子6起点处的15氨基酸肽(Q9NP70)所抑制,而Q9NP70又有与Ex5相同的增强hMSC分化和细胞外矿化标志物分泌的积极作用[15]。目前AS对ABMN外显子5/6和各种分子衍生亚型的调控机制仍有待阐明,但可以肯定的是AMBN的AS似乎对编码AMBN细胞外结构域、AMBN的自组装和hMSC的增殖分化有很大的的意义,特别是在成骨方面很重要[7]。
4.4 POSTN的可变剪接
骨膜素(Postn,PN,OSF-2)是一种分泌性细胞外基质糖蛋白。AS发生于Postn外显子16-23处的C末端区,产生Postn-001和Postn-001-008两种剪接亚型[16]。Postn-001包括数量最大的RD结构域,发挥增强成骨分化的作用。相比之下,Postn-001-008包括有不同数量的RD结构域,能够增加骨膜中成骨细胞的附着[17]。有研究报道,在脊椎动物中Postn在AS位点即C末端区显示出逐渐进化的可塑性,该区域可能作为Postn发挥不同生物学功能的基础[18]。
4.5 Col9a1和CDKN2A的可变剪接
Col9a1是一个典型的软骨基因,通过AS产生两种剪接亚型,包括发生于外显子1的Col9a1-201和跳过外显子6的Col9a1-202。Col9a1-202缺少N末端层黏连蛋白G结构域,与骨再生有关。CDKN2A基因也称多重肿瘤抑制基因,剪接产生CDKN2A-201和CDKN2A-202。剪接体201/202的比例控制细胞周期进程,调控骨密度和成骨分化[4]。目前对于AS对Col9a1和CDKN2A的调控机制仍需进一步研究。此外,Khayal等[4]通过二代测序,分别对第0、3、6、12天不同时间节点发生AS的基因各剪接亚型表达含量变化进行生物信息学分析,结果表明,包括Agbl5、Pdzd7、Wnk1等120余种基因在骨分化过程中发生AS。
5 展望
以往对调控MSCs成骨分化的分子机制的研究主要集中在转录调控上。然而,最近的发现揭示了AS在MSCs成骨分化和功能中被低估的作用。本综述总结了AS在成骨分化中调控Runx2、Sp7等关键转录因子剪接的机制,以及产生的各剪接亚型在MSCs细胞增殖和决定细胞命运中的作用。总结了AS调控成骨分化的3种重要方式:(1)通过激活pre-mRNA特异性转录靶标或是拮抗wt蛋白的功能从而表达特异性的蛋白同种型;(2)通过控制同种型亚细胞定位和它与其他分子(如核糖核酸-蛋白质和蛋白质-蛋白质)间的相互作用,微调同种型表达的平衡以确保MSCs的分化;(3)控制不同类型的RBPs在时间与空间上特异性表达,调控剪接体与剪接位点的结合从而实现AS。
目前为止,大多数关于AS与成骨分化的报道局限于体外人工培养的研究中。对于AS在成骨关键转录因子的调控上仍有许多未知值得探索。如何更详细地阐明AS体内确切的分子功能和机制,加深AS在成骨方面的认识,使未来临床骨创伤、骨修复等治疗方面取得新突破将成为研究重点。

