LncRNA NUTM2A-AS1调控miR-183-5p/TGFα影响骨关节炎软骨细胞增殖、凋亡的研究
崔国峰 刘丹 武军龙 魏戎 刘瑞宇 王坤正*
1.西安交通大学附属第二医院骨与关节外科,陕西 西安 710004
2.郑州大学附属洛阳中心医院骨科,河南 洛阳 471009
3.西安医学院第一附属医院风湿免疫科,陕西 西安710077
软骨细胞凋亡及炎症反应引起的软骨损伤是导致骨关节炎(osteoarthritis,OA)形成的重要原因[1-2]。探讨软骨细胞凋亡在OA发生发展中的作用机制,可为OA的预防及早期治疗提供理论基础。转化生长因子α(transforming growth factor α,TGFα)是一种与OA相关的生长因子,其通过抑制基质合成并促进分解代谢因子的表达在关节软骨细胞中诱导OA样表型,TGFα可能会成为未来OA治疗的新靶点[3]。TGFα基因的rs2862851等位基因可显著增加膝关节OA易感性风险[4-5]。生物学软件预测发现TGFα与miR-183-5p有结合位点,miR-183-5p与LncRNA NUTM2A-AS1有结合位点。有研究[6]报道circ_DHRS3能够通过竞争性靶向miR-183-5p正向调节GREM1表达,介导IL-1β作用的软骨细胞增殖、凋亡和细胞外基质降解。沉默NUTM2A-AS1可减轻脂多糖诱导的牙髓细胞凋亡和炎症[7]。然而NUTM2A-AS1对OA软骨细胞增殖、凋亡及炎症反应的影响及分子机制尚不清楚。白细胞介素-1β(IL-1β)在OA中起重要作用,可诱导软骨细胞凋亡和炎症反应[8]。本研究旨在探讨NUTM2A-AS1对IL-1β诱导的软骨细胞增殖、凋亡及炎症反应的影响及其分子机制是否与调控miR-183-5p、TGFα有关。
1 材料与方法
1.1 材料
关节软骨细胞(北京科瑞思搏生物科技有限公司);DMEM培养基、白细胞介素-1β(IL-1β)(美国Sigma);Trizol试剂、荧光定量PCR试剂盒(大连宝生物工程有限公司);细胞计数试剂盒8(CCK-8)、凋亡检测试剂盒(日本同仁研究所);RIPA蛋白裂解液、TNF-α、IL-6酶联免疫试剂盒(艾美捷科技有限公司);双荧光素酶报告基因检测试剂盒(武汉纯度生物科技有限公司)。
1.2 方法
1.2.1细胞处理与分组:将关节软骨细胞用DMEM培养基培养,用5 μg/L的IL-1β处理软骨细胞24 h,记为模型组,以正常培养的细胞作为对照组;将miR-183-5p、miR-NC、si-LncRNA NUTM2A-AS1、si-TGFα、si-NC分别转染至软骨细胞,后经IL-1β处理,记为miR-183-5p+模型组、miR-NC+模型组、si-LncRNA NUTM2A-AS1+模型组、si-TGFα+模型组、si-NC+模型组;将pcDNA-TGFα、pcDNA与si-LncRNA NUTM2A-AS1共转染至软骨细胞,后经IL-1β处理,记为pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组、pcDNA+si-LncRNA NUTM2A-AS1+模型组。
1.2.2RT-qPCR检测LncRNA NUTM2A-AS1、miR-183-5p和TGFα mRNA的表达水平:提取各组细胞总RNA,合成cDNA后进行PCR,相对表达量用2-△△Ct法计算。PCR反应体系:2 μL反转录产物、10 μL SYBR Green Mix、上下游引物各0.5 μL,7 μL无菌水;循环条件:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;融解曲线:95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。
1.2.3蛋白质印迹法检测蛋白表达:提取细胞总蛋白,取50 μL蛋白样品进行聚丙烯酰胺凝胶电泳分离蛋白,后转至PVDF膜,5 %脱脂牛奶室温封闭1 h,加入TGFα 、CyclinD1、Cleaved-caspase-3-抗(1∶1 000),4 ℃孵育过夜,洗膜3次后加入二抗(1∶2 000)室温孵育2 h;洗膜3次,显影,定影,Quantity One测定蛋白条带灰度值,以β-actin为参照计算其相对表达水平。
1.2.4CCK-8检测细胞活性:将各组细胞接种于96孔板,培养48 h后每孔中加入10 μL CCK-8试剂,孵育2 h后,酶标仪检测450 nm处吸光度值(A)。
1.2.5流式细胞术检测细胞凋亡:收集各组细胞,用预冷的PBS漂洗2次,与500 μL的结合缓冲液混匀,加入10 μL的Annexin V-FITC,再加入5 μL的PI,混匀后避光孵育10 min;最后上流式细胞仪检测。
1.2.6酶联免疫吸附法(ELISA)检测TNF-α、IL-6水平:各组细胞培养48 h后取上清,按照试剂盒操作检测TNF-α、IL-6水平。
1.2.7双荧光素酶报告实验:将LncRNA NUTM2A-AS1和TGFα的野生型、突变型荧光素酶报告基因载体分别与miR-NC和miR-183-5p共转染至软骨细胞,按试剂盒说明书检测荧光素酶活性。
1.3 统计学分析

2 结果
2.1 RT-qPCR检测各组细胞中LncRNA NUTM2A-AS1、miR-183-5p和TGFα mRNA的表达水平
与对照组比较,模型组LncRNA NUTM2A-AS1、TGFα mRNA表达升高(P<0.05),miR-183-5p表达降低(P<0.05);与si-NC+模型组比较,si-LncRNA NUTM2A-AS1+模型组LncRNA NUTM2A-AS1、TGFα mRNA表达降低(P<0.05),miR-183-5p表达升高(P<0.05);与miR-NC+模型组比较,miR-183-5p+模型组TGFα mRNA表达降低(P<0.05),miR-183-5p表达升高(P<0.05);与si-NC+模型组比较,si-TGFα+模型组TGFα mRNA表达降低(P<0.05);与pcDNA+si-LncRNA NUTM2A-AS1+模型组比较,pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组TGFα mRNA表达升高(P<0.05),见表1。
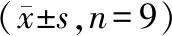
表1 RT-qPCR检测各组细胞中LncRNA NUTM2A-AS1、miR-183-5p和TGFα mRNA的表达水平Table 1 RT-qPCR was used to detect the expression levels of LncRNA NUTM2A-AS1, miR-183-5p and TGFα mRNA in each group of
2.2 蛋白质印迹法检测各组细胞中蛋白表达
与对照组比较,模型组TGFα和Cleaved-caspase-3蛋白表达升高(P<0.05),CyclinD1蛋白表达减少(P<0.05);与si-NC+模型组比较,si-LncRNA NUTM2A-AS1+模型组Cleaved-caspase-3蛋白表达降低(P<0.05),CyclinD1蛋白表达升高(P<0.05);与miR-NC+模型组比较,miR-183-5p+模型组Cleaved-caspase-3蛋白表达降低(P<0.05),CyclinD1蛋白表达升高(P<0.05);与si-NC+模型组比较,si-TGFα+模型组TGFα和Cleaved-caspase-3蛋白表达降低(P<0.05),CyclinD1蛋白表达升高(P<0.05);与pcDNA+si-LncRNA NUTM2A-AS1+模型组比较,pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组TGFα和Cleaved-caspase-3蛋白表达升高(P<0.05),CyclinD1蛋白表达降低(P<0.05),见图1和表2。
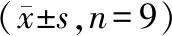
表2 Western Blot检测各组细胞中蛋白表达Table 2 Western Blot was used to detect the protein expression in each group of
2.3 CCK-8检测各处理组细胞活性
与对照组比较,模型组活性降低(P<0.05);与si-NC+模型组比较,si-LncRNA NUTM2A-AS1+模型组活性升高(P<0.05);与miR-NC+模型组比较,miR-183-5p+模型组活性升高(P<0.05);与si-NC+模型组比较,si-TGFα+模型组活性升高(P<0.05);与pcDNA+si-LncRNA NUTM2A-AS1+模型组比较,pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组活性降低(P<0.05),见表3。
2.4 流式细胞术检测各组细胞凋亡情况
与对照组比较,模型组凋亡率升高(P<0.05);与si-NC+模型组比较,si-LncRNA NUTM2A-AS1+模型组凋亡率降低(P<0.05);与miR-NC+模型组比较,miR-183-5p+模型组凋亡率降低(P<0.05);与si-NC+模型组比较,si-TGFα+模型组凋亡率降低(P<0.05);与pcDNA+si-LncRNA NUTM2A-AS1+模型组比较,pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组凋亡率升高(P<0.05),见图2和表3。
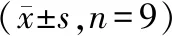
表3 CCK-8检测各处理组细胞活性Table 3 CCK-8 was used to detect the cell viability of each treatment
2.5 酶联免疫吸附法(ELISA)检测各组细胞TNF-α、IL-6水平
与对照组比较,模型组TNF-α和IL-6水平升高(P<0.05);与si-NC+模型组比较,si-LncRNA NUTM2A-AS1+模型组TNF-α和IL-6水平降低(P<0.05);与miR-NC+模型组比较,miR-183-5p+模型组TNF-α和IL-6水平降低(P<0.05);与si-NC+模型组比较,si-TGFα+模型组TNF-α和IL-6水平降低(P<0.05);与pcDNA+si-LncRNA NUTM2A-AS1+模型组比较,pcDNA-TGFα+si-LncRNA NUTM2A-AS1+模型组TNF-α和IL-6水平升高(P<0.05),见表5。
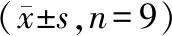
表5 酶联免疫吸附法(ELISA)检测各组细胞TNF-α、IL-6水平Table 5 Enzyme-linked immunosorbent assay (ELISA) was used to detect the levels of TNF-α and IL-6 in each group of
2.6 LncRNA NUTM2A-AS1通过miR-183-5p调控TGFα的表达
Starbase预测显示LncRNA NUTM2A-AS1与miR-183-5p有结合位点,miR-183-5p与TGFα有结合位点(图3A、3B)。LncRNA NUTM2A-AS1或TGFα野生型报告质粒与miR-183-5p共转染后荧光素酶活性降低(P<0.05),见表6、表7。与si-NC比较,si-LncRNA NUTM2A-AS1组LncRNA NUTM2A-AS1和TGFα蛋白表达降低,miR-183-5p表达升高(P<0.05);与si-LncRNA NUTM2A-AS1+anti-miR-NC比较,si-LncRNA NUTM2A-AS1+anti-miR-183-5p组miR-183-5p表达降低,TGFα蛋白表达升高(P<0.05),见表8、图3C。
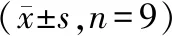
表6 miR-183-5p与NUTM2A-AS1报告质粒共转染后的细胞荧光素酶活性Table 6 Cellular luciferase activity after co-transfection of miR-183-5p with NUTM2A-AS1 reporter
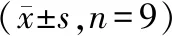
表7 miR-183-5p与TGFα报告质粒共转染后的细胞荧光素酶活性Table 7 Cellular luciferase activity after co-transfection of miR-183-5p with TGFα reporter n=9)
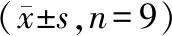
表8 LncRNA NUTM2A-AS1通过miR-183-5p调控TGFα的表达Table 8 LncRNA NUTM2A-AS1 regulates TGFα expression via n=9)
3 讨论
OA是多种因素所致的炎性病症,软骨细胞凋亡可直接导致关节软骨退变甚至钙化;炎症在关节软骨退变过程中起重要驱动作用,其不仅引起软骨组织细胞外基质降解,而且导致软骨细胞凋亡[9-11]。因此,抑制软骨细胞凋亡和炎症反应对防治OA具有重要意义。已有研究[3-5]报道TGFα与OA的发生有关,TGFα基因的rs2862851等位基因影响汉族人群膝关节OA的易感性,且与其严重程度之间呈正相关。本研究结果显示,IL-1β诱导的软骨细胞中TGFα mRNA和蛋白表达水平升高,提示TGFα确实可能与OA进展有关。TNF-α、IL-6是促炎因子,其可促进炎症反应,加重软骨破坏损伤[12];本研究发现低表达TGFα可抑制IL-1β诱导的软骨细胞凋亡,抑制TNF-α、IL-6水平,提高细胞活性,这表明低表达TGFα可抑制IL-1β诱导的软骨细胞凋亡和炎症反应,促进细胞存活,提示TGFα低表达可保护软骨免受损伤。
为进一步研究TGFα上游可能的分子机制,本研究通过生物学软件预测到TGFα是miR-183-5p的潜在靶基因。IL-1β诱导的软骨细胞中miR-183-5p低表达,提示miR-183-5p可能与软骨细胞损伤有关。有研究[13]报道骨髓间充质干细胞的细胞外囊泡通过携带miR-183-5p改善脑神经功能,降低脑水含量并抑制炎症反应。miR-183-5p通过负调节PTEN来减轻缺血性损伤[14]。miR-183-5p还通过减少凋亡细胞和降低凋亡相关蛋白水平来减轻心肌缺血/再灌注损伤[15]。说明miR-183-5p具有抑制细胞炎症反应及损伤的作用。本研究发现,过表达miR-183-5p可抑制IL-1β诱导的软骨细胞凋亡和炎症反应,促进细胞存活,提示miR-183-5p可保护IL-1β诱导的软骨细胞免受损伤。此外,本研究证实miR-183-5p可靶向调控TGFα,提示miR-183-5p可能通过调控TGFα影响关节软骨细胞凋亡和炎症反应。
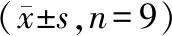
表4 流式细胞术检测各组细胞凋亡情况Table 4 Flow cytometry was used to detect cell apoptosis in each
研究[16-18]表明lncRNA参与OA的发病机制,可影响软骨细胞的增殖、凋亡、炎症和细胞外基质的降解。因此,本研究进一步预测miR-183-5p可能上游调控基因,发现miR-183-5p与LncRNA NUTM2A-AS1有结合位点。本研究结果显示,IL-1β诱导的软骨细胞中LncRNA NUTM2A-AS1表达水平升高,提示LncRNA NUTM2A-AS1可能与OA的进展有关。已有研究[7]表明沉默NUTM2A-AS1可减轻LPS诱导的牙髓细胞凋亡和炎症。本研究转染si-RNA来抑制NUTM2A-AS1表达,结果显示低表达LncRNA NUTM2A-AS1可抑制IL-1β诱导的软骨细胞凋亡和炎症反应,促进细胞存活。
此外,本研究证实了LncRNA NUTM2A-AS1可靶向调控miR-183-5p,低表达LncRNA NUTM2A-AS1可下调TGFα的表达,且TGFα过表达可逆转LncRNA NUTM2A-AS1低表达对IL-1β诱导的软骨细胞增殖、凋亡及炎症反应的影响,提示LncRNA NUTM2A-AS1可通过miR-183-5p进而调控TGFα表达影响软骨细胞损伤。
综上所述,低表达LncRNA NUTM2A-AS1能够通过调控miR-183-5p/TGFα抑制IL-1β诱导的软骨细胞凋亡及炎症反应,促进细胞存活。

