大气细颗粒物对HepG2细胞氧化应激的影响
林司杭,谢菁菁,林蕾蕾,邱文可,周林,曹雯娟,李明*
(1.广东药科大学临床医学院;2.广东药科大学生命科学与生物制药学院,广东 广州 510006)
随着近年来空气污染日益严重,大气颗粒物已成为威胁人类健康的重要因素,特别是空气动力学直径小于2.5 μm 的细颗粒物(fine particulate matter,PM2.5)的危害性尤其严重[1]。PM2.5 不仅可以在肺泡沉积干扰呼吸系统的功能,甚至可通过肺部毛细血管等途径进入循环系统,引起肺外器官疾病[2]。最近流行病学和来自临床横断面的研究表明PM2.5是肝脏疾病的重要致病因素[3],特别是与非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)密切相关,如我国学者Sun等[3]分析了58026 名台湾地区居民的调查数据后发现PM2.5浓度每增加1 μg/mL,NAFLD 发病率上升1.06%(95%CI:1.04~1.08)[4],来自对国外居民的调查也得到了类似的结论[5]。同时,有动物实验也显示长期吸入PM2.5 可加速NAFLD 的发生[6]。我国是世界上大气污染最严重的国家之一,PM2.5 的浓度甚至超过世卫组织标准的几十倍,这可能是导致我国NAFLD 发病率日益增高的原因之一。因此,研究PM2.5 的肝毒性,揭示其致肝病机理不仅有助于认识大气污染对健康的危害性,而且能加深对NAFLD 发病原因的了解,具有重要意义。
NAFLD 发病机制复杂,其中以“二次打击学说”被广泛认可[7]。该学说认为“初次打击”是指肝内胰岛素抵抗和脂肪储积,随后大量游离脂肪酸在肝脏堆积,导致肝细胞过度炎症反应、氧化应激增强和脂质过氧化造成“二次打击”,引起肝脏的坏死性炎症和纤维化,其中氧化应激被认为是二次打击中的主要致病机制[8]。许多研究发现NAFLD 患者肝脏会发生氧化应激,而氧化应激会造成脂质过氧化,二者共同作用引起肝脏炎症反应和肝细胞凋亡,最终导致肝纤维化[9],抗氧化药物对NAFLD 具有保护作用也证实了氧化应激在NAFLD 发生发展中的作用。因此,本文采用不同浓度的PM2.5 对肝HepG2 细胞进行染毒,检测细胞氧自由基(reactive oxygen species, ROS)和脂过氧化产物丙二醛(malondialdehyde, MDA)含量的变化,以及细胞抗氧化相关蛋白如超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT) 的表达情况,分析PM2.5 对肝细胞氧化应激状态的影响,探讨PM2.5 引起NAFLD 的机制。
1 材料与仪器
1.1 试剂与仪器
DCFH-DA(江苏凯基生物技术股份有限公司),Trizol、PrimeScriptTM RT reagent Kit 和SYBR Premix Ex TaqTMⅡ(日本TaKaRa 公司);总SOD 检测试剂盒和MDA 检测试剂盒(上海碧云天生物技术有限公司);酶标仪(美国Bio-Tek 公司);定量PCR 仪器(美国Bio-Rad 公司)。
2 方法
2.1 PM2.5 采集
参照Ye 和本室所建立的方法在广州城区采集大气中的PM2.5,加入PBS 制备成PM2.5 样品混悬液于-80 ℃保存备用[10-11]。
2.2 细胞培养
人肝癌细胞株HepG2 细胞购自武汉大学细胞库。细胞按照说明书,用含10%胎牛血清和1%青链双抗的DMEM 完全培养基于37 ℃、5%CO2培养箱中进行培养,待细胞达到80%~90%融合后进行传代,取对数生长期细胞用于后继实验。
2.3 DCFH-DA 荧光探针法检测细胞内ROS 水平
按2×105/孔将HepG2 细胞种于6 孔培养板中,待细胞完全贴壁后弃去培养基。实验分为阴性对照组和低、中、高剂量PM2.5 染毒组(PM2.5 质量浓度分别为12.5、25、50 μg/mL)。根据分组用PM2.5处理4 h 后,加入10 μmol/L DCFH-DA 避光孵育1.5 h,PBS 洗涤3 次后在荧光显微镜下观察拍照。
2.4 细胞内MDA 和SOD 含量的测定
按2×105/孔将HepG2 细胞接种于6 孔板中培养,待细胞长到50%融合,按照步骤“2.3”分组并处理细胞,6 h 后分别根据试剂盒说明书要求收集样品,依照操作步骤检测细胞MDA和总SOD的含量。
2.5 qRT-PCR 法检测SOD1、SOD2 和CAT mRNA的表达
按2×105/孔将HepG2细胞接种于6孔板中培养后,按照步骤2.2 进行分组并处理细胞。12 h 后用Trizol试剂从HepG2细胞中提取总RNA,测定RNA 浓度后使用反转录试剂盒合成cDNA作为模板进行RT-PCR检测。反应条件为:95℃预变性30s;然后95℃变性5s,60 ℃退火33 s,72 ℃延伸30 s,循环数为40 个循环。所有样品均以β-actin 为内参,结果用2-ΔΔCt法计算基因表达变化。引物序列如下:β-actin上游引物:5′-GATTACTGCTCTGGCTCCTAGC-3′,下游引物:5′-GACTCATCGTACTCCTGCTTGC-3′;SOD1 上游引物:5′-ATGGCGACGAAGGCCGTGTGCGTGC-3′,下游引物:5′-TTATTGGGCGATCCCAATTACACCACAAGCC-3′;SOD2上游引物:5′-CTCCCCGACCTGCCCTACGAC-3′,下游引物:5′-TGCAGGTAGTAAGCGTG-3′;CAT 上游引物:5′-TGAGGTTGAACAGATAGC-3′,下游引物:5′-CACAGGTATATGAAGATAATTG-3′。
2.6 统计方法
数据以表示,统计学分析采用Graphpad Prism 8 软件进行,各组间差异采用方差分析(ANOVA)进行均数间多重比较,P<0.05 表示差异有统计学意义。
3 结果
3.1 PM2.5对HepG2细胞内ROS的影响
结果如图1 显示,与阴性对照组比较,PM2.5 染毒组细胞中ROS 的荧光强度显著增强(P<0.05),且随着PM2.5浓度增大而增强。由此说明PM2.5可引起HepG2细胞ROS生成增多。
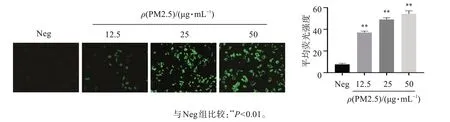
图1 PM2.5对HepG2细胞ROS生成的影响(DCFH-DA 荧光探针法,200×,n=3)Figure 1 Effects of PM2.5 on ROS production in HepG2 cells(DCFH-DA fluorescent probe,×200,±s,n=3)
3.2 MDA和SOD检测结果
与阴性对照组相比,PM2.5 可使细胞内SOD 的水平显著下降(图2A),同时使MDA的水平显著升高(图2B),且二者与阴性对照组相比差异有统计学意义(P<0.05)。说明PM2.5 不仅使细胞脂过氧化物MDA 生成增多,上调HepG2 细胞的氧化水平,同时下调细胞内主要的抗氧化酶SOD 含量,抑制肝细胞的抗氧化能力,最终造成肝细胞氧化应激状态。

图2 PM2.5染毒对HepG2细胞SOD和MDA含量的影响Figure 2 Effects of PM2.5 on the levels of SOD and MDA in HepG2 cells(±s,n=3)
3.3 PM2.5 对HepG2 细 胞SOD1、SOD2 和CAT mRNA表达的影响
与阴性对照组比较,PM2.5染毒组SOD1、SOD2和CATmRNA 表达均明显下调,与对照组相比差异有统计学意义(P<0.05)。见图3。本结果与结果“3.2”中有关SOD 的研究结果一致,表明PM2.5 对HepG2 细胞氧化应激的影响不仅在于促进ROS 生成,还与降低细胞抗氧化能力有关。
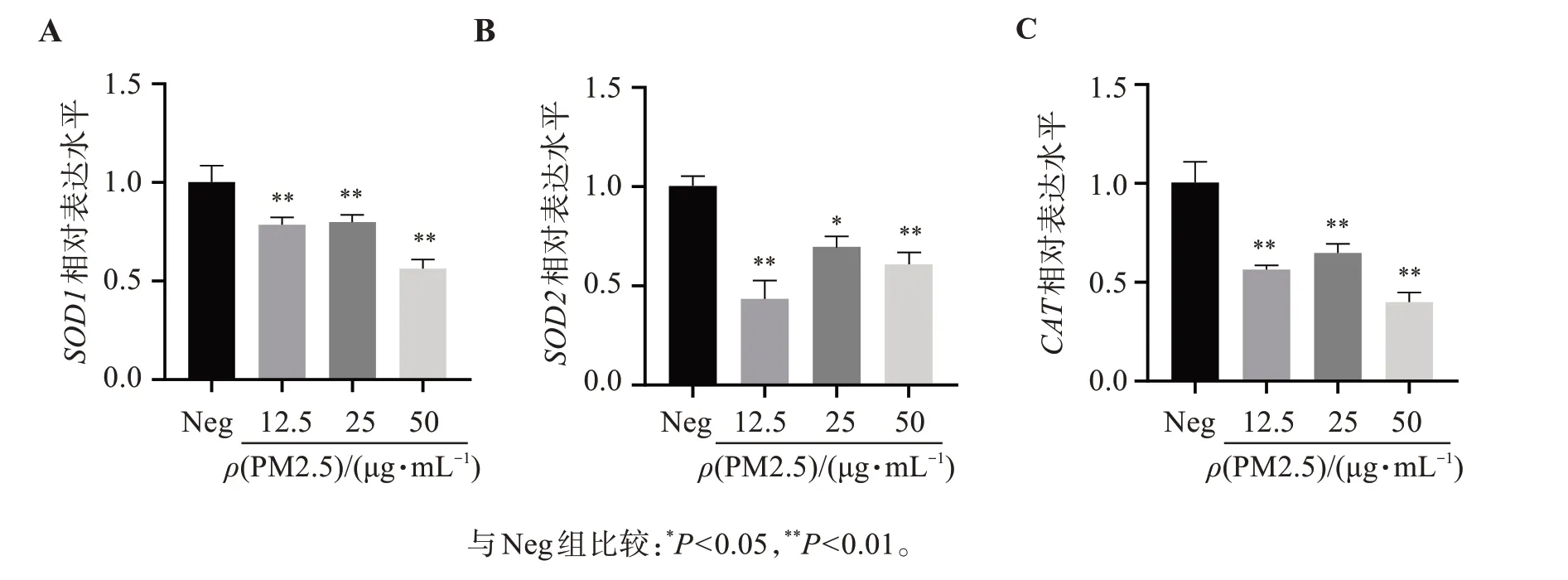
图3 PM2.5对HepG2细胞SOD1、SOD2和CAT mRNA表达的影响Figure 3 Effects of PM2.5 on the mRNA expression of SOD1、SOD2和CAT in HepG2 cells(±s,n=3)
4 讨论
根据世界卫生组织的报告,每年有近300 万人死于空气污染相关的疾病[12]。PM2.5 由于粒径小,比表面积大,在大气中悬浮时间长的物理特性和容易富集多种有机物及重金属的化学特性,使之更容易进入机体内并引发疾病[13]。越来越多的证据表明,长期暴露于PM2.5 可能是肝脏疾病发病率和死亡率增高的一个重要风险因素[14]。除前述流行病学研究证实PM2.5 暴露与NAFLD 相关外[4],动物实验也证实了二者的联系,如Jian[15]等发现气管内滴注PM2.5可诱导小鼠肝脏出现脂肪变和非酒精性脂肪性肝炎等NAFLD 表现,该结果与其他研究结果一致[16-17]。因此,PM2.5 被认为是一种新的NAFLD 致病危险因素。
体外细胞模型是研究PM2.5 毒性的常见方法。多个研究在体外培养肝细胞,观察了PM2.5 染毒对肝内细胞的毒性,如有研究用代谢组学的方法证实PM2.5体外染毒导致肝细胞代谢紊乱[11,18];还有研究报道PM2.5 可诱导肝细胞凋亡[19];我们前期也发现证实PM2.5 通过激活SREBP-1c 和LXR-α引起肝细胞脂肪堆积[10]。
氧化应激在NAFLD 的起始和进展中均发挥着至关重要的作用。常见肝毒性物质引起肝损伤都与氧化应激有关,如乙型肝炎病毒、氰酸盐、肠源性肝毒物等导致NAFLD 都与ROS 增多相关[20-21]。同时研究还显示抑制ROS 对NAFLD 具有保护作用,多种中药发挥护肝作用都与抑制肝脏的氧化应激有关[22-23]。这充分说明了氧化应激在NAFLD“二次打击”中的关键作用。
为了证实PM2.5 对肝细胞氧化应激的影响,本研究首先用DCFH-DA 荧光染色法观察了PM2.5 染毒肝细胞ROS 的生成情况,结果显示PM2.5 染毒后HepG2 细胞内可见大量绿色荧光,证实了肝细胞受到PM2.5 攻击后会产生大量的ROS。实验还发现PM2.5 使肝细胞内MDA 明显增多。MDA 是ROS与生物膜磷脂中的多价不饱和脂肪酸发生脂质过氧化反应生成的脂过氧化产物,不仅反映细胞受损情况,而且MDA 可加速氧化应激反应,协同ROS干扰肝脏内细胞的正常功能。提示PM2.5 染毒促进ROS的生成。
SOD 是细胞内主要的抗氧化物质,其可及时清除机体产生的ROS,使得细胞的氧化/抗氧化维持在一种动态平衡状态[24]。抗氧化物质的减少是细胞氧化应激的原因之一。本研究发现PM2.5干预后细胞内主要的抗氧化损伤酶类SOD 含量显著减少,并进一步采用定量PCR 分析其编码基因SOD1和SOD2的表达情况,结果显示PM2.5 染毒后肝细胞SOD1和SOD2的表达也明显下降,此外结果还显示细胞内另一个主要的抗氧化酶CAT的基因表达在PM2.5干预后也明显降低。这些结果提示PM2.5不仅促进ROS 生成,还可以抑制细胞的抗氧化能力,最终造成肝细胞氧化应激,这可能与PM2.5 引起NAFLD有关。虽然本实验仅从体外观察了PM2.5对肝细胞氧化应激的影响,但是最近有研究显示PM2.5 可引起高脂饮食小鼠肝脏ROS 生成增多从而加速NAFLD 的疾病进程[17],也证实了我们的实验结果,因此推测氧化应激可能是PM2.5 引起NAFLD 的主要机制之一,后继我们将建立动物模型,以氧化应激为靶点研究PM2.5 的具体信号途径并寻找防治PM2.5肝毒性的药物。
综上所述,本研究在体外初步证实PM2.5 染毒引起HepG2 细胞氧化应激。此外,前期我们和其他研究者发现PM2.5 可引起血管内皮细胞和肺上皮细胞等多种细胞的氧化应激反应[26-27],因此引起机体氧化应激可能是PM2.5 导致包括NAFLD 在内的多种疾病的共同途径,为后继实验将以氧化应激为靶点寻找抗PM2.5 毒性的防治方法提供了基础。

