施万细胞样细胞对大鼠背根神经节细胞突起生长和神经生长因子表达的影响及其机制
杜元良,任 旺,刘 琳,胡朔丹,刘茗宇,杜鹏飞,付秀美,3
(1.承德医学院附属医院骨外科,河北 承德 067000;2.承德医学基础医学院人体解剖学教研室,河北 承德 067000;3.河北省神经损伤与修复重点实验室,河北 承德 067000)
背根神经节(dorsal root ganglion,DRG)即脊神经节,是周围神经系统中神经元胞体聚集而形成的结构,位于椎间孔处,是脊神经后根与前根汇合成脊神经之前膨大的部分,为感觉神经元胞体所集聚的部位。DRG细胞生存能力较强,体外培养的成功率较高,因此关于DRG细胞的基础和临床研究[1]较多。施万细胞(Schwann cells,SCs)是周围神经的胶质细胞,在周围神经损伤(peripheral nerve injury,PNI)后的再生修复过程中可以发挥诱导再生、营养支持和促进轴突生长等作用[2-3]。然而,体外培养SCs却存在来源困难、扩增缓慢和易受污染等不足[4]。脂肪源性干细胞(adipose-derived stem cells,ADSCs)源于脂肪组织,含有大量的细胞基质成分,其来源充分、取材方便、体外培养增殖速度快且扩增能力强[5-6]。本课题组前期研究[7]证实:ADSCs可在体外经多种因子联合诱导,分化为施万细胞样细胞(Schwann cell-like cells,SCLCs)。这不仅避免了SCs的缺点,还能充分发挥SCs在PNI后的再生修复作用,这将对周围神经的再生修复起到极大的促进作用。HAN等[8]研究显示:将DRG细胞接种于载有分化后ADSCs(即形成为SCLCs)的碳纳米管上,其细胞数量及每个细胞的最长轴突均明显高于单独的碳纳米管。但关于SCLCs对DRG细胞的作用机制目前尚不十分清楚。
神经生长因子(nerve growth factor,NGF)具有营养、保护和促进神经再生的作用[9-10]。研究[11]显示:NGF与其细胞膜上的受体结合是启动感觉神经元分化、生长和存活过程的主要因素。本研究通过建立SCLCs与DRG细胞共培养体系,观察DRG细胞及其突起数的变化并检测DRG细胞中NGF蛋白的表达,进一步探讨SCLCs促进DRG细胞生长的作用及其可能的作用机制,为采用细胞移植方式治疗PNI提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF级健康Sprague-Dawley(SD)大鼠购于辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2015-0001。10只体质量为80~120 g的雄性SD大鼠用于ADSCs的分离与培养;6只雌性和2只雄性SD大鼠(体质量为180~220 g)进行合笼喂养,待幼鼠出生后,取出生1~3 d的幼鼠用于DRG细胞的培养。本研究经过承德医学院实验动物管理和伦理委员会批准,批准文号:CDMCLAC-20190402-007,实验过程及操作均符合国家有关实验动物的管理和使用规定。DMEM/F12培养基购于美国Genview公司,0.25%胰酶-EDTA和Ⅰ型胶原酶购于美国Invitrogen公司,胎牛血清(fetal bovine serum,FBS)购于以色列BI公司,地塞米松、茜素红、β-甘油磷酸钠、维生素C、β-巯基乙醇(β-mercaptoethanol,β-ME)和全反式维甲酸(all-trans-retinoic acid,ATRA)购于美国Sigma公司,佛司可林(forskolin,FSK)购于美国Alexis公司,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、重组人神经调节蛋白β1(recombinant human neuregulin beta-1,rh-NRG-β1)和血小板源性生长因子AA(platelet-derived growth factor-AA, PDGF-AA) 购 于 美 国PeproTech公司,兔抗S100抗体购于美国Santa Cruz公司,兔抗NGF抗体、兔抗NeuN抗体、Cy3标记山羊抗兔IgG荧光二抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG和山羊抗小鼠IgG均购于美国Abclonal公司,BCA蛋白定量试剂盒、RIPA蛋白裂解液和小鼠抗β-actin抗体均购于沈阳鼎国昌盛生物技术有限公司,抗荧光淬灭封片液、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色液和DAB染色液购于上海碧云天生物技术公司。BX43荧光显微镜、CKX53倒置显微镜及其相应图像采集系统均购于日本Olympus公司。
1.2 原代ADSCs的分离培养及其分化能力检测采用2%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉大鼠,无菌条件下分离获取双侧附睾旁的脂肪组织,充分清洗并剪碎。采用0.1%Ⅰ型胶原酶对获取组织消化45~60 min,后加入含10%血清的DMEM/F12培养基终止消化,置于200钼滤网进行过滤和离心(1 000 r·min-1,10 min),得到细胞沉淀。向沉淀中加入适量含10%血清的DMEM/F12培养液,制成单细胞悬液,接种于25 mL培养瓶中,置于37℃、5%CO2的孵育箱中培养,倒置显微镜下观察细胞贴壁和生长情况。48 h后第1次换液,然后根据细胞生长情况每2~3 d换液1次。当贴壁细胞爬满瓶底80%左右时,采用0.25%胰酶-EDTA消化,按1∶2的比例进行传代培养。选取第3代ADSCs,将细胞密度调整为1×105mL-1,接种于带有无菌盖玻片的6孔板上,置于37℃、5%CO2孵育箱中培养。当细胞生长至约80%融合时,更换为成骨诱导培养液(即在基础培养基中加入0.1μmol·L-1地塞米松、50μmol·L-1维生素C和10 mmol·L-1β-甘油磷酸钠),25~28 d后进行茜素红染色,检测ADSCs的成骨诱导分化能力。
1.3 ADSCs向SCs诱导分化及其鉴定选取第3代ADSCs,当细胞密度达到80%左右时,采用0.25%胰酶-EDTA消化后收集细胞,将细胞密度调整为1×105mL-1,接种于25 mL培养瓶中。首先进行预诱导:采用含1 mmol·L-1β-ME无血清的培养液培养24 h,含35μg·L-1ATRA的培养液培养72 h。随后更换为含血清、14μmol·L-1FSK、5μg·L-1PDGF-AA、200μg·L-1rh-HRG-β1和10μg·L-1bFGF的SCs条件培养液培养进行正式诱导,时间为10~14 d。以基础培养液作为对照组,倒置显微镜下观察细胞的生长状况。在细胞爬片24~48 h后,采用含4%多聚甲醛的磷酸缓冲液固定细胞20~30 min。5%血清封闭30 min,加入兔抗S100抗体(1∶200),置于4℃冰箱孵育过夜。第2天,室温平衡1 h后,加入Cy3标记的山羊抗兔IgG(1∶200),37℃避光孵育1 h,0.01 mol·L-1PBS漂洗3次,每次5 min,DAPI复染细胞核,荧光防淬灭封片液封片,荧光显微镜下观察并进行图像采集。
1.4 原代DRG细胞的分离培养和鉴定选取出生后1~3 d的幼鼠,采用75%酒精进行浸泡消毒,取出DRG,采用眼科剪将其充分剪碎,加入2倍体积的0.25%胰酶-EDTA于37℃恒温箱内消化30~40 min。加入等量的含血清的培养基终止消化、1 000 r·min-1离心5 min,弃去上清后再加入适量的培养基重悬细胞,200钼滤网过滤,行细胞计数,将细胞密度调整为1×106mL-1,接种于培养瓶中并置于37℃、5%CO2孵育箱中培养。常规对细胞进行换液、传代培养,倒置显微镜下观察DRG细胞的生长情况。取第3代DRG细胞爬片,免疫组织化学染色观察DRG细胞中NeuN蛋白的表达情况。
1.5 共培养体系的建立和细胞分组采用直接接触式共培养的方法建立SCLCs与DRG细胞共培养体系。取第3代DRG细胞和SCLCs,在细胞密度达80%左右时,采用0.25%胰酶-EDTA消化后收集细胞,将细胞密度调整为1×105mL-1,随后将两者以相同体积混合为共培养组。单培养组则是将2份等体积的DRG细胞直接混合后进行常规培养。2组细胞均根据实验要求进行接种和铺板,置于37℃、5%CO2孵育箱中培养,镜下观察细胞的形态结构并进行细胞染色和蛋白提取。
1.6 HE染色观察DRG细胞的形态结构采用含4%多聚甲醛的磷酸缓冲液对细胞固定20~30 min。0.01 mol·L-1PBS洗 涤 细 胞3次,时 间 分 别 为10、5和5 min。先采用苏木素染色10~15 min,自来水冲洗15 min,再采用伊红染色6 min,采用盐酸-酒精分化30 s,自来水冲洗5 min。分别采用70%、80%、90%、95%和100%酒精进行脱水。二甲苯透明,最后中性树胶封片、光学显微镜下进行观察和图像采集。采用Image Pro Plus 6.0图像分析软件计数每个视野下细胞数目。每组随机选取3张切片,每张切片任选3个视野,取平均值。
1.7 免疫组织化学法检测DRG细胞中神经元核抗原(neuronal nuclear antigen,NeuN)和NGF蛋白表达情况细胞爬片24~48 h后,采用含4%多聚甲醛的磷酸缓冲液固定细胞20~30 min。0.01 mol·L-1PBS洗涤细胞3次,时间分别为10、5和5 min。采用3%Triton X-100处理10 min,0.01 mol·L-1PBS洗涤3次,每次5 min。山羊血清IgG封闭30 min,滴加一抗兔抗NeuN(1∶200)和兔抗NGF(1∶200),置于4℃冰箱孵育过夜。第2天,室温平衡1 h后采用0.01 mol·L-1PBS洗涤3次,时间分别为10、5和5 min,加入山羊抗兔IgG,37℃孵育2 h,0.01 mol·L-1PBS洗 涤3次,每 次5 min。DAB显色3~10 min,苏木素染色15 min后流水冲洗15 min(NeuN不需要苏木素复染),经过70%、80%、90%、95%和100%酒精进行脱水,二甲苯透明,中性树胶封片,光学显微镜下观察并进行图像采集。
1.8 Western blotting法检测2组DRG细胞中NGF蛋白表达水平当细胞达到约80%融合时,采用0.25%胰酶-EDTA消化后收集细胞得到沉淀,加入裂解液置于冰上裂解30~40 min,提前将离心机温度设置为4℃、12 000 r·min-1离 心30 min,其上清为所提取细胞的蛋白。采用BCA蛋白试剂盒进行定量、凝胶电泳和转膜,采用5%FBS于室温下封闭1 h,加入一抗分别为兔抗NGF(1∶400)和小鼠抗β-actin(1∶5 000),置于4℃冰箱孵育过夜。第2天,室温平衡1 h后采用TBST缓冲液漂洗3次,每次10 min,依次加入HRP标记的山羊抗兔和山羊抗小鼠IgG(1∶10 000),37℃孵育1 h,TBST缓冲液洗涤3次,每次5 min,ECL发光后检测蛋白条带,采用Image Pro Plus 6.0图像分析软件检测蛋白条带的灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/标准蛋白条带灰度值。
1.9 统计学分析采用SPSS 17.0统计软件进行统计学分析。共培养组和单培养组DRG细胞数、细胞突起数和DRG细胞中NGF蛋白表达水平均呈正态分布,以±s表示,组间两两比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ADSCs的形态表现和分化能力原代培养48 h,镜下可见散在、单一和两端略长的短梭型细胞,胞体周围有亮晕(图1A)。7 d以后,细胞数量增加、体积增大、胞体伸展呈长梭形或树叶状,细胞排列紧簇,呈旋涡状或类似铺路石样外观(图1B)。为检测所分离培养的细胞是否为ADSCs,对其进行分化能力的检测。细胞在成骨诱导液中培养25~28 d后行茜素红染色,显微镜下可观察到钙化的结节(图1C)。

图1 ADSCs的形态表现和分化能力(×200)Fig.1 Morphology and differentiation ability of ADSCs(×200)
2.2 ADSCs诱导分化SCLCs的形态表现和鉴定第3代ADSCs通过β-ME和ATRA的预诱导及FSK、PDGF-AA、rh-HRG-β1和bFGF的正式诱导,其向SCs诱导分化。初期,镜下可见细胞体明亮呈梭形,胞体两端伸出细长的突起。7~8 d后,细胞体积明显增加,胞体变为圆形或椭圆形,折光度进一步加强,突起变得更加细长,形似树枝或栅栏状,形态多不规则,突起间相互形成连接形似网状。为检测所获得的细胞是否为SCLCs,采用免疫荧光染色检测SCs标志物S100蛋白的表达。荧光显微镜下可见S100蛋白被标记为红色荧光,阳性产物主要集中在胞浆及其突起,DAPI浸染细 胞核,为蓝色荧光。见图2。
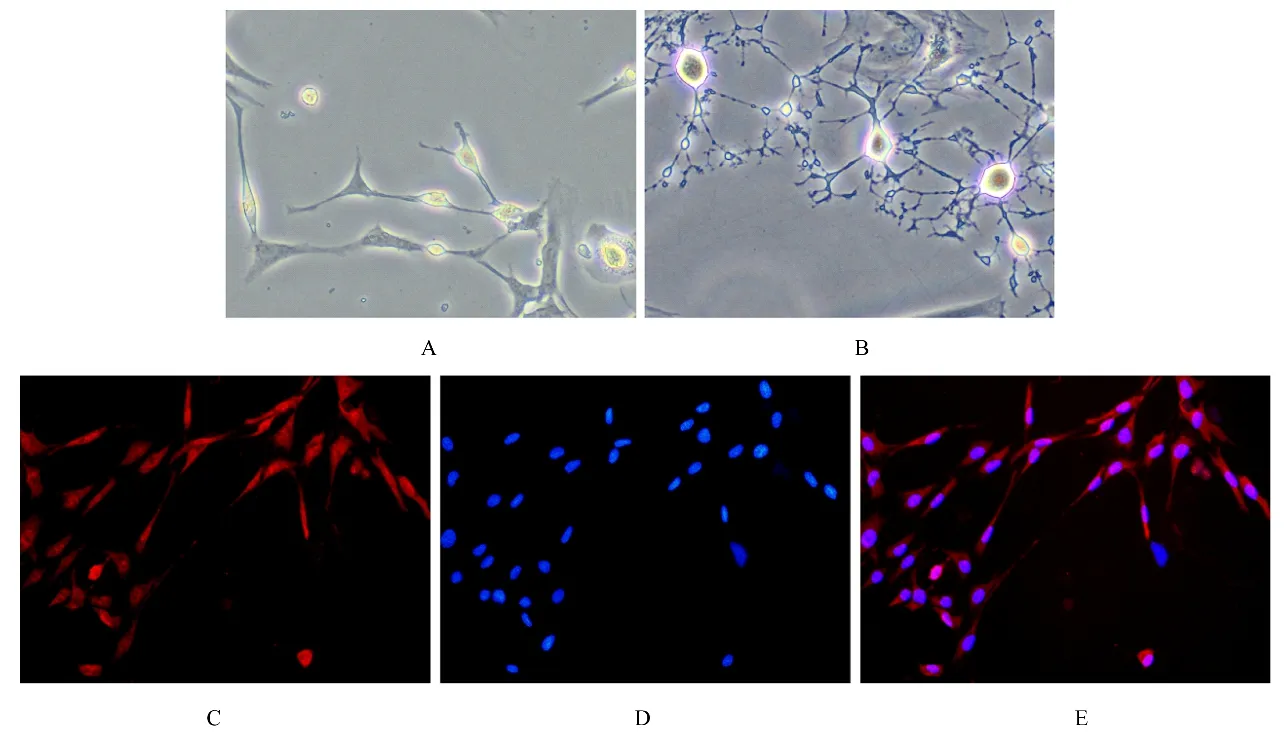
图2 SCLCs的形态表现和鉴定(×200)Fig.2 Morphology and identification of SCLCs(×200)
2.3 DRG细胞形态表现和Neu N蛋白免疫组织化学染色情况原代培养DRG细胞24 h,倒置显微镜下可见部分细胞已贴壁,DRG细胞数较多、成纤维细胞较少,并且DRG细胞胞体周围可见光环,成纤维细胞无此现象(图3A)。48 h后DRG细胞胞体变大,突起变长,排列不规则(图3B)。培养72 h后DRG细胞突起变得细而长,且细胞突起之间形成连接,呈花环样排列(图3C)。7~8 d时,细胞状态良好,细胞数量进一步增加,胞体较大,呈圆形,突起细长,类似树枝状伸出,细胞突起之间相互连接更为紧密,似栅栏样(图3D)。NeuN是成熟神经细胞特异性的标志物,本研究采用免疫组织化学染色对获得细胞进行NeuN染色,结果显示几乎所有细胞核均被标记为棕褐色(图3E~3G)。

图3 DRG细胞形态表现和Neu N蛋白免疫组织化学染色情况Fig.3 Morphology of DRG cells and immunohistochemical staining of NeuN protein in DRG cells
2.4 2组DRG细胞数和DRG细胞突起数单培养组平均每个视野下可见(20.220±3.962)个细胞,共培养组平均每个视野下可见(105.600±10.550)个细胞,共培养组DRG细胞数明显多于单培养组(P<0.05);高倍镜下观察结果显示:共培养组DRG细胞突起数(3.200个±0.374个)明显多于单培养组(1.800个±0.200个)(P<0.05),而且突起呈细长状,彼此之间相互连接,形似花环状排列。见图4。

图4 HE染色观察2组DRG细胞的形态表现Fig.4 Morphology of DRG cells in two groups observed by HE staining
2.5 2组DRG细胞中NGF蛋白表达水平免疫组织化学检测可见NGF蛋白免疫阳性产物主要位于细胞质,为棕褐色产物,细胞核不着色,见图5。Western blotting法半定量分析结果显示:单培养组和共培养组DRG细胞中NGF蛋白表达水平分别为(0.193 3±0.010 6)和(0.716 5±0.003 9)。与单培养组比较,共培养组DRG细胞中NGF蛋白表达水平明显升高(P<0.05),见图6。
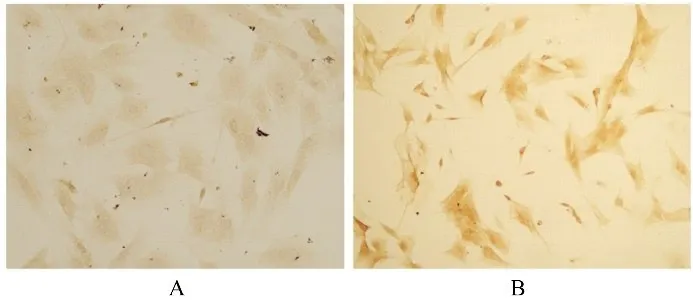
图5 免疫组织化学染色检测2组DRG细胞中NGF蛋白表达情况(×200)Fig.5 Expressions of NGF protein in DRG cells in two groups detected by immunohistochemical staining(×200)

图6 Western blotting法检测2组DRG细胞中NGF蛋白表达电泳图Fig.6 Electrophoregram of expressions of NGF protein in DRG cells in two groups detected by Western blotting method
3 讨 论
神经纤维离断会导致与之相连的神经元胞体损伤,进而发生崩解和破坏等一系列反应,称之为溃变。DRG细胞作为初级感觉神经元,是连接外周神经纤维与中枢的中继站。研究[12]显示:PNI可导致DRG细胞胞体肿胀、胞核偏位或者移位、细胞数减少,进而使神经细胞之间的连接发生紊乱,引起感觉功能障碍。因此,探讨促进DRG细胞生长的因素在PNI后再生修复中意义重大。本研究采用直接接触式共培养的方法建立SCLCs与DRG细胞共培养体系。本研究结果显示:在共培养条件下,DRG细胞数及其突起数明显增加,说明SCLCs促进了DRG细胞的生长,这对周围神经损伤后的感觉功能恢复具有极大的促进作用。杨雨洁等[13]研究显示:腹腔注射嗅鞘细胞培养上清液,可增加大鼠DRG细胞神经轴突数并提高髓鞘化能力,进而促进坐骨神经的再生。李文辉等[14]观察到内皮祖细胞可增加DRG细胞突起数、最长突起长度及平均突起长度,下调Nogo-A和NgR的表达,促进DRG细胞突起生长。本研究所采用的SCLCs是ADSCs在多因子的联合诱导下分化获得,其不仅具有ADSCs所具备的来源广泛、取材简单和增殖能力强的特点,还能充分发挥SCs促进神经修复再生的作用,如可通过趋化作用引导生长锥生长和通过分泌神经营养因子为神经再生创造微环境等[15]。研究[7]显示:SCLCs可增加坐骨神经损伤大鼠脊髓内脑源性神经营养因子、睫状神经营养因子和NGF蛋白的表达,抑制JAK2/STAT 3信号通路的活化,进而发挥促进损伤神经再生的作用。任旺等[16]研究显示:SCLCs可增加DRG细胞数及其突起数和长度,提高细胞中BDNF蛋白的表达。
NGF兼有神经营养因子和神经生长因子的双重作用,在周围神经的损伤修复中具有促进SCs增殖、引导轴突定向生长和保护神经细胞等作用[17-18]。LI等[19]研究结果显示:NGF可通过激活SCs自噬,增强清除髓鞘碎片的能力,起到加速早期神经再生的作用。LIAO等[20]通过动物实验发现:填充NGF硅橡胶管的实验组其神经传导速度明显升高,潜伏期明显缩短,神经再生的组织形态学均优于对照组。SANG等[21]在坐骨神经损伤模型研究中发现:姜黄素可刺激NGF的释放,NGF可进一步激活Trk A和PI3K/Akt细胞存活信号通路,发挥对损伤神经细胞的保护作用。本研究结果显示:共培养组DRG细胞中NGF蛋白表达水平明显高于单培养组。因NGF具有促进感觉神经元生长和存活的功能,因此推测SCLCs促进DRG细胞生长的作用可能与共培养组DRG细胞中增加的NGF蛋白有关。有研究[22]显示:NGF还可以促进SCs的分裂增殖,SCs则会进一步分泌神经营养因子,从而形成促进神经再生的正反馈环路。另一方面,NGF可减少DRG细胞体肿胀和胞核移位或偏位等保护DRG细胞不受或少受损伤,使其维持在正常的功能状态,有利于DRG细胞的生长。本课题组前期研究结果还证实:SCLCs可增加DRG细胞中BDNF蛋白的表达,但表达升高的NGF和BDNF是否来自于SCLCs及两者通过何种信号转导机制促进DRG细胞增殖的尚需进一步研究。

