基于网络药理学探讨人参治疗房颤的作用机制
阚晨静,高磊,陈昕,徐盛松,3,石开虎※
(1.南京中医药大学附属中西医结合医院心胸外科,江苏 南京 210028;2.江苏省中医药研究院,江苏 南京 210028;3.安徽医科大学第二附属医院心胸外科,安徽 合肥 230601)
房颤,是临床中最为常见的心律失常,其发病率随年龄的增长而增长。随着人口老龄化及其危险因素趋势的上升,心房颤动的发病率预计在未来会大幅增长[1]。房颤临床表现为心悸、眩晕、胸部不适及气短等症状,根据《中西医结合内科学》可将其归为“心悸”范畴[2],而根据中国中医药学会中医诊断专业委员会的规定,此病在中医学上归属于“心动悸”范畴。心悸、心动悸的名称最早是在汉代张仲景《伤寒杂病论》中提出[3],其病因是由诸种原因使心脏气机紊乱,心动异常,临床表现为以阵发心悸、胸闷、气短。
人参为五加科植物人参(Panax ginseng C.A.Mey.)的干燥根、根茎。人参的药用历史有上千年,其抗心律失常的药理作用显著,且毒副作用少,临床应用广泛[4]。目前主要用于临床治疗房颤的中药方剂中,炙甘草汤、生脉散中均含有人参[5],生脉散更是以人参为君药,而在国家中医药管理局发布的《房颤的分级诊疗技术方案》中推荐的安神定志丸也是以人参为君药,此外临床运用治疗房颤的中成药参松养心胶囊、生脉注射液等的主要成分也含有人参,可见人参在房颤的治疗中起到重要作用,但人参治疗房颤的具体作用机制尚不明确。
本研究基于网络药理学,从多向药理学进一步拓展分析人参对房颤的治疗作用靶点以及重要的信号通路,阐明人参在房颤中的作用机制,为后续临床以及基础研究提供一定的思路和依据。
1 资料与方法
1.1 人参的主要成分及靶点预测
登录中药系统药理学数据库(TCMSP, http://tcmspw.com/tcmsp.php)[6],以人参为关键词进行检索,获得人参所有的化学成分,包括化学成分的名字(moleclue name)、生物利用度(OB)和类药性(DL)等信息。结合文献研究,将OB≥30%、DL≥0.18 作为条件,筛选人参的潜在有效成分,并检索所有成分的靶点,利用Uniprot 数据库(http://www.uniprot.org/)[7]将人参的有效靶点与人类相关基因相对应,获得人参潜在靶点;使用BATMAN-TCM(http://bionet.ncpsb.org/batmantcm/)[8]平台来预测人参的成分及其潜在作用靶标。将两个数据库所得结果进行整合筛选,得到人参的潜在作用靶点。
1.2 房颤疾病靶点预测
通过在DrugBank(https://go.drugbank.com)[9]、OMIM(https://omim.org/)[10]、DisGene(thttps://www.disge net.org/)[11]、TTD(http://db.idrblab.net/ttd/)[12]和GeneCards(https://www.genecards.org/)[13]数据库中进行疾病靶点的检索,均以“Atrial Fibrillation”为关键词查找筛选与房颤相关的基因。
1.3 药物成分 疾病靶点网络构建与分析
将人参的靶点和房颤靶点导入在线作图软件Hiplot(https://hiplot.com.cn)绘制比例韦恩图,取得的交集靶点,即为人参治疗房颤的潜在靶点。筛选整合交集靶点及对应人参成分,将结果导入Cytoscape 3.7.1,得到人参成分 房颤靶点网络。
1.4 潜在靶点蛋白互作(PPI)网络构建
将药物 疾病交集靶点导入STRING(https://www.string-db.org/)[14]数据库进行蛋白质相互作用(PPI)分析,得到人参作用于房颤的蛋白互作网络。
1.5 核心靶点筛选及其PPI网络构建
将所得PPI 信息导入Cytoscape 3.7.1,根据连接度(degree)、节点介度(Betweenness Centrality)、连接紧密度(Closeness Centrality)以及平均最短路径(Average Shortest Path Length)筛选出核心靶点,再进行可视化,得到人参作用于房颤的核心靶点蛋白互作网络。
1.6 GO功能分析和KEGG通路富集分析
将药物 疾病交集基因导入DAVID 6.8 数据库(https://david.ncifcrf.gov/)[15],设置Select Identifier 为“OFFICIAL_GENE_SYMBOL”、List Type 为“GeneList”进行GO 功能富集和KEGG 通路富集分析,从生物功能及信号通路角度分析人参房颤的作用机制。
2 结果
2.1 人参的潜在作用靶点
通过TCMSP 数据库收集到人参195 个化学成分,以OB≥30%、DL≥0.18 为条件,筛选人参的潜在有效成分22 个,通过Uniprot 数据库找到人类相关靶点107 个,含靶基因的有效成分17 个。
在BATMAN-TCM 数据库中输入人参的完整拼音,以P <0.05,Scorecutoff >40 为筛选条件进行检索,结果显示,人参的主要化学成分共293 个,其中155个化学成分具有潜在靶点,106 个成分具有Score cutoff>39 的靶点。通过BATMAN-TCM 数据库得到各成分对应的靶点基因,将所得靶点导入EXCEL 并进行排除重复、合并统计,得到人参所含化学成分涵盖靶点基因共439 个。
将TCMSP 和BATMAN-TCM 两个数据库收集到的靶点取并集,共收集到人参的靶基因共计507 个,含靶基因化学成分111 个。
2.2 药物成分 疾病靶点网络构建与分析
通过DrugBank、OMIM、DisGenet、TTD和GeneCards 这5 个数据库检索,共获取房颤靶标基因2 176个;通过韦恩图(图1)分析发现,药物人参与疾病房颤共有190 个交集基因,药物 疾病的基因映射率为37.5%,表明人参防治房颤存在确切作用靶点,对房颤的防治作用具有一定特异性。进一步手动筛选人参干预房颤靶点对应的成分,得到人参干预房颤的有效成分共94 个,见表1。将结果导入Cytoscape 3.7.1,以190个靶基因对应蛋白作为人参治疗房颤的靶点,建立人参成分 疾病靶点网络图。将靶基因设置为蓝色,人参成分设置为黄色,得到药物成分 疾病网络图,见图2。

图1 人参—房颤交集靶点韦恩图Fig.1 Venn diagram of ginseng atrial fibriliation intersection target

图2 药物成分 疾病靶点网络图Fig.2 Drug component disease target network diagram
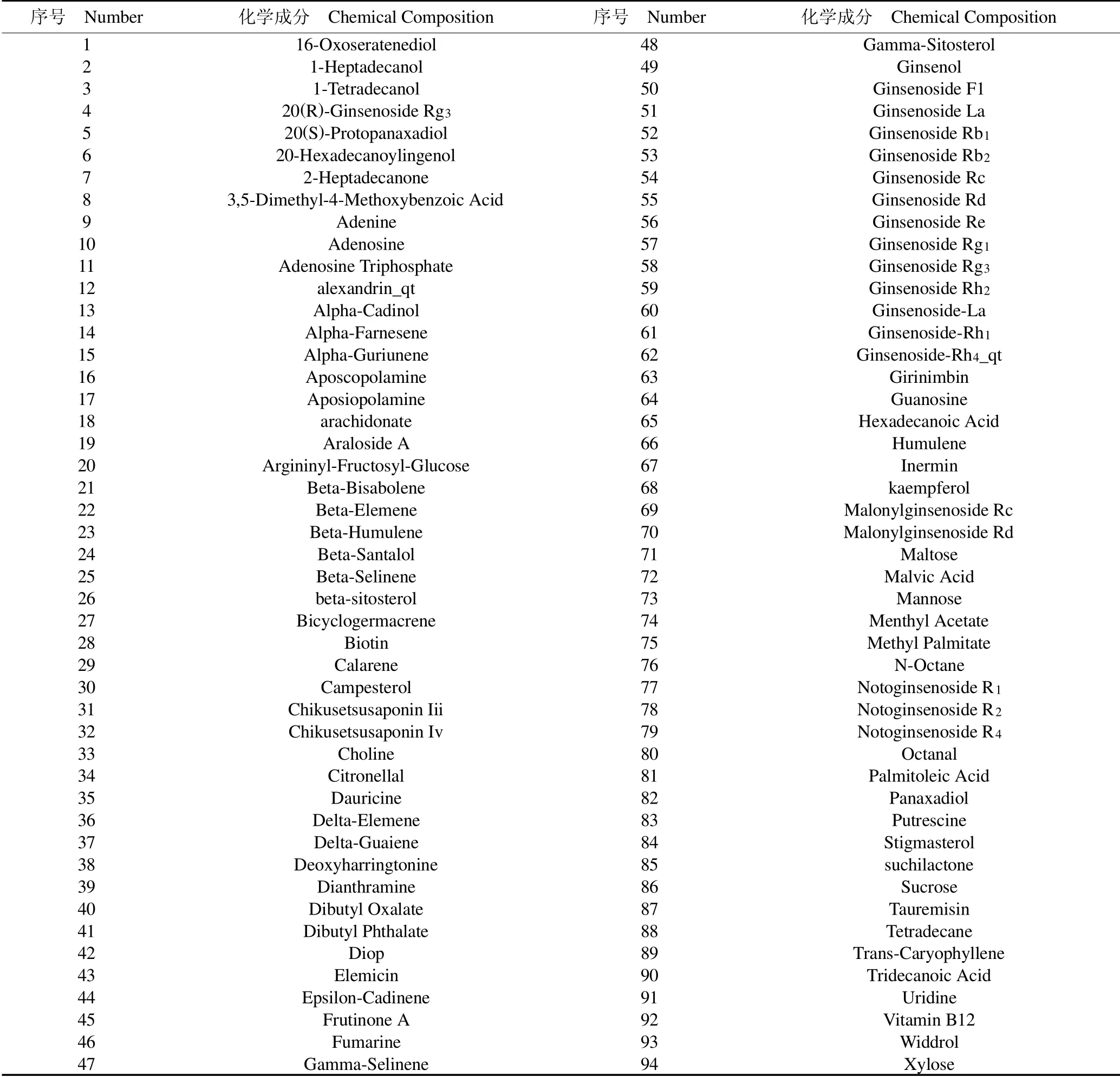
表1 含房颤靶基因的人参化学成分Table 1 Ginseng chemical constituents containing atrial fibrillation target genes
2.3 潜在靶蛋白相互作用网络构建
将药物 疾病交集基因编码蛋白导入STRING数据库,设置物种为“Homo sapiens",最低相互作用评分为高置信度“highconfidence(0.700)”,不显示网络中的单一节点,其余参数保持默认,获取蛋白互作关系,得到药物 疾病交集作用靶蛋白互作网络图(图3),图中节点表示蛋白,连线表示蛋白之间的关联,人参 房颤交集作用蛋白共涉及190 个节点,629 条连线。
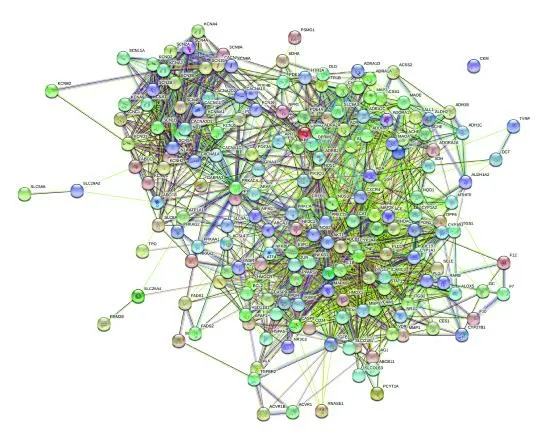
图3 人参治疗房颤潜在作用靶点PPI 网络图Fig.3 PPI network diagram of potential targets of ginseng in the treatment of atrial fibrillation
2.4 核心靶点筛选及其PPI网络构建
将所得PPI 信息导入Cytoscape 3.7.1,筛选出连接度(degree)值大于2 倍数均值(Degree >14.7)的靶点,再根据节点介度(Betweenness Centrality,BC)和连接紧密度(Closeness Centrality,CC)大于均值(BC>0.02,CC >0.329);平均最短路径(Average Shortest Path Length,ASPL)小于均值(ASPL<3.352)筛选得到15 个核心靶点,包括AKT1、TNF、MAPK8、PRKACA、JUN、IL1B 和CASP3 等,提取核心网络,如图4。图中橙色圆圈表示核心靶点,其半径越大表示该靶点的degree 值越大。
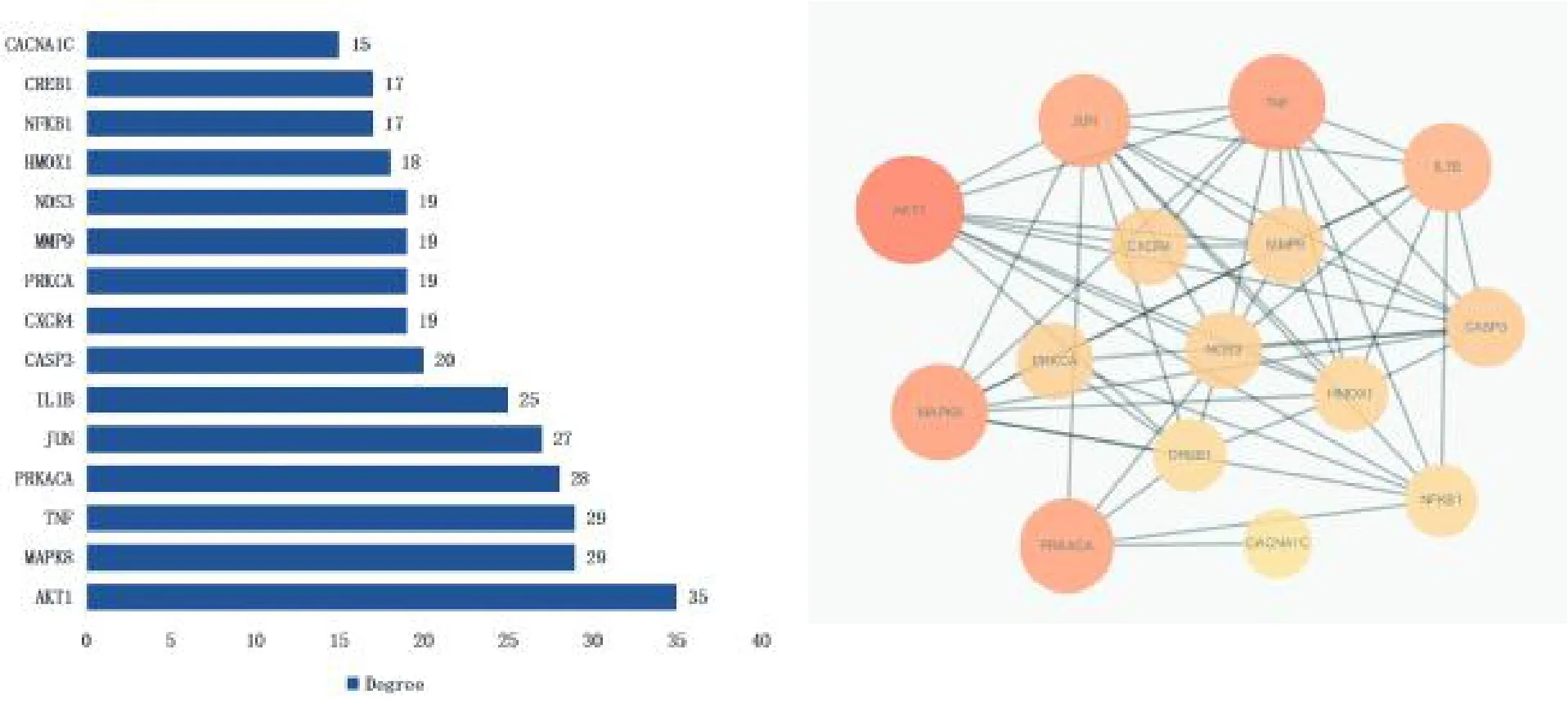
图4 人参治疗房颤核心靶点及PPI 网络Fig.4 Core targets and PPI network of ginseng in the treatment of atrial fibrillation
2.5 GO功能分析结果
对药物 疾病交集基因进行GO 功能分析,以P <0.05 为基准筛选,共获得681 个功能富集,根据P 值选取前10 的信息进行可视化。药物 疾病交集基因GO 功能分析提示,人参活性成分主要通过对药物的反应、调节离子跨膜转运、动作电位时膜去极化、突触后膜电位的调节、对缺氧的反应、衰老、钠离子跨膜转运、通过心脏传导调节心率、神经元动作电位和对脂多糖的反应等参与生物过程(Biological Processes)(图5)。
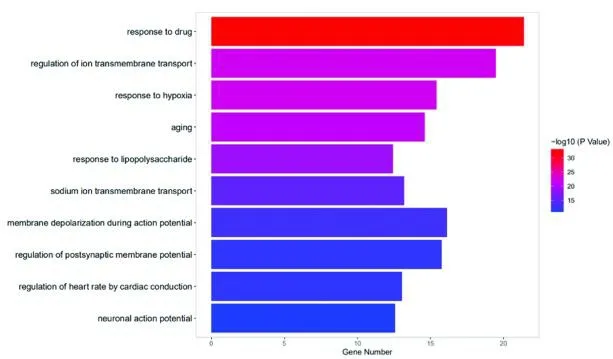
图5 人参治疗房颤的生物过程富集分析Fig.5 Biological Processes enrichment analysis of ginseng in the treatment of atrial fibrillation
在分子功能(Molecular Functions)方面(图6),主要涉及电压门控钠通道活性、酶结合、延迟整流钾通道活动、离子通道结合、药物结合、氧化还原酶活性、血红素结合、电压门控钾离子通道活性、黄素腺嘌呤二核苷酸(FAD)结合和支架蛋白结合等。

图6 人参治疗房颤分子功能富集分析Fig.6 Molecular Functions enrichment analysis of ginseng in the treatment of atrial fibrillation
在细胞组成(Cellular Components)方面(图7),主要和电压门控钠通道复合物、质膜、电压门控钾通道复合物、质膜的组成部分、质膜穴样内陷、横小管、电压门控钙通道复合物、肌膜炎、细胞膜膜筏和闰盘等相关。

图7 人参治疗房颤细胞组成富集分析Fig.7 Cellular Components enrichment analysis of ginseng in the treatment of atrial fibrillation
2.6 KEGG富集通路分析
KEGG通路富集分析中以P<0.05 为基准筛选,190 个交集靶点基因显著富集在129 条通路上。选取其中最有意义的20 条通路(表2)作可视化处理,见图8。由表2 可知,富集排名前20 的通路是cGMP-PKG信号通路、cAMP 信号通路、TNF 信号通路、心肌细胞肾上腺素信号转导、血清素能突触、乙型肝炎、多巴胺能突触、细胞凋亡、查加斯病、吗啡成瘾、肾素分泌、结核、钙信号通路、非酒精性脂肪肝病(NAFLD)、MAPK信号通路、胰岛素抵抗、弓形虫病、胆碱能突触、破骨细胞分化和催产素信号通路,提示人参通过作用以上多条通路发挥治疗房颤的作用。

图8 人参治疗房颤KEGG 通路富集分析Fig.8 KEGG pathway enrichment analysis of ginseng in the treatment of atrial fibrillation

表2 人参治疗房颤潜在靶点KEGG 分析(排名前20)Table 2 KEGG analysis of potential targets of ginseng in the treatment of atrial fibrillation (top 20)
3 讨论
房颤是临床中最为常见的心律失常,其机制主要分为电生理机制和病理生理学机制,病理生理学机制主要涵盖电重构、收缩性重构、结构重构、炎症、神经内分泌和自主神经系统等方面的学说。人参作为中国传统中药,主要功效为大补元气、复脉固脱、补脾益肺、生津和安神等。现代研究发现,人参抗心律失常的作用显著,毒副作用少,临床应用广泛[4]。韩志龙等[16]研究发现人参皂苷Rg1可通过抑制TNF- 、IL-1 等改善大鼠心肌缺血再灌注损伤后的心律失常。人参皂苷Re、Rg2、Rb1和Rd 可阻滞L-型钙离子通道电流,达到抑制心律失常的作用[17-20]。人参皂苷Re、Rb1 可增加Cx40、Cx43的表达,抑制心房缝隙链接的重塑[21,22]。
本研究发现,人参治疗AF主要涉及15 个核心靶点,488 个生理过程,65 种分子功能,125 个细胞组成以及128 条信号转导通路。结果显示,人参治疗房颤的主要作用可能与其调控离子通道、抑制炎症、调控细胞凋亡和抑制心肌纤维化与心脏重塑和调节自主神经有关。
3.1 调控离子通道
房颤的发病机制与心肌细胞内的离子稳态与离子通道改变有关[23]。本研究发现,人参通过靶向PRKACA(环磷酸腺苷依赖性蛋白激酶A,cAMP-dependent PKA 的编码基因),并且参与调控cGMP-PKG 信号通路、cAMP信号通路、肾素分泌和心肌细胞肾上腺素信号转导通路等干预心肌细胞内的离子通道和离子电流。cGMP 为细胞内第二信使,在心肌细胞中,可通过调控蛋白激酶G(PKG)信号减少Ca2+释放,减轻钙超载[24]。cGMP 与cAMP 之间交叉调节,控制心肌细胞内的Ca2+流。研究表明,cAMP 激活PKA,可调控L-型钙通道开放,增加Ca2+内流[25],还能通过RYR2 磷酸化进而调节钙离子通道[26],参与房颤。肾素 血管紧张素 醛固酮系统(renin-angiotensinaldosterone system,RAAS)的激活对于房颤的发生发展有重要作用。RAAS的激活可增加心房肌中的L-型钙通道的密度[27],改变离子通道。人参可能通过靶向上述蛋白,参与上述信号通路,来维持心肌细胞内的Ca2+、K+稳态和离子通道,从而对房颤产生有益作用。
3.2 抑制炎症
在房颤的发生和维持过程中,炎症密切参与了其病理生理过程[28]。研究表明,房颤与TNF- 、IL-1 等炎症因子有一定相关性,可诱导胶原过表达,影响胶原代谢,进而发生心肌纤维化,促进心脏的结构重构[29,30],并且在房颤患者的心肌组织中高表达[31,32]。IL-1 还能通过激活基质金属蛋白酶(matrix metalloproteinases,MMPs)调节金属蛋白酶组织抑制因子(tissue inhibitor of metal protease, TIMPs)的活性,上调心肌中血管紧张素Ⅱ受体AT1 来促进心脏结构重构,导致房颤[33,34]。作为炎症启动因子的TNF- 和IL-1 ,还能够刺激C-反应蛋白(C-reactive protein, CRP)的合成,继而通过破坏心房肌细胞膜结构和炎症细胞浸润等途径导致房颤[35]。另外,TNF- 可调节心房细胞内钙释放、心房神经丛,从而升高房颤触发几率,降低房颤阈值[36,37]。IL-1 可激活右前心房神经丛,从而诱导房颤的发生[38]。可见,人参可以通过抑制炎症,推测其通过抑制IL-1 、TNF 信号通路和产生抗炎作用来影响房颤。
3.3 调控细胞凋亡
发生房颤时,心脏组织中的细胞凋亡增加[39],细胞凋亡与房颤密切相关[40]。心肌细胞发生凋亡时,有效心肌细胞减少,心肌限制纤维化增多,造成心脏的收缩功能降低和纤维化成分的增加,从而促进心脏的结构重构,参与房颤的心脏结构和功能的改变[41]。研究表明在风湿性心脏病合并永久房颤患者的右心房组织中细胞凋亡及其关键酶Caspase-3 表达增加,提示Caspase-3 在房颤发病中起重要作用[42]。人参可能通过靶向Caspase-3 和凋亡信号通路来调控心肌细胞的凋亡,从而发挥其抗房颤的功能。
3.4 抑制心肌纤维化与心脏重塑
心脏的结构重构包括组织结构变化和细胞水平的结构变化。组织结构的变化可直接影响传导,主要包括心肌肥厚、心肌纤维化和脂肪浸润等。纤维化引起细胞外基质(ECM)代谢失调,胶原表达增多,造成心肌细胞之间的传导延迟,使房颤更易维持[43]。缝隙连接是心肌细胞之间的主要连接方式,可维持正常的电偶联,相关蛋白为连接蛋白(Conneixn,Cx)43 和Cx40。心肌纤维化会造成缝隙连接的重构,进而发生房颤[44]。产生ECM 的细胞为心肌成纤维细胞,通过调节MMPs及其抑制剂TIMPs的平衡来促进心肌纤维化[45]。AKT1是蛋白激酶B,即AKT 基因家族成员之一,为PI3K的下游关键靶点,参与细胞活力和增殖的控制,抑制细胞凋亡和促进细胞周期进展,与心血管疾病密切相关[46]。周琳[47]研究发现房颤患者心肌组织中的AKT、Gsk3较窦律组表达更高,提示AKT 参与了瓣膜病房颤的发生。AKT 的磷酸化可升高Cx43 的表达,降低恶性心律失常的发生率[48];MAPK8 编码的JNK1 为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员之一,又称为c-JUN N 端激酶,可使JUN 编码的c-Jun 磷酸化。研究表明,JNK 可通过增强c-Jun 与Cx43 启动子的结合,来减少Cx43 的表达,从而发生房颤[49];研究表明,MAPK通路调控心肌成纤维细胞的增殖和迁移,影响胶原表达,靶向MAPK通路可减轻大鼠房颤[50];作为炎症因子的IL-1 也可以通过激活MMPs,调节TIMPs 的活性,上调心肌中血管紧张素Ⅱ受体AT1 来促进心脏结构重构,导致房颤[34,35]。因此,人参可通过靶向AKT1、MAPK8、IL1B以及MAPK 通路抑制心肌纤维化与心脏重塑,从而抵抗房颤。
3.5 调节自主神经
长期的快速心房刺激可使心房肾上腺素能神经纤维密度增加,产生交感神经重构,影响心房的电生理活动[51]。因此,人参可能通过心肌细胞肾上腺素信号转导重构交感神经丛而干预房颤。
综上所述,人参可能通过作用AKT1、TNF、MAPK8、PRKACA、JUN、IL1B 和CASP3 等相关靶点调节cGMP-PKG 信号通路、cAMP 信号通路、TNF 信号通路、心肌细胞肾上腺素信号转导、细胞凋亡、肾素分泌、钙信号通路及MAPK 信号通路等多条AF 相关通路,通过调控多种离子通道、抑制炎症与细胞凋亡、抑制心肌纤维化与心脏重塑以及调节自主神经等多个方面以发挥治疗AF 的作用。本研究基于网络药理学探讨人参治疗AF 的作用机制,体现了中药多成分、多靶点及多通路的特点,可为进一步开展细胞和动物等试验提供理论依据。

