绝经后乳腺癌芳香化酶抑制剂治疗对骨微结构损害导致骨质疏松性椎体骨折1例*
姜艳 金晨曦② 夏维波
患者女性,61岁,因腰背酸痛1年于2019年11月就诊北京协和医院。患者5年前行左乳腺癌改良根治术,病理为乳腺导管内癌,伴间质浸润,淋巴结转移。免疫组织化学法检测显示,Erα为15%(中阳),ERβ为40%(弱阳),PR 为20%(弱阳),HER-2阳性(1+),p53阴性,Ki-67 为40%。术后行放化疗,持续来曲唑治疗至今,病情稳定。1年来自觉腰背酸痛,休息后可缓解,否认发生骨折。患者46岁绝经,否认骨折家族史。体格检查:身高为169 cm,体质量为63 kg,脊柱无畸形或压痛。化验血、尿常规、肝肾功能、血钙、磷、碱性磷酸酶和甲状旁腺素水平正常,血清1型原胶原C-端前肽71.0 ng/mL(正常15.1~58.6 ng/mL),血清1型胶原交联C-末端肽0.57 ng/mL(正常0.21~0.44 ng/mL)。双能X线骨密度测定仪(dual energy Xray absorptiometry,DXA)测量腰椎2~4、股骨颈和全髋骨密度分别为1.035、0.874 和0.931 g/cm2、T值分别为-0.8、-0.3和-0.2,Z值分别为0.1、0 和0.6。胸椎和腰椎侧位X线检查显示,第2腰椎楔形变(图1)。全身骨显像检查未见骨转移征象。高分辨外周定量CT(high-resolution peripheral quantitative CT,HRpQCT)测量患者胫骨和桡骨远端的骨微结构见表1。临床诊断为骨质疏松症,骨质疏松性椎体骨折。给予骨化三醇和钙剂口服,唑来膦酸静脉输液,患者腰背疼痛减轻。
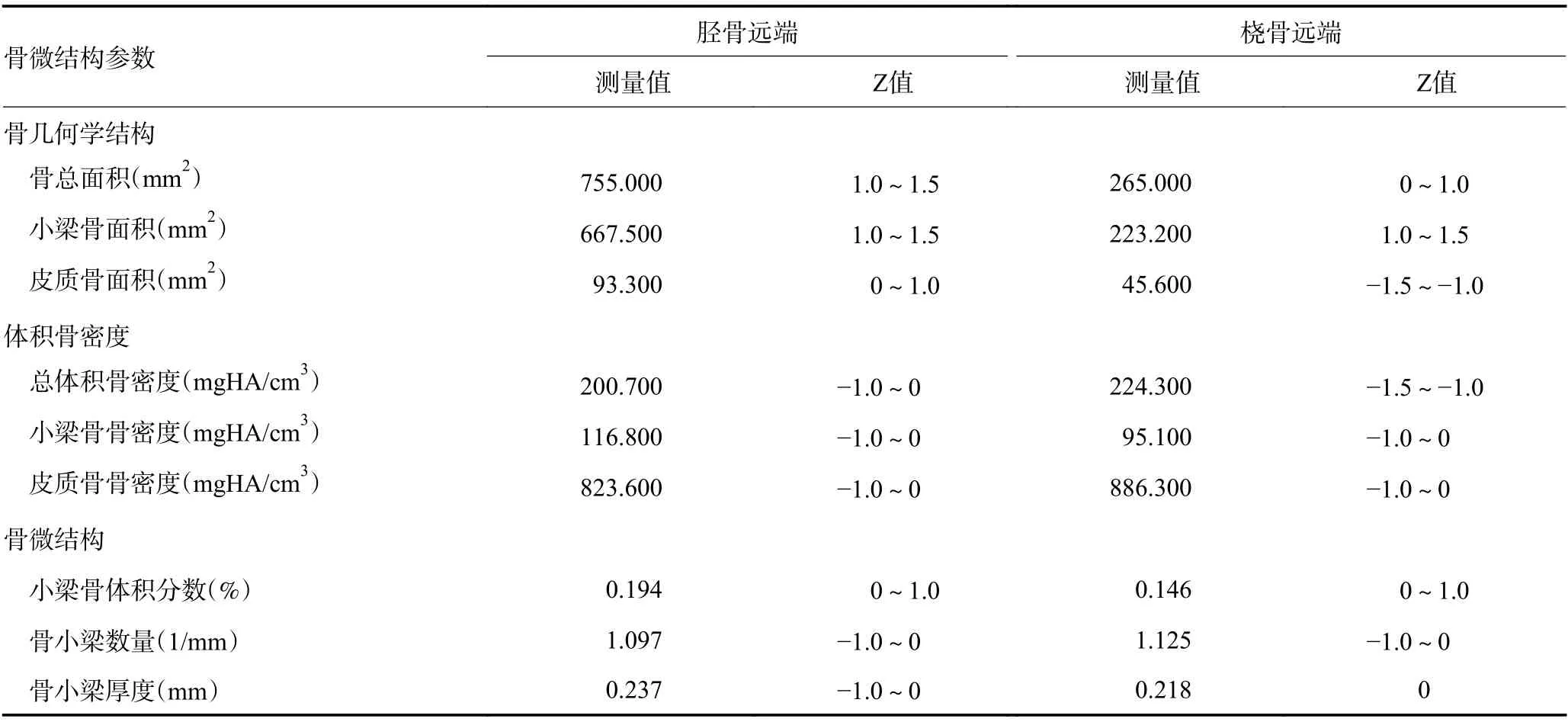
表1 HR-pQCT测定胫骨和桡骨远端的骨微结构的参数
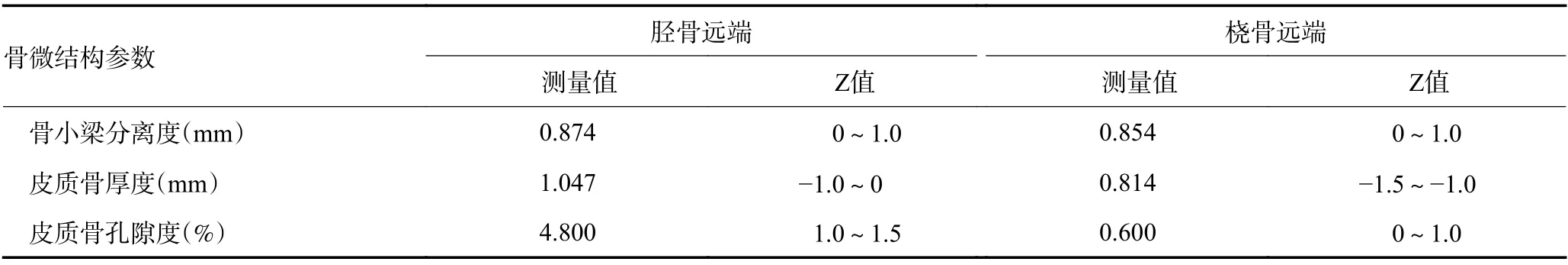
表1 HR-pQCT测定胫骨和桡骨远端的骨微结构的参数 (续表1)
小结绝经后乳腺癌芳香化酶抑制剂(aromatase inhibitors,AI)治疗能明显提高激素受体阳性乳腺癌患者的生存率,是公认的乳腺癌辅助内分泌治疗方案。但AI治疗加速骨量丢失,显著增加骨质疏松和骨折风险[1]。
DXA骨密度是目前骨质疏松症诊断的通用标准,不足之处是结果易受到骨质增生等干扰。而HRpQCT分别测量胫骨和桡骨远端的总体积骨密度、皮质骨面积和皮质骨厚度,可有效避免多种影响因素。本例是对乳腺癌AI治疗后HR-pQCT骨微结构的国内报道,结果显示患者DXA骨密度仍在正常水平,但HR-pQCT桡骨远端的总体积骨密度、皮质骨面积和皮质骨厚度已较正常[2]下降,提示AI治疗后骨微结构损害早于DXA骨密度下降。另外,本例患者虽DXA骨密度不低,但出现腰背疼痛,X线检查发现第2腰椎楔形变。鉴于患者无外伤史,骨显像无骨转移,诊断为骨质疏松性椎体骨折,需要积极抗骨质疏松治疗。因此,乳腺癌AI治疗患者在定期检测骨密度之外,还需行胸腰椎侧位X线检查,进行椎体骨折评估(vertebral fracture assessment,VFA)[3],有助于早期发现椎体骨折。
本例是对绝经后乳腺癌AI治疗致骨微结构损害、骨质疏松性椎体骨折的报道,乳腺癌AI治疗患者应加强骨密度、骨微结构和椎体骨折的综合评估,早期识别骨折风险,积极开展抗骨质疏松治疗。

