骨朗格汉斯组织细胞增生症诊断难点分析
牟东云 张艳金 杨舟 高峰
朗格汉斯组织细胞增生症(Langerhans cell histiocytosis,LCH)是一种起源于骨髓树突状前体细胞的罕见造血系统肿瘤[1]。该病以小儿多见,男性多于女性,临床表现复杂多样,治疗后易复发,不乏见到广泛播散致死的病例报道[2-3]。WHO(2017版)造血与淋巴组织肿瘤分类中,将LCH非特异型、孤立型骨病变、多灶型骨病变生物学行为定义为1(良恶性未定),播散型生物学行为定义为3(恶性)[4]。由于该病少见,临床表现多样,临床医生对其缺乏系统性认识,容易导致漏诊、误诊和误治[5],增加疾病复发、播散及致死的风险。
骨骼(bone)是该病最常见的发病部位[6],提高骨朗格汉斯组织细胞增生症(bone Langerhans cell histiocytosis,BLCH)的诊断率对该病的早诊断早治疗、防止其复发和扩散至关重要。目前,有关BLCH诊断现状,诊断难点,如何提高该病的诊断率,国内外均缺乏客观数据和系统性分析。本研究旨在通过对上海市第一人民医院的BLCH病例统计分析临床、影像和病理的诊断情况,对未诊断病例和疑难病例逐例分析,总结归纳诊断中的难点及应对策略,以便加深对该病的认识,提高该病诊断率。
1 材料与方法
1.1 临床资料
收集2014年1月至2020年12月经上海市第一人民医院病理明确诊断为BLCH的临床病例资料,经两名主任医师复片审核。排除标准:1)门诊院外会诊病例;2)仅有穿刺活检标本者;3)非骨骼受累病例(骨骼受累的多系统受累病例不排除);4)同一患者既有冰冻又有常规石蜡报告、多部位和(或)多次就诊不作为重复病例讨论;5)无免疫组织化学结果支持的病例;6)临床及影像学资料不完整的病例。最终收集到BLCH病例30例,BLCH占同期所有LCH的比例为77%(30/39),男女比例为1.5∶1.0(18∶12),发病年龄为1~60岁,平均发病年龄22.6岁,中位发病年龄13岁,年龄≤14岁者占53.3%(16/30)。临床分类为骨骼单系统受累26例,占比87%(26/30),其中单病灶16例,多病灶10例。含骨骼病变的多系统受累病例4例(肱骨和肺受累1例,额骨和肺受累1例,胸椎、肋骨、颅骨、下丘脑和纵隔淋巴结受累1例,椎体和胃受累1例)。
1.2 方法
本组病例收集以病理确诊为准,收集患者的性别、年龄、发病部位、临床表现、临床诊断、影像诊断、病理诊断,然后对比分析诊断病例和未诊断病例。病理诊断通过查找底单和再次复片模拟诊断过程(两名主治医师诊断)。根据病历资料、HE可直接诊断,免疫组织化学法验证的视为初次诊断的普通病例;根据病历资料、HE可纳入鉴别诊断,根据免疫组织化学法确诊的视为再次诊断的困难病例;初次诊断、再次诊断失误,需要通过上级会诊或疑难病例讨论,进一步行免疫组织化学法确诊的,视为三次诊断的特困难病例。临床分类参照2009年国际组织细胞协会发布《郎格罕细胞组织细胞增生症评估与治疗指南》[7]。根据病变范围分为:1)单系统LCH:有1个脏器或系统受累(单病灶或多病灶);2)多系统LCH:有≥2个脏器/系统受累,伴或不伴危险器官(肝、脾、骨髓)受累[6]。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。 计数资料采用频数、构成比、率表示。以 P<0.05为差异具有统计学意义。
2 结果
2.1 临床表现及诊断
临床表现:患者常无明显诱因发现肿块,伴疼痛不适或压痛就诊,部分患者当肿块增大或疼痛逐渐加重时就诊,2例患者疼痛伴活动受限、肢体麻木无力甚至不能翻身行走时就诊。椎体病变患者疼痛性质多为阵发性钝痛,间歇性发作,久站及劳累后明显,平卧休息可减轻。1例累及下丘脑的多系统受累患者以多尿、烦渴1年、男性勃起功能障碍而就诊。1例眼眶病变患者患侧面部眼眶至嘴角疼痛呈持续性伴麻木及张口困难。本组患者从开始发病到就诊时间为10天至2年不等,平均就诊时间为4.6个月。除1例多处胸椎受累的患者为第三次复发外(2010年左股骨骨质破坏行手术治疗、2018年右肩胛骨骨质破坏行手术治疗),其余均为首发。所有病例骨骼受累部位统计情况如下:颅骨9处(枕骨3、额骨2、颞骨1、顶骨2、颅内颞下窝1);躯干骨15处(胸椎6、腰椎3、骶骨3、肋骨2、颈椎1);四肢骨18处(髂骨6、股骨5、锁骨4、肩胛骨1、桡骨1、肱骨1);本组病例以颅骨和脊柱多见,脊柱略多于颅骨,其次是髂骨、股骨、锁骨等。
临床诊断:根据临床表现直接诊断B-LCH有2例,1例为多系统受累病例,另1例为复发病例,诊断率为7%(表1)。
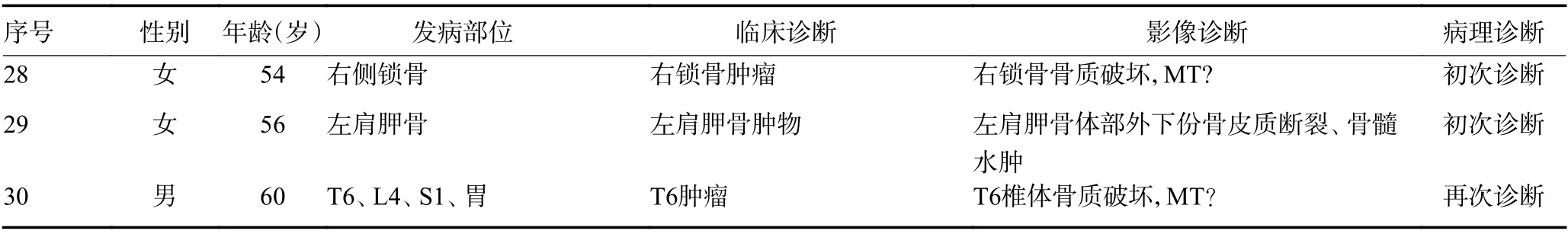
表1 30例骨朗格汉斯组织细胞增生症诊断情况 (续表1)
2.2 影像学表现及诊断
影像学表现:1例B超显示混合性回声团块。X线检查6例,3例提示低密度占位,2例提示骨质破坏(1例伴病理性骨折),1例提示椎体变扁。CT扫描21例,其中8例行三维重建:19例显示骨质破坏,表现为溶骨性(3例)、膨胀性(1例)、偏心性(1例),斑片状、不规则骨质破坏等,病变内可见小斑片状高密度影(3例),可见细小骨嵴影(1例),可密度均匀(1例)。颅骨病变多呈类圆性、穿凿样破坏;椎体病变椎间隙可正常,椎体变扁。骨质破坏边缘多清晰锐利,可有或无骨膜反应和硬化边缘。19例骨质破坏中伴软组织肿块15例,另4例为单纯骨质破坏。软组织病灶最大的1例最大截面约85 mm×49 mm(以左侧髂骨为中心),CT值约为44 (颞下窝内)-54 HU(椎体周围),边界多不清楚。增强时可呈明显不均匀强化,内可见大片强化减低区。MRI检查20例:肿瘤T1WI为等信号-稍低-低信号;T2WI为稍高-高信号,1例显示高低混杂信号;DWI呈高或稍高信号;STIR可呈等-稍高信号;FLAIR可呈混杂信号。增强均可见明显不均匀强化,1例为中度强化。另可见病灶边缘模糊、周围骨髓模糊强化、硬脑膜增厚、硬膜囊及脊髓受压、椎管狭窄等表现。1例多系统中枢受累的患者显示垂体柄增粗且有强化。PET-CT检查3例:骨骼病变部位均显示FDG(氟-18标记的葡萄糖)高代谢,其中1例还发现胃壁局部、T6、S1局部FDG代谢异常增高。
影像诊断:本组病例影像学诊断均考虑到占位或肿瘤,8例考虑诊断BLCH,(CT诊断4例、MRI诊断3例、PET-CT诊断1例),诊断率为27%(8/30)。无法与其他疾病相鉴别的病例数12例:1例考虑肿瘤或结核,9例考虑恶性病变(1例骨肉瘤、3例尤文肉瘤、1例考虑感染),2例考虑偏良性病变(1例骨巨细胞瘤、1例骨母细胞瘤)。未明确诊断病例数10例。
2.3 病理学表现及诊断
病理表现:本组病理标本包括穿刺活检、病灶刮除或肿瘤扩大切除标本。肉眼:穿刺和病灶刮除标本大多呈灰白灰黄暗红碎组织一堆,质软或质韧,含碎骨组织;肿瘤扩大切除标本大多为骨样组织一块,中央可见暗红病灶,1例隆起骨片1 cm并穿透骨皮质,3例切面可见囊腔形成,内容物灰黄灰红,质软或质韧,可脱出,个别可见碎骨片。镜下:均可见骨组织破坏,骨小梁间肿瘤细胞弥漫或成片分布,形态温和(或)轻度异型,细胞边界较清(5例可见微绒毛)或不清,胞浆丰富嗜酸性,细胞核呈圆形、卵圆形或咖啡豆样,染色质细腻,可查见核沟,病理性核分裂像罕见。所有病例均有多少不等的嗜酸性粒细胞浸润,部分病例可见多少不等的多核巨细胞(9/30)、泡沫细胞(5/30),个别病例以淋巴细胞、浆细胞或中性粒细胞浸润为主,间质血管及纤维组织可反应性增生。3例伴有坏死,1例有灶性胆固醇结晶。免疫组织化学检测:肿瘤细胞阳性表达及表达率:CDlα(30/30)、Langerin(30/30)、S100(29/30)、CD68(26/30)、LCA(5/6)、CD4(7/8)、Vim(18/18)、CK(13/16)、P53(3/3)、Ki-67为1%~50%、均值15%(28/29)。其他肿瘤细胞阴性或间质细胞阳性免疫指标:CD3+(少数)、CD20+(少数)、CD38+(浆细胞)、CD138(-)。分子病理检查:4例行BRAFV600E基因检测,其中突变型1例(25%)。
病理诊断:本组病例收集以病理诊断为标准,故病理诊断最终确诊率为100%。通过查找底单和再次复片模拟诊断过程发现,病理初次诊断的普通病例18例(60%),包括临床或影像已考虑该病的10例;再次诊断的困难病例占33%(10/30);三次诊断的特困难病例占7%(2/30)。见图1。
3 讨论
BLCH是LCH最常见的一种类型,随着医疗技术的进步和人们认识的增强,诊断率越来越高,但对于缺乏诊断该病经验的医生来说,对该病的认知缺乏和诊断困难依然存在,因此需要不断总结经验,提高对该病的认识和诊断水平。
3.1 临床诊断难点及应对策略分析
本组BLCH占比、男女比例、发病年龄与既往研究基本相符[8],不同的是本组中无年龄>60岁的患者,有类似年龄范围在1~57岁(51例)、1~57岁(31例)的报道[9-10],而更高龄的患者比较少见[11],提示年龄>60岁患者更少见。关于好发部位,可累及全身骨骼,其中以颅骨、下颌骨、脊柱、肋骨和长干骨更常见[8]。本组病例亦累及多种骨骼,脊柱略多于颅骨,髂骨、股骨、锁骨亦相对多见。本组病例均以肿块伴疼痛就诊,发展相对缓慢。病例中有1例患者为第三次就诊,复发的周期有缩短。
由于该病较少见,且临床表现对诊断缺乏特异性,临床诊断多考虑占位,很难进一步明确占位性质及具体疾病,但本组仍有2例根据临床表现做出诊断。结合本组病例及国内外文献报道[1,10]的临床特征对诊断有以下提示意义:1)患者年龄<14岁;2)好发于颅骨、脊柱等骨组织;3)局部疼痛,疾病进展相对缓慢;4)累及其他系统,如累及垂体引起尿崩症等;5)复发病例。临床医生应增强对该病的认识,提高对该病的诊断意识,以降低误诊漏诊的风险。
3.2 影像诊断难点及应对策略分析
既往影像学文献报道BLCH多呈单发,表现为骨质破坏,大多呈溶骨性,常无边缘硬化或骨膜反应,伴/不伴软组织肿块影,周围骨髓水肿,邻近肌肉软组织水肿,部分可伴病理性骨折[12,13]。本组BLCH影像表现与之相似,但骨质破坏及软组织肿块影呈现出多样性的特点,如骨质破坏呈溶骨性、膨胀性、偏心性、不规则性均可,软组织肿块信号特点变化较大,这可能和病灶所处不同时期有关,研究显示,BLCH疾病进程分朗格汉斯细胞聚集期、肉芽肿期、退缩期[10]。疾病所处时期不同其影像表现亦有差异[14]。
本组病例中,即使是诊断病例,特异性也并不强,相对特异的表现为不规则溶骨性骨质破坏,边缘清楚,可有或无硬化边,破坏区内可见死骨。颅骨病变多呈类圆性、穿凿样破坏,有文献报道颅骨LCH起自板障,外板破坏大于内板,呈现出“梯形/斜面”的骨质破坏外观,肿瘤突破内外板继续生长,软组织肿块可呈“葫芦状”[15]。椎体病变椎间隙可正常,椎体变扁,称之为“扁平椎”、“钱币征”[13]。长骨多起于骨干髓腔内,骨质破坏边缘可有骨质硬化,可见层状骨膜反应,软组织肿块包绕骨质破坏区[10]。
未诊断病例影像表现多样,使该病与多种疾病影像相似。鉴别诊断包括以下方面:1)本组误诊疾病最多的是尤文氏肉瘤(3例),当骨质破坏呈溶骨性并侵犯软组织形成肿块影像特征时,如果患者为儿童,易考虑尤文氏肉瘤。如果发生在青少年,则可能考虑骨肉瘤。但尤文氏肉瘤溶骨性骨质破坏多呈边界不清的片状、筛孔状或虫蚀样,还可见葱皮样骨膜反应和针状骨向外侵犯软组织。骨肉瘤骨质破坏多呈溶骨性、成骨性或边缘不规则的混合性病变,软组织内可见特异性的肿瘤骨,还可见各种形态的骨膜新生骨和Codman三角。2)当不典型病例骨质破坏呈膨胀性,边缘清楚,内部有钙化或骨化时,如患者年龄为10~30岁,易考虑骨母细胞瘤。如以上征象加上“肥皂泡样”征象,发病年龄为20~45岁,还可能考虑为骨巨细胞瘤。但骨母细胞瘤多发生于长骨干骺端以及椎体附件,膨胀性骨质破坏常可分房显示“液液”平面。骨巨细胞瘤多为骨端的膨胀性、多房性、偏心性骨质破坏,骨性包壳明显,其内可见纤维骨嵴。3)当椎体骨质破坏骨组织部分硬化,未累及关节,周围软组织肿块性质不明时,需与结核病进行鉴别。结核病常有结合中毒症状和实验室证据,影像上结核病一般起自终板,常有沙粒状死骨形成和骨膜增生,椎旁见冷脓肿形成,内部液化坏死相对常见[16]。
总之,BLCH的影像诊断相对比较困难,需结合临床资料及影像特征综合细致分析,当考虑以上常见病诊断证据不充分时,应考虑到BLCH这种少见病的可能。另外,本组确诊的8例均采用CT三维重建、MRI或PET-CT检查,必要时完善以上检查,有利于提高该病的诊断率,降低漏诊误诊的风险。
3.3 病理诊断难点及应对策略分析
本病最终确诊依靠病理诊断,根据“指南”及新的研究应用进展[6-7,17],诊断标准为典型的郎格汉斯肿瘤细胞聚集,免疫组织化学染色CD1α 和Langerin阳性即可确诊。
通过对初次诊断病例分析得出,初次诊断病例主要为镜下典型病例和临床影像已确诊病例。典型病例只需免疫组织化学法检测证实CD1α、Langerin阳性即可确诊。临床影像已确诊病例虽病理诊断上也有不典型病例,但均能发现一些诊断线索,如小簇朗格汉斯样细胞散在、嗜酸性粒细胞浸润等,进一步行免疫组织化学法可确诊。本组临床-影像已考虑诊断该病的,病理初次确诊率100%,降低了病理诊断难度,降低了患者的病理检查费用,减少了潜在的误诊漏诊风险。
对于再次诊断的困难病例和三次诊断的特困难病例分析诊断困难原因及解决要点如下:1)送检标本少、零碎,加上大量炎细胞或组织烧灼,致有效诊断成分少,易导致漏诊。建议临床医生尽量保护肿瘤成分不被烧灼和过度钳夹,并将全部肿瘤组织送检;建议病理医生在取材时,活检标本应尽量全取,碎骨较多时,采用脱钙处理,不可因剔除骨组织造成诊断困难或漏诊;切片标本质量不佳影响诊断时,需采取病理重切、深切、再取等方法重新制片;可疑诊断病例可采取“不排除”,“可能”等描述性报告形式,必要时建议临床再取。2)炎症反应重,首先考虑淋巴组织相关性疾病,包括反应性增生病变和恶性淋巴瘤。具体考虑诊断如下:(1)急慢性骨髓炎:大量淋巴细胞或中性粒细胞浸润,未发现(初诊时)其他异常肿瘤成分时,易简单作为炎症考虑。但骨髓炎常有创伤病史,血沉、C反应蛋白、白细胞升高等改变;(2)木村病(Kimura’s disease):嗜酸性粒细胞浸润是B-LCH的一大重要特征,木村病也有此特征。后者血管及淋巴细胞增生更明显,组织细胞样细胞较少且CD1α阴性;(3)窦组织细胞增生伴巨大淋巴结病(Rosai-Dorfman disease):当有大量组织细胞增生时,需与Rosai-Dorfman病相鉴别,后者组织细胞无异型性,CD1α阴性,常有组织细胞内淋巴细胞“穿过现象”;(4)恶性淋巴瘤:大量淋巴细胞聚集,与淋巴瘤很相似,本组病例大部分抗原标记均是淋巴瘤相关性标记。淋巴瘤细胞表达T或B淋巴细胞标志物,不表达CD1α 和Langerin[18]。因此,当发现大量炎细胞浸润的情况,应仔细观察全部切片,不要遗漏可疑肿瘤成分,否则较易与淋巴瘤相混淆。3)易诊断为未分化癌:当病例的不典型细胞呈类上皮样时,病理医生往往会考虑到低分化的癌转移至骨,但癌多见于老年人,常常有病史,免疫组织化学法检测上皮性免疫标记阴性时可排除癌的诊断。4)诊断经验不足:由于该病发病率低,初检医生诊断意识及经验可能不足,需要加强对该病的认识。5)必要时行BRAF-V600E基因检测:研究发现在超过50%的儿童的LCH病变中检测到BRAF-V600E突变,突变型阳性不仅支持这一结果,也为靶向治疗提供了靶向诊断[18]。
综上,BLCH是一种发生于骨的罕见造血系统组织细胞类肿瘤。临床、影像、病理诊断均有难度,各科的诊断医生需提高对该病的认识和诊断意识,采用临床-影像-病理等多学科联合诊疗(MDT)对提高诊断准确率尤其重要。

