人源免疫重建PDX模型构建及其在肿瘤免疫治疗中的应用进展*
李宏伟 高先春 窦建华 闫君雅 聂勇战
随着全球人口老龄化进展,恶性肿瘤的发病率和死亡率逐年增加。由于肿瘤发病隐匿性强,部分患者初诊时已错失手术时机。因此,药物治疗成为主要抗肿瘤手段之一。虽然传统化疗和靶向抗体药物在肿瘤治疗领域中取得显著进展,但2020年全球仍有1 000万例肿瘤患者死亡,抗肿瘤新药的研发依然面临着严峻的挑战[1]。抗肿瘤药物研究中使用的传统细胞系及其构建的肿瘤小鼠模型临床相关性低,造成大量药物临床前研究失败导致无法获得临床准入。为了提高新药临床转化率,2016年美国国家癌症研究院(NCI)指南推荐使用患者来源的肿瘤异种移植小鼠(patient-derived xenograft,PDX)和类器官(patient-derived organoid,PDO)模型用于抗肿瘤药物临床前研究。该类模型具有与患者肿瘤组织病理学特征和微环境高度一致的优势,被广泛应用于化疗及靶向新药的研发。
近年来,过继性免疫细胞治疗(adoptive cell therapy,ACT)和免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)等肿瘤免疫疗法取得了突破性进展,部分肿瘤患者生存期得到改善,推动了新靶点、新组合等研究的快速增长。然而,肿瘤免疫治疗依然存在临床获益人群比例低、耐药和药物不良反应等问题,对建立合适的药物临床前评估模型提出更高的要求。早期肿瘤免疫治疗研究常使用完全免疫能力同源细胞移植小鼠模型、基因工程小鼠模型 (genetically engineered mouse models,GEMM)和化学诱导小鼠肿瘤模型,但由于肿瘤和免疫系统的物种差异导致部分人类免疫反应无法重现,限制了抗肿瘤免疫疗法的研发。为解决人源免疫细胞因异种排异在小鼠体内无法定植的问题,近年来开发出多种重度免疫缺陷模型,促进了免疫系统人源化模型的飞速发展(表1)[2]。通过将人功能性淋巴细胞或CD34阳性造血干细胞移植入重度免疫缺陷小鼠,并在人源免疫重建后移植患者来源的肿瘤组织,可获得异质性和免疫微环境与患者相似的的免疫、肿瘤双人源化模型。该类模型不仅能够模拟肿瘤在患者体内的生长过程,还可以重现肿瘤与免疫系统间相互作用。因此,免疫、肿瘤双人源化模型的广泛应用,使得近年来肿瘤免疫治疗个体化用药标志物筛选和药物研发取得了突破性进展。基于人源化小鼠模型在肿瘤免疫治疗研究中的重要作用,本文拟对人源化免疫重建模型构建和肿瘤免疫治疗研究应用进展进行系统的阐述。

表1 用于异种肿瘤移植免疫缺陷小鼠模型的特点[2]
1 用于人源免疫重建的免疫缺陷小鼠构建及优化
在肿瘤免疫治疗研究中,为获得与人类药物反应更接近的动物模型,需要将人源免疫细胞和肿瘤组织植入不受宿主免疫排异的重度免疫缺陷小鼠。最早用于人类肿瘤研究的免疫缺陷模型是Foxn1基因自发突变的裸鼠,由于小鼠先天胸腺发育不良导致T细胞免疫应答缺陷,在传统肿瘤研究中广泛应用。但模型自体B细胞和先天免疫细胞的存在,导致人源肿瘤成瘤率低并与移植的人源免疫细胞产生严重的排异反应。为提高小鼠免疫缺陷降低异种排异,研究人员构建了缺失突变DNA依赖性蛋白激酶 (Prkdc)基因的T、 B淋巴细胞功能联合缺陷小鼠C.B-17-Prkdcscid(C.B-17 SCID)模型。不但可使人源肿瘤成瘤率显著提高还可使部分人源免疫细胞定植,但鼠源NK细胞和髓系细胞的存在造成人源化免疫重建水平依然较低[2]。之后,为降低小鼠NK细胞对人源免疫细胞杀伤的影响,尝试将Prkdc基因缺失突变引入不同品系的免疫缺陷小鼠。与C.B-17 SCID相比,Prkdc基因缺失的非肥胖型糖尿病小鼠(NOD/SCID)模型具有NK和髓系细胞功能下降等多种免疫缺陷,可使人源免疫系统重建率至少提高5倍[3]。然而,NOD/SCID小鼠体内残留的NK细胞和T、B淋巴细胞的免疫泄露,依然对人免疫细胞长期定植产生较大影响。
为了完善人源化免疫重建技术,2002年开发出NK 细胞活性丧失且极大消除固有免疫细胞“泄漏”的IL-2 受体γ链敲除模型(IL-2rgnull),开启了免疫系统人源化模型构建的新纪元。通过敲除不同背景免疫缺陷模型中IL-2 受体γ链,产生了新一代重度联合免疫缺陷小鼠模型,即NSG (NOD.Cg-PrkdcscidIL-2rgtm1Wjl/SzJ)、NOG (NOD.Cg-PrkdcscidIL-2rgtm1Sug/JicTac) 和 BRG(BALB/c Rag2-/-IL-2Rgc-/-)。虽然这3个品系之间存在一定差异,但免疫缺陷程度相似,被公认为人源免疫细胞重建最佳研究模型。
2 肿瘤免疫治疗研究中常见免疫系统人源化模型的类型
在肿瘤研究领域中,小鼠作为人类的替代品被广泛应用。但是由于物种起源、进化和发育的差异,导致人和小鼠先天免疫应答、T细胞信号传导等免疫反应差异巨大。这种差异使人体抗肿瘤免疫应答机制在体外研究模型中无法重现。为了重现人抗肿瘤免疫系统应答机制,目前常使用人源淋巴细胞(Hu-PBL)或CD34阳性人源造血干细胞(human hematopoietic stem cell,Hu-HSC)移植、人源化基因改造等方案对重度联合免疫缺陷小鼠进行免疫重建。这些免疫系统人源化模型各自的优点和局限性详述如下。
2.1 基于人外周血淋巴细胞免疫系统人源化模型构建
基于人外周血淋巴细胞免疫系统人源化模型(human peripheral blood lymphocyte,Hu-PBL)模型将外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中分离出的淋巴细胞注射移植到免疫缺陷小鼠体内,4周左右即可获得较高T细胞水平且带有供体免疫记忆的人源免疫重建模型。模型中出现的IL-1b、GM-CSF、IFN-g、IL-10、IL-2 和 IL-5有助于人源免疫细胞存活,为肿瘤患者体内T细胞免疫应答研究提供理想的平台[4]。因为人源免疫细胞易于获得、构建过程简单和成本低的优势,所以被公认为性价比最高的人源化免疫重建方案,但成熟人源T细胞对宿主快速攻击导致的异种移植物抗宿主病(xenograft versus host disease,xeno-GvHD)使肿瘤移植后药效研究窗口期有限(通常为4~6 周)[5]。因此,这类模型主要适用于评估ICIs、T细胞调节剂等针对T细胞功能药物的短期研究。近年来通过降低人源CD4+T细胞数量或敲除鼠源主要组织相容性复合体(MHC)基因等方法缓解了xeno-GvHD 症状并延长了小鼠存活时间[6-7],但成熟的人源T细胞活化依赖于对鼠源抗原的识别,且人源B细胞和髓系细胞的缺乏依然限制了Hu-PBL模型在肿瘤免疫治疗研究中的应用。
2.2 基于人CD34阳性造血干细胞免疫系统人源化模型构建
为了改善Hu-PBL模型中人源免疫细胞类型单一的缺陷,研究人员将胎肝、骨髓、脐带血(UCB)或粒细胞集落刺激因子(G-CSF)动员的外周血(MPB)中分离获得的CD34阳性人源造血干细胞移植入新生免疫缺陷小鼠体内,构建出多谱系人源化免疫重建模型(简称Hu-HSC模型)。CD34阳性Hu-HSC具有多系分化的优势,可在小鼠体内发育成多种免疫细胞群(T细胞、B细胞、NK细胞等),使模型中人源免疫细胞类型更加完整。并且,CD34阳性Hu-HSC经过小鼠体内筛选分化出的固有免疫系统和淋巴细胞通常不会产生xeno-GvHD,可使人源化免疫在小鼠体内稳定保持12 周以上[8]。基于上述优势,Hu-HSC模型可更好模拟患者体内肿瘤与免疫微环境间相互作用,适用于评估免疫药物疗效和长效机制研究。然而,Hu-HSC模型中人源免疫细胞和移植瘤HLA配型差异易出现同种异体排异。因此,肿瘤、免疫双人源化模型所用移植物最好来自同一供体或需要进行HLA匹配。小鼠细胞因子和生长因子不能有效地支持人类免疫细胞的发育,最终会导致T和NK细胞出现功能性障碍[9]。虽然Hu-HSC模型的出现使人源化免疫重建取得突破性进展,但免疫细胞的不完全植入、异种GvHD以及人类细胞因子缺失等缺陷还需要进一步改善。
2.3 人源化基因改造小鼠模型构建
随着基因编辑技术的广泛应用,为了改善模型人细胞因子缺乏导致HSC发育和分化不完全的不足,研究人员对不同遗传背景的免疫缺陷小鼠进行细胞因子人源化改造。使免疫重建小鼠(NSG-SGM3、NOGEXL 、MISTRG、NOG-IL-2 Tg、IL-15-NOG Tg和BRGF)体内人源髓系、巨噬和NK等免疫细胞分化能力、数量和成熟程度得以增加[10]。但人源化基因改造(human transgenic mice,Hu-Tg)小鼠模型会出现人源天然免疫细胞对小鼠红细胞攻击,从而造成贫血和寿命短等缺陷,使小鼠难以饲养并无法应用于大规模药物筛选研究。此外,为减少移植后xeno-GvHD诱导的非特异T细胞激活,对免疫缺陷小鼠进行了MHC Ⅰ/Ⅱ类分子敲除或人HLA-DR4(DRAG)基因敲入改造,使免疫人源化小鼠更适于研究ICIs药物抗肿瘤T细胞反应的精确评估[11]。该研究还发现,在肿瘤ICIs治疗相关研究中,除人源化免疫移植小鼠模型外,还使用了单个或多个人源化免疫调节抑制性受体(PD-1、CTLA-4、TIM3、LAG3)或刺激性受体(OX40、GITR、CD137)基因改造小鼠模型。尽管此类模型具有完全的鼠源免疫系统,但表达人源化免疫检查点分子的小鼠可直接用于临床ICIs相关候选抗体药物筛选及联用方案的疗效评价[11]。每种免疫重建模型均有其自身的优点和局限性。在肿瘤免疫治疗研究中,可以根据其特定的免疫应答方向构建相应的人源化免疫重建小鼠模型(表2)。
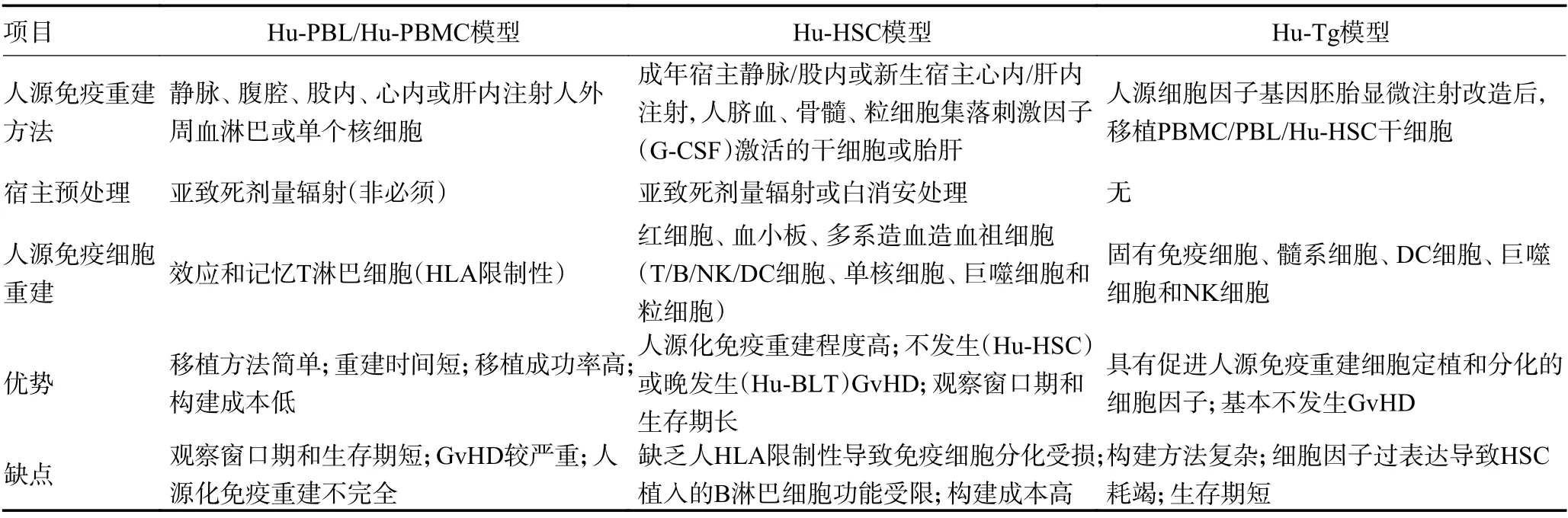
表2 不同人源化免疫重建模型的构建特点
3 不同类型人源化免疫重建模型在肿瘤免疫相关治疗中的应用
肿瘤的生长和治疗效果与肿瘤微环境(TME)密切相关,人源化免疫重建小鼠移植患者肿瘤构建的肿瘤、免疫双人源化模型,可模拟患者体内肿瘤与免疫微环境间相互作用,使其成为目前肿瘤免疫治疗研究最有说服力的临床前模型。其中,主要涉及ICIs、细胞和抗体免疫治疗等领域。
3.1 人源化免疫重建模型在ICIs药物临床前研究中的应用
ICIs是阻断肿瘤免疫逃逸、促进T细胞杀伤肿瘤的免疫治疗方案,该类药物的广泛应用改变了肿瘤治疗的格局。ICIs药物临床前研究常使用同系肿瘤小鼠模型,但鼠源免疫检查点分子组成、免疫微环境应答模式和肿瘤突变负荷与人类的差异,导致药效准确评价受到影响。
人源化免疫重建模型在ICIs疗效评估中的应用,大幅提高了体外研究与临床患者疗效的一致性。Sanmamed等[12]首次使用胃、肠癌Hu-PBL BRG小鼠模型对临床级PD-1抗体和CD137抗体药物进行临床前药效评价。研究发现,药物阻断PD-1并同时激活CD137可使肿瘤免疫微环境中可表达IFN-γ的人源T细胞数量增加,抑制了肿瘤的生长,为肿瘤、免疫双人源化小鼠模型在ICIs及药物联用研究中的应用提供了依据。尽管Hu-PBL模型在ICIs治疗机制研究中取得重大进展,但过早出现的xeno-GvHD导致研究窗口期过短使模型无法完全反映患者疗效[13]。
Hu-HSC模型具有人源免疫细胞持续再生和研究窗口时间长的优势,使其更适用于ICIs药效评价和机制研究。Capasso等[14]在乳腺癌和结肠癌Hu-HSC模型中不仅观察到与临床一致的PD-1药物和HDAC抑制剂联用的抗肿瘤疗效,还发现IFN-γ表达的CD8+肿瘤浸润性T细胞增加对肿瘤生长的抑制的相关作用机制,为提高ICIs疗效和个性化患者筛选提供了临床前研究基础。ICIs治疗相关不良反应 (irAEs)往往是器官特异性的,免疫毒性会使患者永久性终止该类药物的使用,所以ICIs药物毒性评价在临床前研究中意义重大[15]。肿瘤、免疫双人源化模型在评估ICIs治疗毒性方面也显示出巨大的潜力。胎肝来源 CD34 阳性 Hu-HSC构建的肝癌肿瘤、免疫双人源化模型已被用于评估与派姆单抗和伊匹单抗用药相关肝、肺和肾等器官损伤[16]。此外,免疫无应答和治疗耐药是临床肿瘤患者抗PD-1治疗失败的重要因素。使用 Hu-HSC(HLA-A匹配)和自体胸腺移植构建的人源化免疫NSG小鼠黑色素瘤模型进行PD-1抗体耐药机制研究,发现治疗后趋化因子导致的肿瘤浸润的肥大细胞增加在PD-1抗体耐药中发挥重要作用,并且使用肥大细胞相关小分子抑制剂有助于提高免疫检查点治疗应答[17]。
除了免疫缺陷小鼠构建的人源化免疫重建模型之外,CRISPR-Cas9基因编辑的新一代人源PD-1、CTLA4双基因敲入小鼠模型在阿斯利康公司PD-1和CTLA-4单价双特异性抗体新药MEDI5752临床前评价中也发挥着重要作用。小鼠体内研究显示MEDI5752在靶向PD-1阳性细胞的同时,提高了CTLA-4抗体单臂与抗原的结合力,使其可优先CTLA-4单抗定位于肿瘤部位。该结果不但展示出MEDI5752独特的抗肿瘤活性,还推动了临床试验的进展。此外,在人胸膜间皮瘤原位小鼠模型中发现诱导 PD-1 阻断与 CAR-T疗法相结合,可以显著增强肿瘤杀伤,该研究推动了肿瘤免疫疗法进入综合治疗的新时代[18]。
3.2 人源化免疫重建模型在ACT治疗方案开发和作用机制的研究应用
免疫相关治疗方案中,除了降低肿瘤细胞免疫逃逸能力,还可以通过体外扩增并回输肿瘤特异性T细胞受体(T-cell receptor,TCR)或嵌合抗原受体(chimeric antigen receptor,CAR)表达的工程化T细胞对肿瘤进行靶向清除,这类治疗方案统称为ACT。虽然ACT在部分肿瘤患者中疗效显著,但TCR-T/CART细胞抗肿瘤作用机制和安全性评价还需要进一步探索。
人源化免疫重建模型的出现,促进了TCR-T的临床前体外疗效评价和工程化TCR优化研究。Johanna等[19]利用Hu-HSC构建的 NSG-SGM3模型证明,表达特定γδTCR的αβT细胞可有效清除白血病细胞,而且不会出现对健康造血细胞的非特异杀伤。为了优化TCR-T抗肿瘤作用,Najima等[20]使用WT-1特异性TCR基因改造的人源HSC移植入HLA-I转基因NSG小鼠中,使WT-1特异性细胞毒性T细胞持续增殖,并通过产生IFN-γ发挥抗原特异性细胞因子反应,可持久获得功能性细胞毒性T细胞,从而增强了抗肿瘤功能。目前,靶向WT-1的TCR细胞产品已进入Ⅱ期临床试验阶段。
人源化免疫重建模型在CAR-T临床前疗效评价中也发挥着重要作用。尽管早期研究发现Hu-PBL小鼠比免疫缺陷模型更适合CAR-T疗效评估,但模型研究窗口期短导致CAR-T细胞容易耗尽且不易在小鼠体内持续存在。通过使用Hu-HSC构建的急性淋巴细胞白血病模型,可对靶向CD19 CAR-T细胞的宿主免疫杀伤机制和持久性进行探索,为CD19 CART临床获批奠定坚实的临床前数据基础[21]。虽然CAR-T疗法疗效显著,但细胞因子释放综合症(CRS)和神经毒性等严重药物不良事件的发生也是影响临床应用的重要因素。人源化免疫重建小鼠模型不仅有助于CAR-T疗法的疗效评价,还可以模拟治疗不良反应的发生。Hu-HSC SGM3小鼠同时具有人源T细胞和CRS发生相关的单核细胞。使用模型体内T细胞制备的CD44v6和CD19 CAR-T细胞并回输,可重现CRS发生标志物(IL-6、血清淀粉样蛋白A等)短期释放、体质量骤降和体温升高等患者临床治疗后并发症特征,为CAR-T疗法临床CRS评价和神经毒性干预治疗手段的提供了新思路[22]。
CAR-T细胞在肿瘤免疫治疗中的临床应用往往受到非靶向的细胞毒作用等限制。近年来新出现的NK/NKT免疫疗法,不仅能高效杀伤肿瘤还可避免GvHD反应发生,使其成为更具临床发展潜力的免疫治疗手段。人源化免疫重建模型已在多种肿瘤的NK/NKT免疫杀伤活性研究中取得了进展。Heczay等[23]在Hu-HSC转移性神经母细胞瘤NSG模型中也发现,具有CD28和4-1BB共刺激结构域的第3代GD2 CAR设计增强了CAR-NKT细胞的体内持久性,并显示出强大的抗肿瘤活性。并且Hu-HSC模型持续分化的人源造血系统对转移性神经母细胞瘤模型的支持,使模型中GD2 CAR-NKT疗效与患者高度一致。
3.3 人源化免疫重建模型在ADCC抗体药效学评价中的应用
具有增强抗体依赖性细胞介导的细胞毒性(antibody-dependent cellular cytotoxicity,ADCC)作用抗体药物需要与具有杀伤能力的免疫细胞(NK细胞、巨噬细胞等)相结合才能在人体内发挥抗肿瘤作用。因此,免疫系统人源化模型在这类药物疗效评价中也发挥重要作用。目前,人源化免疫重建NOG小鼠白血病和淋巴瘤模型已被用于抗CCR4和抗CD52抗体介导的NK细胞ADCC作用疗效评估[23-25]。此外,肿瘤、免疫双人源化模型还被应用于结肠癌(双特异性Ep-CAM/CD3抗体)、淋巴瘤(双特异性CD20/CD3抗体)和卵巢癌(抗CD3/CLDN6和抗CD3/EpCAM)针对肿瘤抗原和细胞毒性T细胞的双特异性抗体药物疗效评估[26-27]。除此之外,Bleijs等[28]还使用基于Hu-HSC构建的NSG和NRG免疫人源化模型评估了抗CD20奥法木单抗(ofatumumab)的药代动力学(PKs)和潜在毒性。并发现该模型可以模拟人补体依赖性细胞毒性(complement dependent cytotoxicity,CDC)作用对CD20阳性淋巴瘤和慢性淋巴细胞白血病的特异性杀伤。
4 影响肿瘤、免疫双人源化模型应用的其他因素
随着免疫系统人源化模型构建方案的不断地改良和优化,推动了肿瘤、免疫双人源化模型在肿瘤免疫治疗相关研究中的广泛应用。但依然受限于肿瘤移植模型自身存在的构建时间长、成瘤率低、成本高和无法进行大规模药物筛选等问题。为了推进免疫、肿瘤双人源化模型在临床前和药物转化研究中的应用,研究人员从肿瘤移植位置优化、高增殖活性小鼠筛选、肿瘤移植过程中Matrigel的添加和移植后人源细胞因子补充等方面对模型进行改良[27]。然而,昂贵的建模成本使模型在高通量药物筛选应用中依然受限。
为了弥补人源化小鼠模型在肿瘤治疗研究中的局限性,研究人员近十年间还开发出PDO模型作为肿瘤研究中小鼠的替代品。PDO模型不但可重现人源肿瘤内和肿瘤间异质性,还具有模型构建成本低、周期短等优势被广泛应用于抗肿瘤药物开发和高通量药物筛选等领域(表3)[28]。由于PDO模型缺乏肿瘤免疫微环境和体内免疫系统,研究人员建立了PDO芯片和PDO、外周血/肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)共培养模型,使其可以替代小鼠模型应用于肿瘤免疫治疗研究[29]。如在PDO与患者自体PBMC共培养模型中,可观察到PDO刺激下肿瘤特异性抗原反应性T细胞富集和扩增,甚至可以预测免疫抑制等免疫治疗的效果[30]。PDO与TILs共培养系统可用于肿瘤反应性T细胞扩增,过继性T细胞免疫治疗和肿瘤反应性TCR新靶点的发现。但是这类模型无法重现体内免疫细胞在肿瘤组织中募集和肿瘤杀伤等生理过程,所以在免疫治疗研究中需要使用肿瘤PDO构建相应的免疫系统人源化小鼠模型(patient-derived organoids-based xenograft, PDOX)进行相互验证[31]。

表3 患者PDX模型和PDO模型的优势和局限性
5 结语与展望
随着肿瘤免疫相关治疗的取得了革命性的突破,使得患者治愈率和生存率显著提高。肿瘤、免疫双人源化小鼠模型作为现阶段免疫治疗最具潜力的疗效评估工具,不但可以重现人体内肿瘤免疫微环境在肿瘤发生、发展和转移中发挥重要作用,还可以用于新药物、新方案的临床前有效性和安全性评价。虽然双人源化小鼠可模拟患者体内大部分免疫细胞(固有免疫、适应性免疫)与肿瘤的相互作用,但依然缺乏人源免疫中的一些关键因素。其中主要包括免疫细胞与肿瘤之间的MHC相容性差异和部分人源细胞因子、趋化因子缺乏等,导致模型免疫亚群发育受阻。前期的研究数据不仅有助于免疫治疗基本机制的完善,还对进一步开发具有更高拟人化小鼠改良模型发挥了积极的推动作用。
本文分析了不同类型人源化免疫重建模型在免疫治疗研究中的优势和局限性。然而,依然暂无单一模型可以完美地模拟人类肿瘤和免疫系统的临床特征。因此,临床研究前根据不同研究目标选择合适的模型尤为重要。另外,随着双人源化模型不断改进并与人源肿瘤异体移植模型来源的肿瘤类器官等多种体内外模型进行联合应用,将尽可能更好地预测肿瘤免疫治疗药物敏感性和毒性[32],为肿瘤免疫治疗新策略的研发及高效临床转化提供更可靠的临床前研究平台。

