雌激素受体低表达乳腺癌的研究进展*
郑方超 综述 袁芃 审校
雌激素受体(estrogen receptor,ER)作为乳腺癌的生物学标志物,影响着乳腺癌内分泌治疗的选择。美国临床肿瘤学会和美国病理学家学会(American Society of Clinical Oncology /College of American Pathologists,ASCO/CAP)指南(2010年)将ER≥1%定为ER阳性,ER<1%定为ER阴性。ASCO/CAP指南(2020年)中,新增ER在1%~10%定为ER低表达,ER>10%定为ER高表达。ER低表达乳腺癌,作为一种特定表达形式,其生物学特征与ER阴性相似[1]。
ER阳性乳腺癌除从5~10年内分泌治疗获益外[2],针对人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)、周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4 and 6,CDK4/6)的靶向药物、针对PIK3CA基因突变的选择性磷脂酰肌醇3-激酶(PI3K)抑制剂阿培利司以及靶向BRCA胚系突变的PARP抑制剂等药物也给患者带来生存改善。ER阳性乳腺癌的治疗策略能否直接用于ER低表达乳腺癌,目前尚无定论。因此,本文将对ER低表达乳腺癌的研究进展进行综述。
1 ER表达的发展及生物学特征
1.1 ER表达的发展
ER在细胞膜、细胞质、线粒体和细胞核均有表达,最初用于测定ER表达的方法是配体结合试验(ligand binding assay,LBA)。随后Harvey等[3]证实:相对LBA,免疫组织化学法(immunohistochemistry,IHC)测定ER能同等或更好地预测内分泌治疗的效果,且更为安全便利,至 20世纪90年代IHC逐渐替代LBA。
ER阳性乳腺癌适合行内分泌治疗,但在不同研究中,ER阳性的界值从1%到20%不等[4]。一项纳入绝经前乳腺癌的研究中,将ER≥10%定义为ER阳性[5]。Viale等[6]也将ER≥10%定义为ER阳性。ER≥10%作为ER阳性的界值逐渐被认可。ASCO/CAP指南(2010年)修订ER阳性为ER表达≥1%,ER阴性为ER表达<1%[7]。
此外,Gnant等[5]根据ER表达量对ER阳性患者进行分组,ER表达为 10%~50%定义为低表达,51%~80%为中表达,81%~100%为高表达。Viale等[6]根据ER表达量行亚组分析发现,ER为阴性、ER为1%~9%、ER≥10%三类患者的无病生存期(disease-free survival,DFS)差异具有统计学意义(P<0.05),而该研究中ER表达为1%~9%患者为44例。一项9 636例的回顾性研究发现,250例患者(2.6%)ER表达为1%~9%[8]。因此,仅以1%作为ER阳性界值预测内分泌疗效尚有不足,尤其是ER低表达患者[9]。ASCO/CAP指南(2020年)、晚期乳腺癌国际共识指南第五版(ABC5)、中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2021年)将ER表达在1%~10%定为ER低表达(弱阳性),见表1。
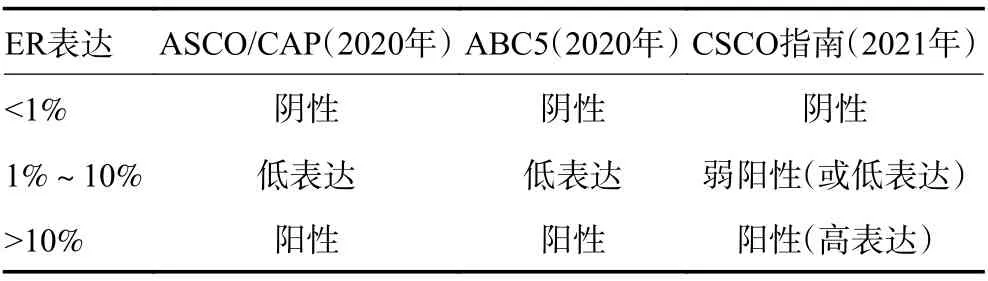
表1 ER表达量
1.2 ER表达的生物学特征
ER和孕激素受体(progesterone receptor,PR)是核受体超家族,在ER阳性绝经前或围绝经期乳腺癌中,PR低表达患者能从化疗中受益[10];ER阳性、PR阴性是乳腺癌复发高危因素。研究显示,ER低表达与ESR1基因突变或拷贝数变异相关[1],NF-κB的激活调控ER表达下调[11]。
2 ER低表达的流行病学、临床病理特征及相关生物标记物
2.1 流行病学特点
ER阳性乳腺癌中,ER低表达患者占2%~5%[9,12-17]。在纳入2 162例病理分期为Tis期和T1期的乳腺癌中,ER低表达占2.5%[15]。一项33 366例HER-2阴性乳腺癌的研究发现,HR低表达占2%[16]。在韩国的研究中,纳入5 930例乳腺浸润性导管癌或小叶性癌患者,ER低表达约占2%[17]。另一研究显示,纳入ER阳性/HER-2阴性乳腺癌1 573例,ER低表达约占3%[18]。在中国ER阳性/HER-2阴性患者的小样本中,ER低表达占5%[19]。
2.2 临床病理特征
研究显示,ER低表达与ER阴性或基底样乳腺癌的分子特征相似[14,20]。有研究发现,ER低表达患者的年龄、种族、家族史、肿瘤大小、分期或肿瘤分级等与三阴性乳腺癌(triple-negative breast cancer,TNBC)患者比较差异无统计学意义(P>0.05),且与TNBC胚系突变相似,BRCA1/BRCA2是最常见的突变基因[14]。也有研究发现,ER低表达与ER阴性患者的年龄、肿瘤大小、HER-2表达等相似[20]。但ER低表达患者的临床病理特征有别于ER阴性或ER高表达者。ER低表达较ER≥10%患者的年龄更小,分期更晚的比例更高(临床分期Ⅱ vs. Ⅲ期为61.6% vs. 43.7%)[8];与ER阴性相比,ER低表达分期更早。一项欧洲的研究发现,ER低表达较ER阴性患者的导管癌比例更少,组织学分级G3期更少,Ki-67表达更低[4]。另有研究显示,ER阴性较ER低表达患者的分化更差[21]。
一项纳入2 162例乳腺癌的研究发现,与ER高表达相比,ER低表达患者的组织学分级更差、Ki-67表达更高,PR阴性比例更高;与ER阴性患者相比,ER低表达患者更年轻、组织学分级更好、Ki-67表达更低,PR阳性比例更高[15]。一项465例早期乳腺癌包括25例ER低表达患者的研究发现,约有1/4 ER低表达患者的ESR1 mRNA表达呈阳性,ER高表达患者的ESR1 mRNA表达高于ER低表达和ER阴性患者[22]。
2.3 HER-2阳性及生物标记物
Finn等[23]研究发现,在转移性ER阳性/HER-2阴性乳腺癌中,ER低表达可作为标志物,预测拉帕替尼联合内分泌方案的疗效。与ER高表达和ER阴性相比,ER低表达中HER-2阳性表达比例更高[15];ER低表达患者中的HER-2阳性表达比例高于ER高表达比例(27.6% vs.13.1%)[8]。
ER低表达作为生物标记物能预测乳腺癌患者的病理完全缓解(pathological complete response,pCR)率[24]。研究显示,在ER低表达患者中TP53蛋白表达更高[25]。HR阴性乳腺癌BRCA1/2突变率为36.1%(86/238);HR低表达乳腺癌BRCA1/2突变率为39.5%(30/76)[26],HR低表达和HR阴性乳腺癌的BRCA1/2突变率相近。
3 ER低表达乳腺癌的治疗及预后
3.1 内分泌治疗
2005年国际乳腺癌研究小组将乳腺癌分为内分泌治疗敏感型(内分泌治疗改善预后)、内分泌治疗不敏感型(ER不表达或阴性)和内分泌疗效不确定型(ER低表达或ER表达不明显,内分泌效果不确定,常需化疗)[26]。研究发现,ER低表达乳腺癌患者受益于内分泌治疗,但治疗效果较ER高表达者差[27]。新辅助化疗后,ER低表达比ER高表达患者有更佳的pCR率;相较于ER高表达乳腺癌,ER低表达患者DFS和总生存时间(overall survival,OS)更短[24]。
在ER低表达乳腺癌中,未行内分泌治疗89例、行2~3年内分泌治疗185例、行5年内分泌治疗360例患者的结果显示,2~3年与5年内分泌治疗患者的DFS差异无统计学意义(P>0.05),均优于未行内分泌治疗的患者,2~3年短程或5年行内分泌治疗均是可行的治疗方案[28]。
3.2 其他药物治疗
卵巢功能抑制(ovarian function suppression,OFS)剂常用于绝经前女性乳腺癌患者治疗,OFS提高了患者(ER或PR>10%)的8年DFS和OS,但未包括ER低表达者[29]。在绝经前(尤其育龄期)的女性乳腺癌中,化疗可致卵巢功能不全,进而增加女性不孕、骨质疏松、认知障碍、心血管疾病等风险,而OFS可保护卵巢功能,进而降低以上风险。
在ER阳性/HER-2阴性的转移性乳腺癌中,CDK4/6抑制剂联合内分泌治疗已成标准一线方案[30]。该研究显示,在早期乳腺癌中,新辅助或辅助内分泌治疗也给患者带来生存获益,如 Monarch E试验中阿贝西利、PALLAS试验中哌柏西利用于辅助内分泌治疗,以及FELINE试验中瑞博西尼用于新辅助内分泌治疗。CDK4/6联合内分泌治疗中,ER低表达患者的生存获益是否等同ER阳性尚无预设试验佐证,治疗选择上还需谨慎。一项III期随机临床试验发现,低剂量口服环磷酰胺未能改善ER低表达和TNBC患者的DFS[31]。
3.3 早期乳腺癌预后
一项纳入360例早期乳腺癌的研究显示,ER低表达和ER阴性患者的3年DFS和OS差异无统计学意义(P>0.05)[21]。另有研究发现,ER阴性与ER低表达乳腺癌患者的5年DFS(74% vs.79%)和OS(86%vs.90%)差异无统计学意义(P>0.05)[4]。一项42例ER低表达早期乳腺癌的研究发现,ER低表达和ER阴性患者的5年DFS和OS差异无统计学意义(P>0.05)[32]。研究显示,ER低表达患者的OS优于ER阴性,差于ER高表达者[22]。Viale等[6]研究发现,ER高表达患者的预后优于ER阴性患者,ER低表达与ER阴性或ER高表达患者的预后差异无统计学意义(P>0.05)。在病理分期为Tis期和T1期乳腺癌中,ER低表达与ER高表达患者的5年DFS差异无统计学意义(P>0.05),但ER阴性者的5年DFS比ER高表达者差[15]。也就是说,ER低表达在不同乳腺癌患者中的预后不同。也有研究未根据早、晚期乳腺癌进行分期。一项9 636例早、晚期乳腺癌的研究中,ER低表达患者的无远处转移生存期、DFS和OS均差于ER>10%的患者,但ER低表达和ER阴性患者的DFS相似[8]。
2018年一项荟萃分析显示,ER低表达乳腺癌患者较ER阴性有更佳的5年DFS和OS,且相对ER≥10%、ER低表达乳腺癌者的内分泌治疗效果差,是否行内分泌治疗不影响ER低表达乳腺癌患者的预后[27]。2021年一项荟萃分析显示,ER低表达比ER高表达患者有更高的pCR率(24.8% vs. 8.3%),但与ER阴性患者的pCR率相近,与ER高表达相比,ER低表达乳腺癌患者的DFS和OS更差,而ER低表达与ER阴性患者的预后相近[24]。见表2。

表2 ER低表达乳腺癌患者的预后
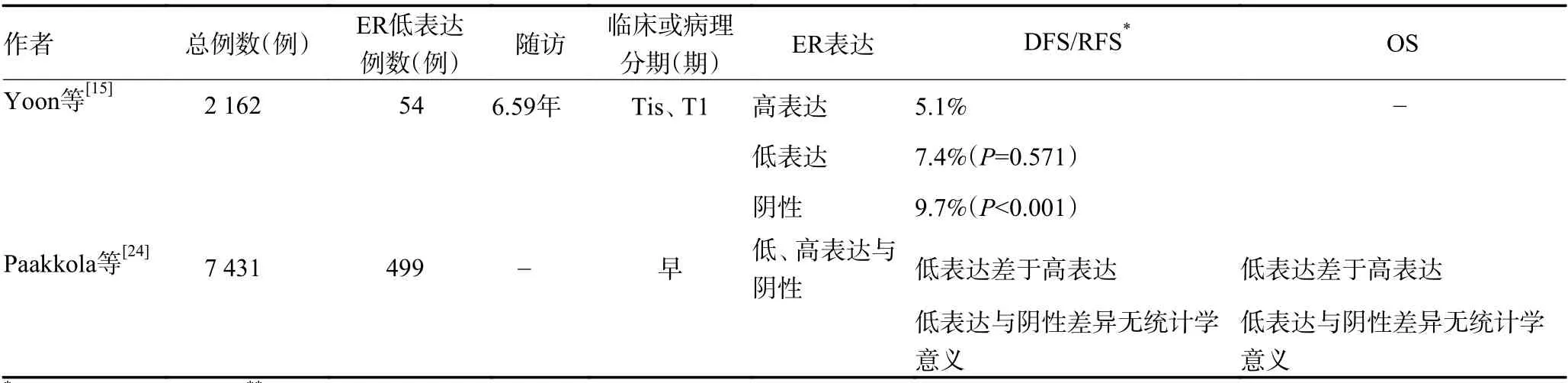
表2 ER低表达乳腺癌患者的预后 (续表2)
4 结语
在ER阳性乳腺癌中,针对HER-2、CDK4/6、PIK3CA等靶点的药物改善了患者预后,但上述策略用于治疗ER低表达乳腺癌的证据尚有不足。目前,ER低表达患者的治疗证据多来自临床试验的亚组分析、回顾性研究或荟萃分析。考虑到ER低表达乳腺癌不同的生物特征,建议在ER低表达乳腺癌患者的治疗中,应在多学科模式下,整合患者HER-2状态、年龄、基因突变等生物学特征,制定更优化的治疗策略。

