术前免疫炎症指数与胃癌患者预后关系的研究*
许召君 陈小彬 安娟③ 袁加琪 蒋树云 刘韬 张成武 马晓明
世界卫生组织发布的GLOBOCAN数据显示[1],2020年全球新增胃癌病例为108.9万例,胃癌导致死亡的人数高达76.9万例,分别位居恶性肿瘤发病率和死亡率的第五位和第四位,严重威胁人们的生命健康。尽管早期诊断技术逐步提高、外科手术愈加精准、化疗方案不断成熟,但因胃癌患者早期症状不明显,故诊断时多为进展期,使得手术难度加大、术后易复发且转移率较高,35%~70%的患者5年内会出现复发和转移。另一方面,肿瘤干细胞(circulating stem cells,CSCs)的存在也极大地降低了胃癌的5年生存率,导致其预后较差,因此及时对病情进行判断并对其预后进行精准的评估,从而制定相应的个体化诊疗方案至关重要[2-5]。
近年来,研究表明,炎症反应和免疫反应在肿瘤的发生、发展过程中发挥重要的作用,其中包括的循环免疫细胞和炎症细胞主要有中性粒细胞(neutrophil,NE)、淋巴细胞(lymphocyte,LY)和血小板(platelet,PLT)[6]。最近,一种以NE、LY和PLT为基础计算出的SII已证实在评估食管癌、乳腺癌、肝癌、胰腺癌的预后中具有重要价值[7-10]。然而到目前为止,关于SII对胃癌术后患者预后价值影响的研究相对较少。本研究的主要目的是探讨SII在胃癌术后患者预后中的价值。
1 材料与方法
1.1 病例资料
回顾性分析2010年6月至2015年6月青海大学附属医院收治行手术治疗的胃癌患者临床资料。治疗方式包括远端胃癌根治术(distal gastrectomy,DG)、近端胃癌根治术(proximal gastrectomy,PG)、全胃切除术(total gastrectomy,TG)。
纳入标准:1)术前病理明确诊断为胃黏膜腺癌;2)术前未行放、化疗及生物治疗等其他治疗;3)术前未合并急慢性炎症,血常规检查结果正常者;4)接受手术治疗,行规范淋巴结清扫。排除标准:1)病历资料缺失或失访患者;2)拒绝手术治疗者;3)术前合并血液系统疾病或其他肿瘤的患者。病理分期以第8版UICC/AJCC分期为标准[11],采用日本胃癌协会指南(胃癌治疗指南)进行胃癌的病理诊断和分类[12]。
1.2 方法
收集患者入院首次采血结果,计算SII,SII=PLT×NE/LY,根据本组患者SII最佳临界值进行分组,分析SII与患者临床病理因素之间的关系。
对所有术后患者进行定期随访,随访周期为每3~6个月随访1次,采用门诊、短信、电话、电子邮件、网络通信工具等方式进行随访。总生存时间定义为术后第1天至死亡或随访截止时间,随访截止时间为2021年2月或患者死亡。
1.3 统计学分析
使用SPSS 26.0和Graphpad Prism 8.0软件进行统计学分析。计数资料采用n(%)表示,组间比较采用χ2检验。相关性分析采用Spearman相关分析。应用ROC曲线确定SII的最佳临床临界值,应用Kaplan-Meier法计算总生存时间(overall survival,OS)并绘制生存曲线,组间差异采用Log-rank检验。采用Cox回归模型进行单因素和多因素分析,并计算风险比(hazard ratio,HR)及对应的95%CI。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料
经筛选共有771例患者符合标准,其中男性606例(78.60%)、女性165例(21.40%),年龄25~81(56.91±9.546)岁。771例患者术前及术后病理均证实为胃黏膜腺癌,无因术后并发症死亡患者,术后均顺利出院。所有患者中接受DG者297例(38.52%),PG者250例(32.43%),TG者224例(29.05%),均接受标准D2淋巴结清扫术。截至2021年2月,771例患者全部获得随访,中位随访时间46个月(95%CI:43.986~48.014),490例患者尚健在。
2.2 SII最佳临界值的确定
Spearmen相关分析提示,SII与胃癌患者术后生存状态具有显著性相关(r=0.399,P<0.001)。绘制SII相关ROC曲线,AUC=0.721(95%CI:0.681~0.761),约登指数(Youden index,YDI)为0.384,对应的最佳临界值为489.52,其评估灵敏度为55.5%,特异度为82.9%。并根据该临界值将771例患者分为L-SII组(SII≦489.52)和H-SII组(SII>489.52),分别为531例和240例(图1)。
2.3 SII与胃癌患者临床病理因素的关系
SII与肿瘤最大直径、组织学类型、ALb、NE、LY、PLT、WBC、CA125、TNM分期均有关(P<0.05),而与年龄、性别、吸烟、饮酒、ABO血型、CEA、CA199以及手术方式无关(P>0.05,表1)。
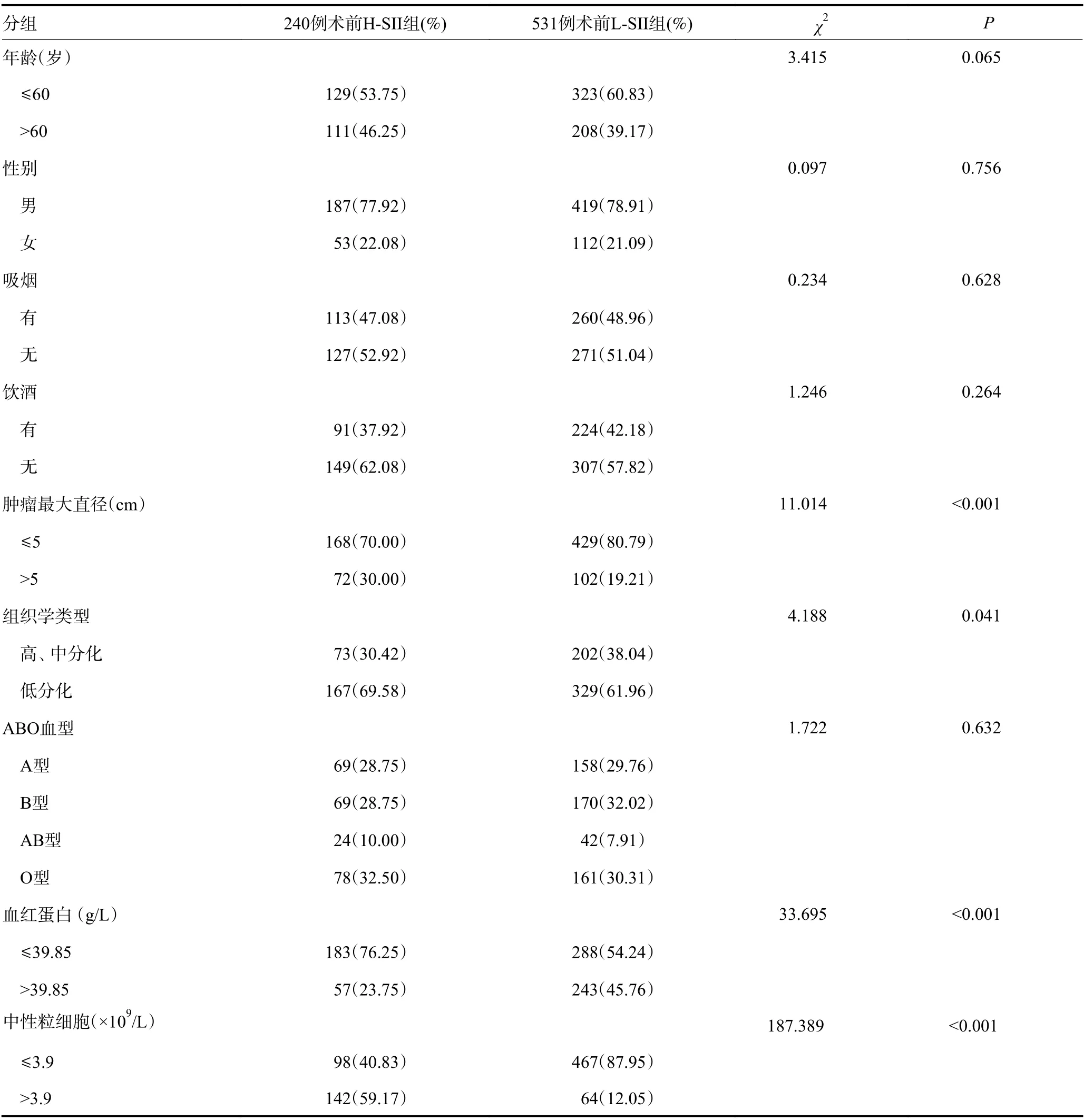
表1 SII与胃癌患者临床病理因素的关系
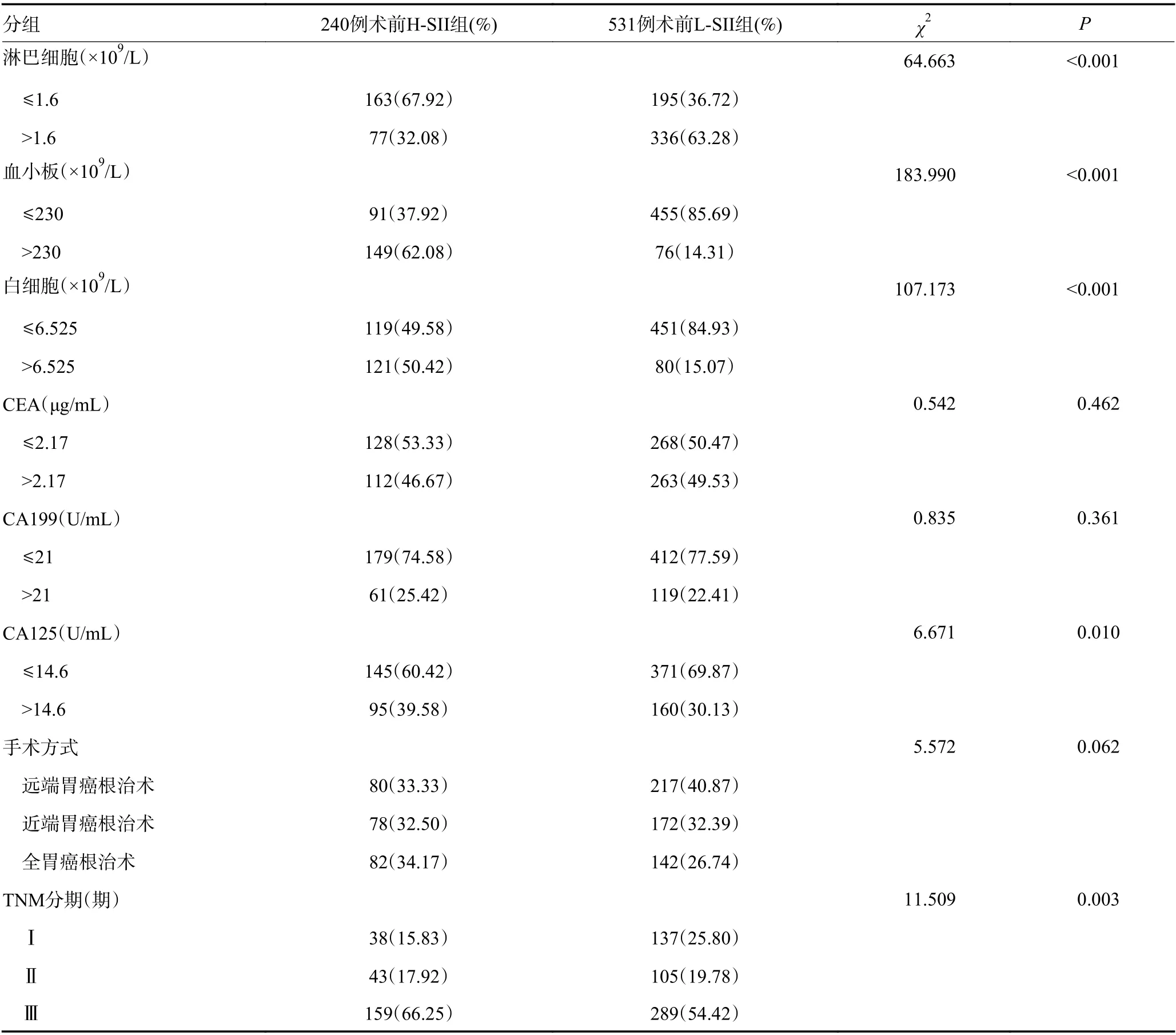
表1 SII与胃癌患者临床病理因素的关系 (续表1)
2.4 SII与胃癌患者总生存期的关系
L-SII组中平均OS时间为60.547个月(95%CI:58.221~62.873)、中位OS时间为73个月(95%CI:65.172~80.828);H-SII组中平均OS时间为35.912个月(95%CI:32.840~38.984),中位OS时间为28个月(95%CI:24.646~31.354)。L-SII组1、3、5年OS率分别为92.8%、81.0%、67.9%;H-SII组分别为80.0%、39.8%、28.9%,L-SII组胃癌患者的OS率优于HSII组,两组OS率差异具有统计学意义(P<0.05,图2)。此外,本研究通过Kaplan-Meier生存曲线和对数秩检验分析高低SII组在不同TNM分期中的生存结果发现,Ⅰ、Ⅱ、Ⅲ期中L-SII组的5年OS率明显高于H-SII组(分别为81.8% vs. 24.8%、56.5% vs. 21.2%、62.5% vs. 24.6%),差异具有统计学意义(P<0.05,图3)。
2.5 影响患者生存的单因素分析
单因素分析结果显示,年龄、肿瘤最大直径、组织学类型、ALb、CEA、CA199、CA125、WBC、SII、手术方式、TNM分期均是影响胃癌患者预后的因素(P<0.05);而性别、吸烟、饮酒、ABO血型与胃癌患者预后无关,差异无统计学意义(P>0.05),见表2。
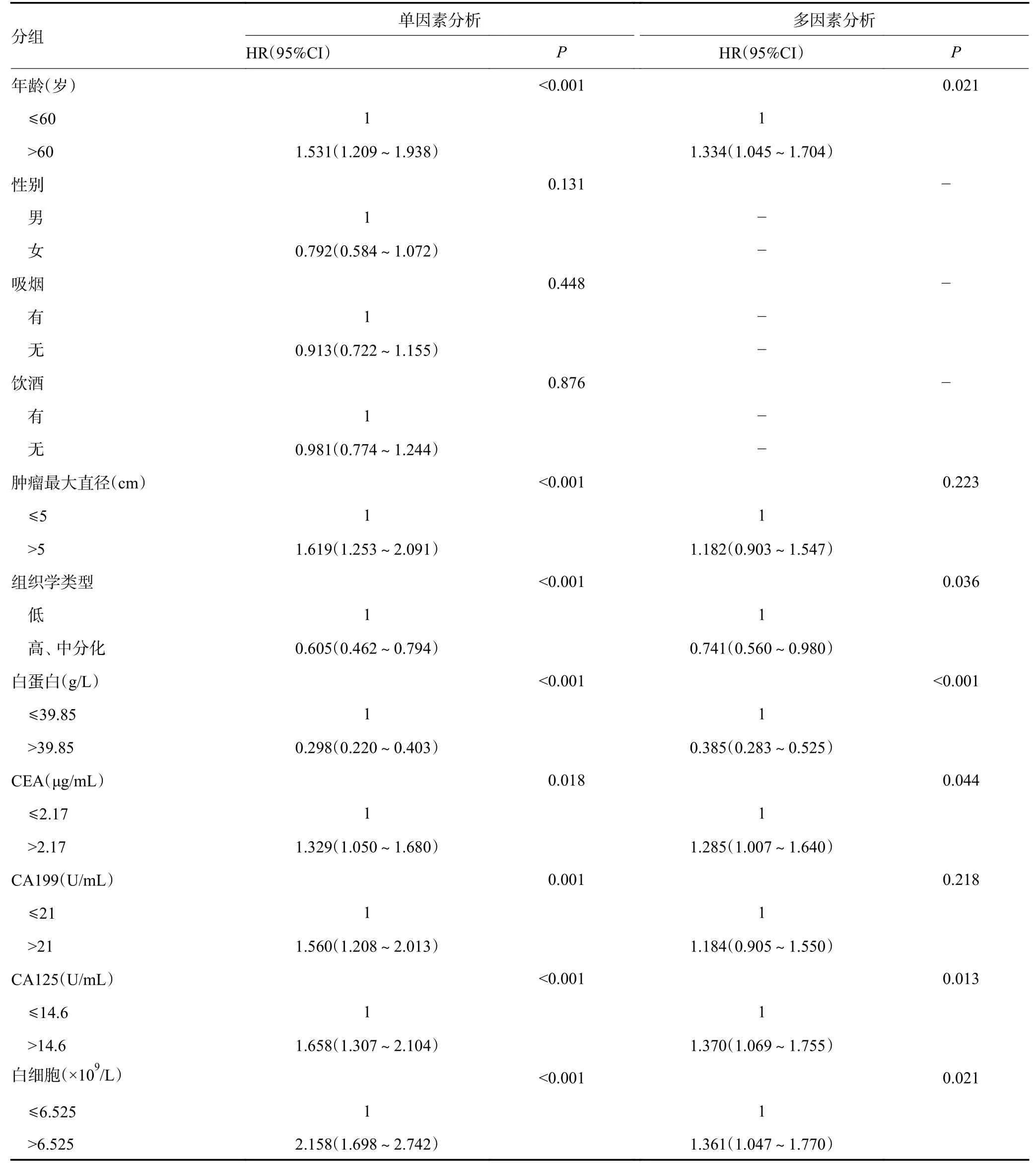
表2 影响胃癌患者生存的单因素及多因素分析
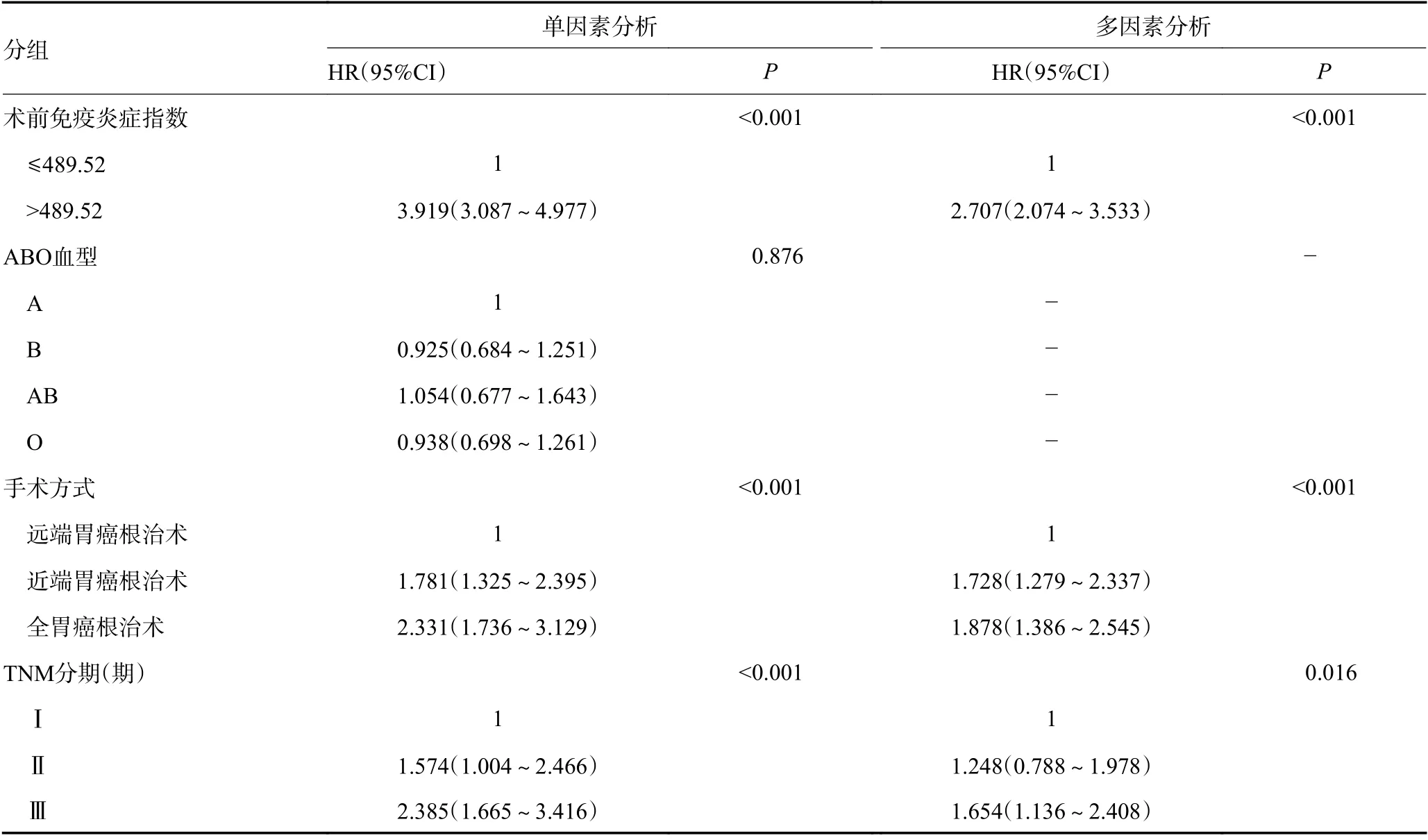
表2 影响胃癌患者生存的单因素及多因素分析 (续表2)
2.6 Cox回归模型多因素分析
将单因素分析结果中具有统计学意义(P<0.05)的因素纳入多因素Cox回归模型,结果显示年龄、组织学类型、CEA、CA125、WBC、SII、手术方式、TNM分期均是影响胃癌患者预后的独立危险因素(P<0.05),而肿瘤最大直径、CA199不是胃癌患者的独立预后因素(P>0.05),但仍能够作为预测胃癌患者OS时间的重要参考指标(表2)。
2.7 SII和其他临床因素在胃癌患者术后的预后价值比较
通过ROC曲线分析表明,SII的AUC=0.692(95%CI:0.651~0.732,P<0.001),TNM分期的AUC=0.622(95%CI:0.582~0.699,P<0.001),ALb的AUC=0.661(95%CI:0.622~0.699,P<0.001),CA125的AUC=0.565(95%CI:0.522~0.607,P<0.001),WBC的AUC=0.606(95%CI:0.563~0.648,P<0.001),手术类型的AUC=0.591(95%CI:0.550~0.633,P<0.001),组织学类型的AUC=0.582(95%CI:0.541~0.623,P<0.001),年龄的AUC=0.550(95%CI:0.507~0.592,P<0.001)。SII较其他指标的AUC大,组间AUC面积差异具有统计学意义(P<0.05),SII作为一个新的预后指标有望成为评估胃癌患者预后的指标(图4)。
2.8 SII联合Alb、CEA、CA125、WBC在胃癌患者预后中的预测价值
将SII、Alb、CEA、CA125、WBC 指标通过二元Logistic回归分析进行联合,设X1=SII,X2=Alb,X3=CEA,X4=CA125,X5=WBC;变量Y代表X1联合X2、X3、X4、X5效果的新值,可得联合预测概率值回归模型Y=1.46×X1-1.406×X2+0.426×X3+0.573×X4+0.587×X5-2.804(表3)。其预测胃癌患者预后预测效能的曲线下面积AUC为0.786(95%CI:0.752~0.819,P<0.001),最佳截断值为-0.530,敏感度为64.4%,特异度高达79.8%。表明SII联合Alb、CEA、CA125、WBC较单独使用单个指标具有显著提高预测的AUC值(图5)。
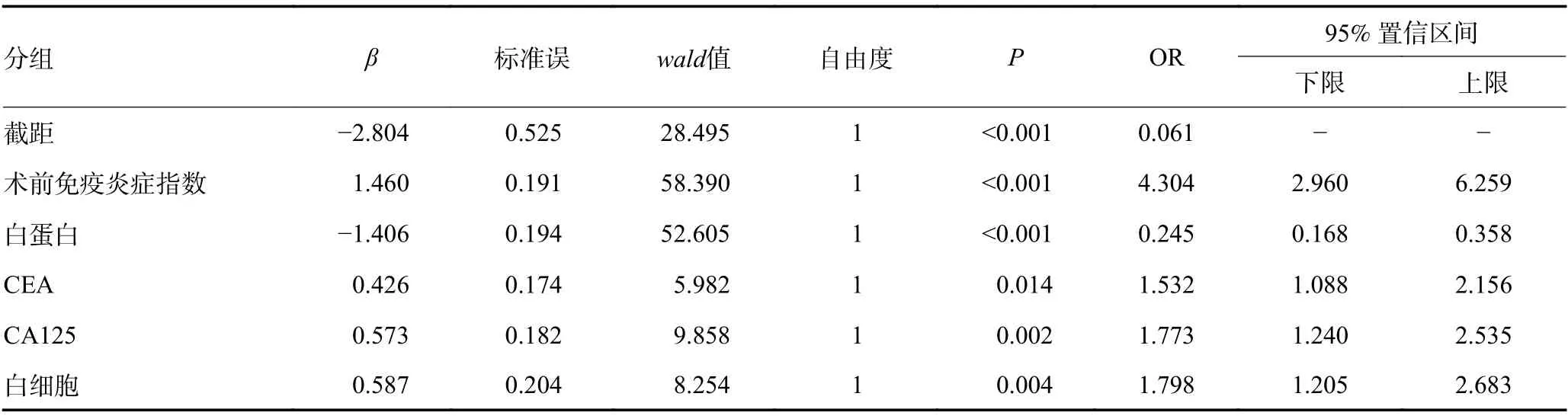
表3 SII、Alb、CEA、CA125、WBC在胃癌患者预后的相关性分析
3 讨论
研究表明,炎症反应在恶性肿瘤的发生、发展和转移中扮演着重要的角色[13]。一些生物标志物如C-反应蛋白、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、SII等与癌症患者预后密切相关,对监测癌症患者预后具有潜在的临床意义[14-15]。目前,关于SII对胃癌术后患者预后价值影响的研究相对较少,本研究在分析SII与胃癌患者预后的基础上,进一步探讨SII与胃癌不同TNM分期的关系及研究SII联合其他外周血检查指标对胃癌患者预后的评估效能。
单因素、多因素分析提示,年龄、组织学类型、ALb、CEA、CA125、WBC、SII、手术方式、TNM分期是OS的独立预后指标,具有重要的临床意义。TNM分期是公认的评估胃癌患者预后的重要指标[11],本研究结果也进一步证实TNM分期与胃癌患者预后的相关性。ROC曲线显示:SII的AUC=0.692(95%CI:0.651~0.732)较其他影响胃癌患者预后的独立危险因素的AUC高,组间比较差异具有统计学意义(P<0.05),表明SII作为一种新的预测胃癌患者预后指标,有望成为评估胃癌患者预后的工具。本研究还通过Logistic回归分析,将SII联合Alb、CEA、CA125、WBC,预测胃癌患者预后,结果表明SII联合Alb、CEA、CA125、WBC可显著提高预测效能,有望成为新的预测预后的手段。
本研究结果表明,SII与胃癌患者OS具有相关性,H-SII组胃癌患者OS时间明显缩短,5年OS率显著低于L-SII组(28.9% vs. 67.9%,P<0.001)。而Wang等[16]等通过回顾性分析444例胃癌患者行胃切除术的临床资料发现,H-SII组和L-SII组患者5年OS率分别为29.4%和46.1%,提示SII水平和胃癌患者预后相关,其结果与本研究相一致。韩帮岭等[17]也通过研究表明SII与胃癌患者预后密切相关,高水平SII提示胃癌患者的预后不良。此外,本研究通过分析SII在不同TNM分期中的预测能力,结果发现Ⅰ、Ⅱ、Ⅲ期中L-SII组的5年生存率明显高于H-SII组(分别为81.8% vs. 24.8%、56.5% vs. 21.2%、62.5% vs. 24.6%),差异具有统计学意义(P<0.05)。H-SII高表达代表着较高的NE和PLT以及较低的LY水平,意味着胃癌患者的免疫反应减弱、炎症反应增强,从而导致预后不良。SII影响胃癌患者预后可能包括以下几个方面:1)一些炎性细胞因子,如IL-1、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及集落刺激因子(colony stimulating factor,CSF)等可以募集大量的NE至肿瘤组织中,成为肿瘤相关NE。这些被激活的NE通过分泌多种生物活性分子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、IL-8等,可以局部诱导血管生成并导致纤维蛋白和纤维连接蛋白持续外渗,持续生成层外基质来促进肿瘤细胞的新陈代谢[18];2)LY是人体重要的肿瘤免疫系统成员,如CD3+、CD4+、NK细胞,其主要作用是抑制肿瘤细胞增殖和迁移,诱导肿瘤细胞凋亡。肿瘤组织中浸润的活化中性粒细胞会产生一氧化氮(NO)、活性氧(reactive oxygen species , ROS)、精氨酸酶(arginase,ARS)等因子,这些生物因子会影响T细胞的免疫功能,造成T细胞免疫功能下降,导致肿瘤细胞发生免疫逃逸[19];3)活化血小板中的α-颗粒可产生多种促进肿瘤生长的因子,如转化生长因子(transforming growth factor,TGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)等,TGF-α可以促进肿瘤细胞的有丝分裂[20];VEGF、PDGF等调节因子可以促进肿瘤血管的生成[21],为肿瘤供给养分,还可以呈递有助于肿瘤细胞穿透和扩散的蛋白酶和细胞因子。这些均可能是H-SII患者预后不良的原因。
本研究存在一定的局限性。一方面,这是高原地区胃癌患者的小样本回顾性研究;另一方面,NE、PLT以及LY在胃癌发生发展过程中的相关机制需进一步研究。因此,未来仍需进行更大规模的前瞻性研究,以确认本研究的初步结果。总之,SII因其具备简单、便于计算、可重复性、通用性、无创性、廉价等特点,有望成为评估胃癌患者预后的指标;同时SII在胃癌患者不同TNM分期中也同样具有一定的预测价值。

