左归丸含药血清调节Runx2激活ALP、OPN蛋白促进BMSCs增殖和分化的研究
刘飞祥 樊巧玲 谭峰 李星 麦聪英 叶素敏 张明玥 柴毅 吴丹
南京中医药大学中医学院·中西医结合学院,江苏 南京210023
骨质疏松(osteoporosis,OP)是一种慢性、持续存在的全身性骨骼疾病,其主要特征为骨量减少、骨微观结构改变以及骨脆性增加[1]。OP及OP性骨折易发生在55岁以上妇女和65岁以上男性中,其较高的致残率和致死率,严重影响了患者的生活质量和生命安全。骨质疏松流行病学调查显示,我国60岁以上女性2型糖尿病患者OP患病率高达40.1%,60岁以下患病率为26.5%,而北京市绝经后妇女患者的椎体骨折的患病率从60岁以下的13%上升到80岁以上的50%[2-3]。结合我国人口基数大和社会步入老龄化阶段的实际情况,OP及OP性骨折将对医疗卫生事业带来巨大的挑战。左归丸出自《景岳全书·新方八阵》,由菟丝子、山药、枸杞子、鹿角胶、熟地黄、山茱萸、龟甲胶和川牛膝八味药物,治疗“真阴肾水不足……或腰酸腿软,精髓内亏、津液枯涸等证”。实验表明[4-5],左归丸能显著提高去卵巢大鼠骨密度水平,改善骨显微结构,同时也能明显促进骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)向成骨细胞方向分化,然而其分子机制尚未完全阐明。本研究拟进一步探讨左归丸促进BMSCs增殖和向成骨细胞分化的分子机制,明确左归丸补肾壮骨的作用机理,为其临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物和细胞:20只8周龄SPF级SD大鼠均由南京市青龙山动物繁殖中心提供,合格证号为SCXK(SU)2017-0001,动物在南京中医药大学动物实验中心喂养。本研究的骨髓间充质干细胞来自课题组的自提细胞,其形态、表面抗体及向成骨、成脂细胞方向分化的能力已在前期实验中鉴定完毕[5]。本次动物实验研究方案获得南京中医药大学动物伦理委员会的同意(伦理号:201803A002)。
1.1.2中药:菟丝子、山药、枸杞子、鹿角胶、熟地黄、山茱萸、龟甲胶和川牛膝购买于南京中医药大学国医堂,药材质量均为合格产品。
1.1.3试剂和仪器:BCIP/NBT碱性磷酸酶显色试剂盒、碱性磷酸酶(AKP)测试盒购自上海碧云天生物技术有限公司(批号:C3206,P0321 S);Rabbit anti-Runx2,Rabbit anti-ALP,Anti-Osteocalcin(OPN)和Actin由Abcam生物科技有限公司提供(批号分别为:ab76956,ab154100,ab133612,ab8226);胎牛血清(FBS)由以色列BI公司提供(批号:01-042-1ACS);β-甘油磷酸钠、地塞米松、维生素C购买自Sigma公司(批号分别为:50020,D4902,1043003)。
EnSpire型酶标仪(美国PerkinElmer);imagequant las 4000型超灵敏化学发光成像仪(美国GE通用);Mini-protean Tetra 型Bio-rad蛋白电泳仪/伯乐小型垂直电泳槽(美国 伯乐)。
1.2 方法
1.2.1药物制作:中药(龟甲胶和鹿角胶除外)粉碎后分别煎煮2 h,然后过滤浓缩,烊化龟甲胶和鹿角胶,上Freeze Dryers冻干机-50 ℃干燥48 h,低温干燥保存。
1.2.2含药血清制备:20 只大鼠常规饲养7 d后分别给予ZGW灌胃(4.6 g/kg冻干粉)和等体积纯水灌胃7 d(n=10只)。末次给药2 h后,取全血,在4 ℃冰箱静置4 h,3 000 r/min离心 15 min,然后血清过滤、除菌、灭活,-80 ℃保存备用。
1.2.3试剂配制:10% FBS DMEM:89 mL DMEM培养液,10 mL FBS,1 mL青链霉素。成骨诱导液:89 mL DMEM培养液,10 mL大鼠BMSCs专用胎牛血清,1 mL青链霉素,10 mmol/Lβ-甘油磷酸钠,10-7mol/L地塞米松,50 μg维生素C。2.5%空白大鼠血清-成骨诱导液组:86.5 mL DMEM培养液,10 mL大鼠BMSCs专用胎牛血清,2.5 mL空白组大鼠血清,1 mL青链霉素,10 mmol/Lβ-甘油磷酸钠,10-7mol/L地塞米松,50 μg维生素C。2.5%左归丸含药血清-成骨诱导液:86.5 mL DMEM培养液,10 mL大鼠BMSCs专用胎牛血清,2.5 mL左归丸灌胃组大鼠血清,1 mL青链霉素,10 mmol/Lβ-甘油磷酸钠,50 μg维生素C,10-7mol/L地塞米松。
1.2.4含药血清对BMSCs的增殖实验:按照0.25×104/孔的密度,将P3 BMSCs接种于7个96孔板中。将细胞分为10% FBS DMEM组(Control)、成骨诱导液组(OIS)、2.5%空白大鼠血清-成骨诱导液组(ROIS)、2.5%左归丸含药血清-成骨诱导液组(ZGWOIS),并给予相应药物干预,每组设置5个复孔,4个空白孔。将细胞置培养箱分别孵育1、2、3、5、7、9、11 d,每孔分别加入50 μL 1×MTT试剂,置细胞培养箱孵育4 h,然后吸取培养液,加150 μL/孔DMSO,恒温箱中摇匀10 min,在酶标仪上以波长为550 nm进行检测。
1.2.5碱性磷酸酶法对细胞AKP检测:按照3×104/孔的密度,将P3 BMSCs接种于6孔板。10% FBS DMEM孵育细胞融合到70%左右,细胞分组同上,分别给予相应药物干预,每组设置3个复孔,2个空白孔,每2 d更换培养液,在第3、7天时,取细胞上层培养液,按照操作流程检测培养液中的AKP浓度。
1.2.6碱性磷酸酶钙钴染色:按照3×104/孔的密度,将P3 BMSCs接种于6孔板。10% FBS DMEM孵育细胞融合到70%左右,细胞分组同上,并给予相应的药物干预。每组设置3个复孔,2个空白孔,每2 d更换培养液,第7天吸取培养液,PBS洗涤2次,10%多聚甲醛固定1 h,PBS洗涤2次,按照0.5 mL/孔的体积吸取碱性磷酸酶钙钴染色液覆盖6孔,避光染色30 min,双蒸水缓慢冲洗,倒置相差显微镜观察。
1.2.7Western bloting检测BMSCs中相关蛋白的水平:按照3×104/孔的密度,将P3 BMSCs接种于6孔板。10% FBS DMEM孵育细胞融合到70%左右,细胞分组同上,分别给予相应的药物干预。每组设置3个复孔,2个空白孔,置37 ℃5% CO2细胞培养箱孵育,每2~3 d更换培养液,第7天吸取培养液,PBS洗涤2次,按照150 μL/孔的比例加入裂解液提取总蛋白。然后检测蛋白浓度,用SDS-PAGE分别分离出总蛋白,并转移至PVDF膜中。分别给予兔抗Runx2(1∶1 000)、兔抗ALP(1∶1 000)、兔抗OPN(1∶1 000)和兔单克隆-actin蛋白(1∶2 000)孵育8 h。PBST清洗3次后,分别使用山羊抗小鼠IgG(1∶2 000)或山羊抗兔IgG(1∶2 000)在摇床上孵育2 h。用PBST清洗3次后进行曝光,Image J软件分析和检测灰度值,actin作为参考标准。
1.3 统计学分析

2 结果
2.1 对BMSCs增殖的影响
与Control组比较,OIS、ROIS和ZGWOIS组中BMSCs的生长曲线呈S形,符合BMSCs的生理特性。与Control组比较,从第3天开始,OIS、ROIS和ZGWOIS组中的BMSCs增殖速度加快,提前进入平台期,ZGWOIS组的细胞增殖能力优于其他两组(图1)。
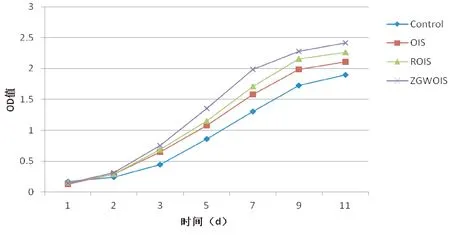
图1 ZGW对不同组别BMSCs增殖的影响Fig.1 Effect of ZGW on BMSCs proliferation
2.2 对细胞中AKP含量的影响
与Control组比较,在孵育3 d时,OIS组AKP未见明显升高,差异没有统计学意义。在孵育7 d时,与OIS组相比,ZGWOIS组培养液中AKP含量显著升高,差异具有统计学意义(P<0.01),而ROIS组中AKP含量未见明显升高(表1)。

表1 左归丸对不同组别AKP的影响Table 1 Effect of ZGW on AKP
2.3 对碱性磷酸酶钙钴染色的影响
与Control组比较,OIS组的染色明显较深;与OIS组比较,ZGWOIS组BMSCs中的染色明显较深,ROIS组未见明显差异(图2)。

图2 左归丸对不同组别BMSCs碱性磷酸酶钙钴染色的影响(×40)Fig.2 Effect of ZGW on alkaline phosphatase calcium cobalt staining in BMSCs (×40)注:A:10% FBS DMEM组;B:成骨诱导液组;C:2.5% 空白大鼠血清-成骨诱导液组;D:2.5%左归丸含药血清-成骨诱导液组。
2.4 对BMSCs中Runx2、ALP和OPN蛋白的影响
与Control组相比较,OIS组中Runx2、ALP和OPN蛋白明显升高,差异有统计学意义(P<0.01)。与OIS组相比,ZGWOIS组中Runx2、ALP和OPN蛋白明显升高,而ROIS组中Runx2、ALP和OPN蛋白未见明显变化(图3,表2)。

图3 ZGW对不同组别BMSCs中Runx2、ALP和OPN蛋白的影响(n=3)Fig.3 Effect of ZGW on proteins of Runx2, ALP, and OPN in BMSCs (n=3)注:A:10% FBS DMEM组;B:成骨诱导液组;C:2.5% 空白大鼠血清-成骨诱导液组;D:2.5%左归丸含药血清-成骨诱导液组。
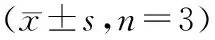
表2 ZGW对不同组别BMSCs中Runx2、ALP和OPN蛋白的影响
3 讨论
OP属于中医“骨痿”“骨枯”等疾病范畴,其病机多属肾精亏虚,治法以补肾填精、益髓壮骨为主。多项临床试验表明[6-8],左归丸能显著改善OP患者的腰背疼痛、腰部功能障碍等症状,提高机体骨密度水平,降低OP性骨折发生的风险。而动物实验发现[9],左归丸可显著降低大鼠血清中Ⅰ型胶原交联羧基端肽和抗酒石酸碱性磷酸酶b水平,提高血清中ALP、骨钙素和骨保护素含量,调节骨保护素/核因子κB受体激活因子配体/核因子κB受体活化因子等多条通路,从而增加骨密度,改善骨显微结构水平。这些研究明确了左归丸对骨调控的分子机制,阐释了中医“髓养骨”的科学内涵,丰富了中医“肾主骨生髓”的藏象理论。
BMSCs一方面参与骨髓环境构建,并可分化为成骨细胞、成软骨细胞,为骨形成提供细胞来源;另一方面,BMSCs由其分化而来的成骨细胞一起参与调节破骨细胞的分化、成熟和凋亡,从而调节骨代谢的平衡[10-11]。Runx2是骨骼发育的重要转录因子,在BMSCs、成骨细胞系细胞和软骨细胞中表达,其通过调节Ihh基因表达来调节软骨细胞增殖,决定了软骨细胞是形成暂时性软骨还是永久性软骨[12]。Runx2对成骨细胞分化至关重要,是骨祖细胞增殖所必需的。一方面,Runx2能够诱导软骨内骨祖细胞向前成骨细胞分化[13];另一方面,Runx2诱导Sp7表达,促进前成骨细胞分化为未成熟成骨细胞,以及通过直接调节Fgfr2和Fgfr3的表达来诱导骨祖细胞的增殖[14]。此外,Runx2通过诱导hedgehog、Fgf、Wnt和Pthlh信号通路基因在骨中的表达,从而诱导间充质细胞的增殖并向成骨细胞系细胞分化[15]。OPN是一种分泌性磷蛋白,是细胞基质蛋白小整合素结合配体N-连接糖蛋白家族的成员,参与多种生物活性。研究表明[16],OPN在骨代谢和体内平衡中起着重要作用,其不仅是神经元介导和内分泌调节骨量的重要因子,而且参与多种骨相关细胞,包括BMSCs、破骨细胞和成骨细胞的增殖、迁移和粘附等生物学活动。骨桥蛋白已被证实与许多骨相关疾病的发生和发展密切相关,如骨质疏松症、类风湿关节炎和骨肉瘤[17]。ALP是生物矿化的重要组成部分,由骨质中分泌出来的,是成骨细胞表型标志物之一[18]。研究显示,在BMSCs向成骨细胞分化以及成熟的过程中Runx2基因激活骨基质蛋白,如ALP、OPN、骨涎蛋白等的表达,并调控骨形成的进程[19-20]。本研究发现,左归丸含药血清能够显著上调BMSCs细胞中Runx2、ALP和OPN蛋白的表达,效果优于单独使用成骨诱导液,而空白组大鼠血清对相关蛋白未见明显影响。基于Runx2蛋白对ALP和OPN的上游调控作用,说明左归丸含药血清是通过调节Runx2蛋白表达,激活ALP和OPN的表达,从而促进BMSCs的增殖和向成骨细胞方向分化。
综上所述,左归丸通过激活Runx2蛋白,上调ALP和OPN蛋白的表达,促进了BMSCs的增殖和向成骨细胞方向分化,这从分子层面为阐释左归丸“补肾填精、益髓壮骨”抗骨质疏松症的主要作用机制提供了一定的参考依据。

