积雪草苷通过TGF-β/Smads通路对BMSCs成骨分化的影响
曹振宇 沈晓钟 马建武 郑峰
青海省人民医院骨科,青海 西宁 810000
骨质疏松症(osteoporosis,OP)是骨质质量和微结构的恶化,导致骨组织脆性增加,从而提高骨折发生几率[1]。研究表明,OP患者的骨流失是骨形成减少和骨吸收增加引起的,成骨分化形成可受多种转录因子和信号通路的调控[2-3]。近年来,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)因其具有强大分化能力而成为治疗OP的一个很有前途的工具细胞[4]。BMSCs是典型的具有自我更新能力的间充质干细胞,可分化为成骨细胞,可能是骨组织工程的潜在细胞来源,因此,诱导BMSCs成骨分化对于骨再生应用与临床上治疗OP具有重要意义[5-6]。
积雪草是一种伞形科积雪草属植物,积雪草苷是从积雪草中提取的一种白色针状结晶物,主要成分是三萜皂苷[7]。积雪草苷长期以来被认为是一种伤口愈合剂,同时具有抗炎、抗纤维化、促进创伤愈合、抑制瘢痕形成、抗肿瘤、免疫调节等作用[8]。积雪草苷已被证明对细胞成骨分化有显著的积极影响[9],有研究发现积雪草苷通过TGF-β/Smad通路抑制增生性瘢痕和瘢痕疙瘩的形成,对糖尿病相关认知功能障碍具有保护作用[10]。但未发现有关积雪草苷诱导BMSCs成骨分化作用的相关研究。因此,本实验通过TGF-β/Smads通路研究积雪草苷能否促进BMSCs成骨分化,为临床上治疗OP提供实验基础。
1 材料与方法
1.1 材料
1.1.1实验细胞:BMSCs购自中国科学院典型培养物保藏委员会细胞库。
1.1.2试剂:积雪草苷购自北京索莱宝科技有限公司,纯度≥98%;CCK-8试剂购自上海碧云天生物技术有限公司;TGF-β1、Smad2、p-Smad2、Smad3和p-Smad3和β-actin抗体均购自艾博抗(上海)贸易有限公司;ALP、OPN和OCN引物购自生工生物工程(上海)股份有限公司;Annexin V-APC/PI荧光双染细胞凋亡检测试剂盒购自武汉普诺赛生命科技有限公司;一步法RT-qPCR试剂盒购自湖南艾科瑞生物工程有限公司。
1.1.3仪器:Infinite M200酶标仪(瑞士帝肯)、CKX53倒置显微镜(日本奥林巴斯)、多功能凝胶成像仪(美国Bio-Rad公司)、蛋白质电泳仪(美国Bio-Rad公司),Cytoflex流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 实验方法
1.2.1细胞培养:将BMSCs置于完整的培养基(L-DMEM培养基+10%胎牛血清+1%青链霉素双抗)。细胞培养条件为37 ℃,5%CO2。当细胞融合度达到80%~90%时,按1∶2的比例进行消化传代2~3代,待细胞进入生长对数期后备用,细胞培养代数不能超过10代。
1.2.2细胞毒性实验:取生长对数期的BMSCs消化重悬,将100 μL细胞悬液(1×104个/mL)加入96孔板。在5% CO2、37 ℃条件下培养12 h,然后用不同浓度的积雪草苷(0、5、10、20、30、40 μmoL/L)处理,每个浓度设3个重复孔,培养48 h。培养完成后在每个孔中加10 μL CCK 8试剂。孵育2 h后,用酶标仪测定每组细胞在450 nm波长下的OD值。
1.2.3细胞凋亡检测:取生长对数期的BMSCs消化重悬,以5×105个/mL浓度种植至6孔板中,在5% CO2、37 ℃条件下培养过夜,然后用不同浓度的积雪草苷(0、5、10、20、30、40 μmoL/L)处理,每个浓度设3个重复孔,培养48 h,收集细胞,按试剂盒说明书操作,使用流式细胞仪检测细胞凋亡情况。
1.2.4细胞分组:机制探索实验分成两部分,第一部分分成2组:空白对照组与积雪草苷组(20 μmoL/L);第二部分分成3组:空白组对照组、积雪草苷组(20 μmoL/L)与抑制组(20 μmoL/L积雪草苷+50 moL/L SB-431542)。
1.2.5细胞成骨分化检测:将BMSCs按1.2.4进行分组,以1×104个/mL浓度种植至12孔板中,待细胞贴壁后进行药物处理12 d,每3 d更换一次培养液,药物干预完成后用PBS洗涤2次,加入4%多聚甲醛在37 ℃下固定30 min,然后用1%茜素红染色30 min,观察钙化结节的形成情况。
1.2.6细胞中TGF-β1、ALP、OPN和OCN基因表达水平的检测:将BMSCs按1.2.4进行分组与药物干预12 d后,按照试剂盒说明书试剂盒提取细胞总RNA,进行逆转录得到cDNA并进行扩增,qPCR扩增过程为:95 ℃变性30 s,62 ℃退火15 s,72 ℃延伸10 s,45个循环,以β-actin作为内参基因,以2-ΔΔCT反映细胞中TGF-β1、ALP、OPN和OCN基因表达水平。
1.2.7蛋白质印迹(Western blot):收集各组细胞,使用RIPA裂解缓提取总蛋白并进行定量,依次进行10% SDS-PAGE凝胶电泳(上样量为40 μg)、转移到PVDF膜、置于5%脱脂奶粉溶液中室温封闭2 h,4 ℃过夜孵育一抗:TGF-β1(1∶1000)、Smad2(1∶1000)、p-Smad2(1∶1000)、Smad3(1∶1000)和p-Smad3(1∶1000)和β-actin(1∶1500)。漂洗干净后在室温中孵育二抗(1∶5000)2 h,使用ECL法进行显影后置于凝胶成像系统中曝光拍照,计算目的蛋白表达水平。
1.3 统计学分析
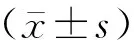
2 结果
2.1 积雪草苷对BMSCs增殖、凋亡率的影响
与0 μmoL/L组相比,5、10、20 μmoL/L积雪草苷对BMSCs均无抑制与促凋亡作用(P>0.05),30、40 μmoL/L积雪草苷均能降低BMSCs细胞增殖率,升高细胞凋亡率(P<0.01),因此后续实验以20 μmoL/L积雪草苷为最大无毒浓度。结果见表1,图1。

表1 不同浓度积雪草苷对BMSCs增殖率的影响
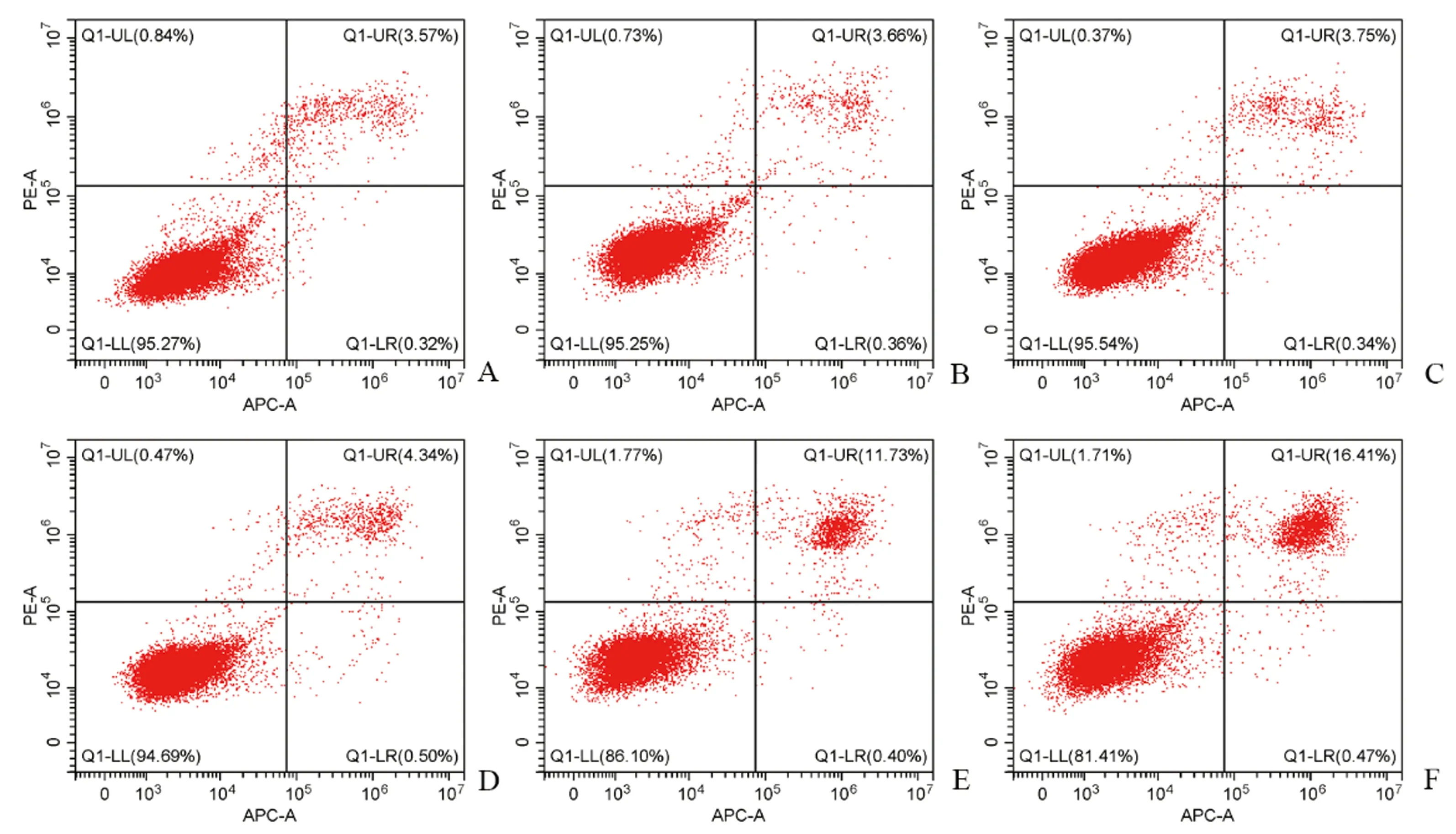
图1 不同浓度积雪草苷对BMSCs凋亡率的影响Fig.1 Effect of different concentrations of asiaticoside on apoptosis rate of BMSCs注:A、B、C、D、E、F分别代表0、5、10、20、30、40 μmoL/L浓度的积雪草苷。
2.2 积雪草苷对BMSCs成骨分化的影响
20 μmoL/L积雪草苷对BMSCs进行诱导培养12 d后,茜素红染色发现积雪草苷组矿化结节数目明显多于空白对照组。茜素红染色结果见图2。
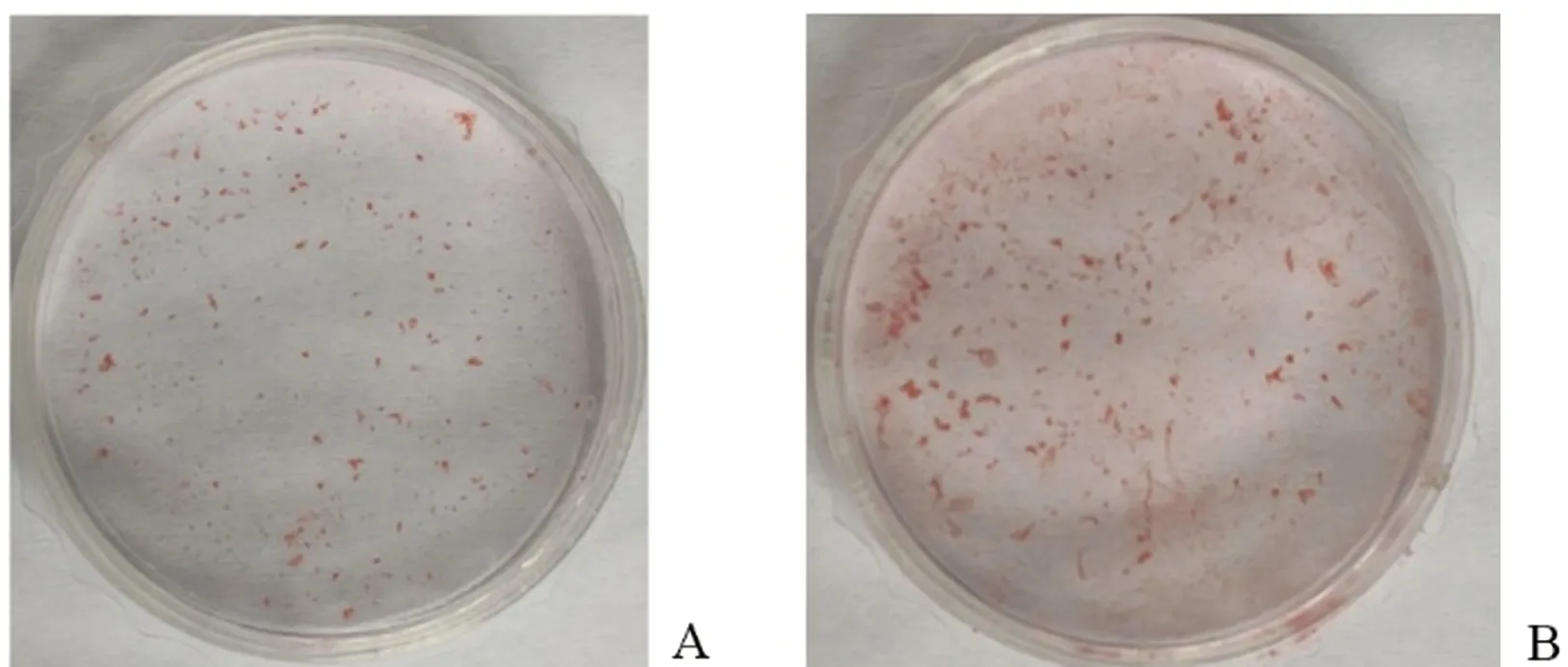
图2 不同浓度积雪草苷对BMSCs成骨分化的影响(茜素红染色)Fig.2 Effect of asiaticoside on osteogenic differentiation of BMSCs (Alizarin red staining)注:A、B分别代表0、20 μmoL/L积雪草苷处理(图中红点为矿化结节)
2.3 积雪草苷对BMSCs成骨分化基因表达的影响
与空白对照组相比,积雪草苷组细胞中ALP、OPN和OCN基因表达水平升高(P<0.05或P<0.01)。详见表2。

2.4 积雪草苷对BMSCs中TGF-β/Smads通路的影响
与空白组相比,积雪草苷组细胞中TGF-β1、p-Smad2和p-Smad3的蛋白表达水平升高(P均<0.01),Smad2与Smad3蛋白表达水平没有变化(P均>0.05),详见表3、图3。

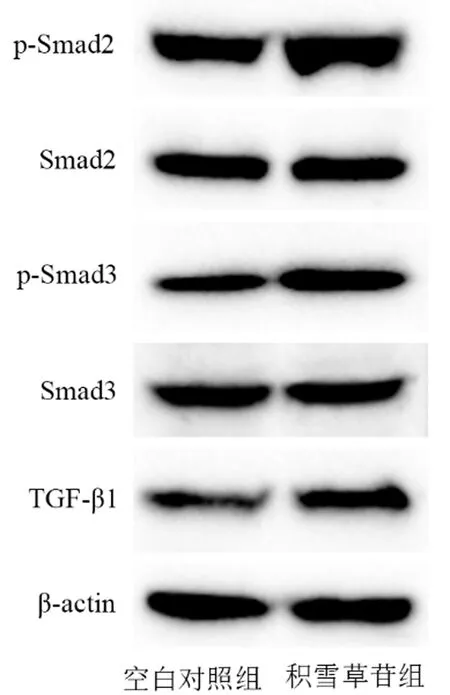
图3 不同组别积雪草苷对BMSCs中TGF-β1、Smad2、p-Smad2、Smad3和p-Smad3蛋白表达水平的影响Fig.3 Effects of asiaticoside on protein expression levels of TGF-β1, Smad2, p-Smad2, Smad3, and p-Smad3 in BMSCs
2.5 抑制TGF-β/Smads通路后积雪草苷对BMSCs骨分化的影响
与空白对照组相比,积雪草苷组细胞中TGF-β1、ALP、OPN和OCN基因表达水平升高(P均<0.01)。与积雪草苷组相比,抑制组细胞中TGF-β1、ALP、OPN和OCN基因表达水平降低(P<0.05或P<0.01)。详见表4。

表4 抑制TGF-β/Smads通路后积雪草苷对BMSCs中TGF-β1、ALP、OPN和OCN基因表达的影响Table 4 Effects of asiaticoside on TGF-β1, ALP, OPN and OCN gene expression in BMSCs after inhibition of TGF-β/
茜素红染色发现,肉眼观察3组矿化结节数目,积雪草苷组最多,抑制苷组次之,空白对照组最少。染色结果见图4。

图4 积雪草苷对BMSCs成骨分化的影响(茜素红染色)Fig.4 Effect of asiaticoside on BMSCs osteogenic differentiation (Alizarin red staining)注:A、B、C分别代表0、20 μmoL/L积雪草苷处理、50 nmoL/L SB-431542+20 μmoL/L积雪草苷处理
与空白对照组相比,积雪草苷组细胞中TGF-β1、p-Smad2和p-Smad3的蛋白表达水平升高(P均<0.01),Smad2与Smad3蛋白表达水平没有变化(P均>0.05);与积雪草苷组相比,抑制组细胞中TGF-β1、p-Smad2和p-Smad3蛋白表达水平降低,差异具有统计学意义(P<0.05),Smad2与Smad3蛋白表达水平无明显变化(P>0.05)。详见表5、图5。
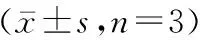
表5 抑制TGF-β/Smads通路后积雪草苷对BMSCs中TGF-β1、Smad2、p-Smad2、Smad3和p-Smad3基因表达的影响
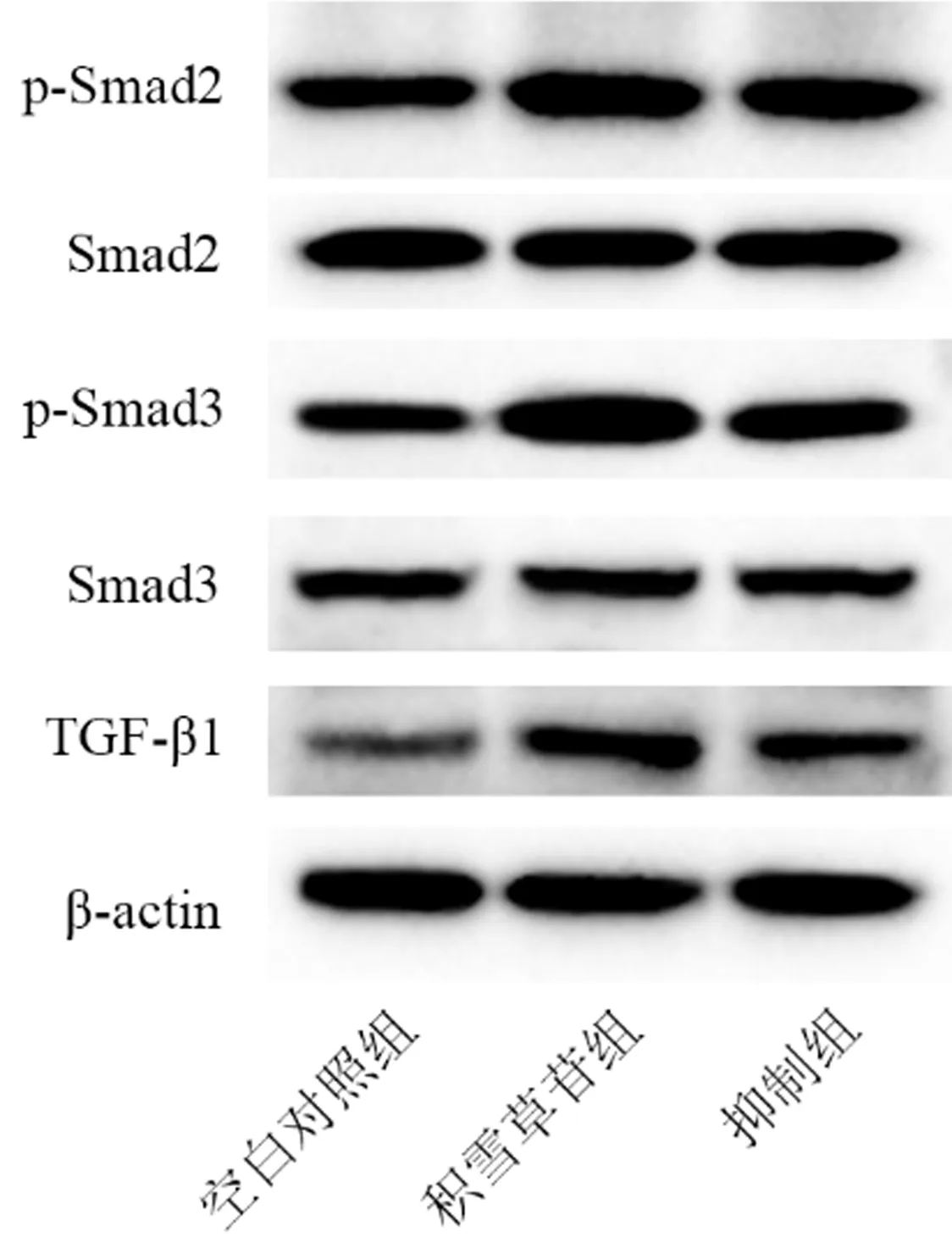
图5 抑制TGF-β/Smads通路后积雪草苷对BMSCs中TGF-β1、Smad2、p-Smad2、Smad3和p-Smad3蛋白表达水平的影响Fig.5 Effects of asiaticoside on the protein expression levels of TGF-β1, Smad2, p-Smad2, Smad3, and p-Smad3 in BMSCs after inhibition of TGF-β/Smads pathway
3 讨论
BMSCs是骨髓微环境中的细胞组分之一,是骨细胞、软骨细胞和其他类型的细胞的祖细胞,这些细胞参与了骨骼组织、造血支持基质和脂肪组织的形成[11-12],与调节造血、免疫、成骨等生理功能密切相关[13]。目前研究发现,BMSCs移植被认为是治疗OP的一个有前途的策略,同种异体和自体BMSCs均有效[14-15]。BMSCs向脂肪细胞的偏分化可能导致成骨细胞的减少和OP发病增加。因此,各种可促进BMSCs成骨分化的调控因子可能是治疗OP的潜在治疗药物[16-17]。本研究发现积雪草苷对BMSCs具有良好的诱导成骨分化能力,对TGF-β/Smads通路也有一定的调节作用,是一种治疗OP的潜在药物。
众所周知,TGF-β1是调节多种生理功能的关键因子之一。例如,TGF β1可以通过重组细胞骨架使祖细胞进入成脂或成骨细胞谱系,从而提高间充质干细胞的成骨能力[18-19]。多种类型细胞及不同成熟阶段的成骨细胞均能合成和分泌OPN,是成骨细胞分化成熟的标志[20]。ALP与OCN都是骨分化成熟的标志,作为成骨细胞的标记基因,ALP在早期成骨中发挥重要作用[21],ALP在未成熟的骨前体细胞中不表达,但随着成骨分化,ALP的表达逐渐增加[22]。ALP产生磷酸钙沉积在成熟成骨细胞中,促进成骨矿化,而OCN是参与矿化调控的最丰富的蛋白[23]。在本实验中,BMSCs经积雪草苷处理12 d后,TGF-β1、OPN、ALP与OCN的基因表达量升高,细胞成骨分化后矿化结节形成数量增加,说明BMSCs细胞出现成骨分化且程度较高,证明积雪草苷对BMSCs细胞骨分化具有明显诱导作用,其中涉及的机制需要进一步实验进行验证。
Smads蛋白是TGF-β超家族成员信号转导的关键,Smad2/3作为TGF-β的下游信号蛋白分子,可以通过与转录调控因子相互作用来调控靶基因的活性[24-25]。既往研究表明,OP患者外周血中TGF-β1表达降低,说明TGF-β/Smads通路对OP进程有密切联系[26],然而,积雪草苷诱导BMSCs细胞成骨分化的效果与TGF-β/Smads通路之间的联系还不明确。本实验首先使用SB-431542抑制BMSCs细胞中的TGF-β/Smads通路,再使用积雪草苷进行干预,发现积雪草苷在TGF-β/Smads通路处于抑制状态的情况下仍然能发挥诱导骨分化的效果,细胞中TGF-β1、p-Smad2和p-Smad3蛋白表达水平升高,Smad2与Smad3蛋白表达水平无明显变化,说明积雪草苷能增加TGF-β1表达,促进Smad2、Smad3磷酸化,对抗抑制剂产生的TGF-β/Smads通路抑制效果,从而诱导TGF-β1、OPN、ALP与OCN基因表达,促进成骨分化形成钙化结节。
综上所述,本实验证明了积雪草苷具有诱导骨髓间充质干细胞骨分化的潜力,可能涉及的机制为激活细胞中TGF-β/Smads通路,上调OPN、ALP与OCN基因表达量,帮助骨髓间充质干细胞完成成骨分化。

