野生型及突变型人Toll 样受体23′非编码区基因重组质粒的构建及鉴定
包丽丽,孙传凯,李晓玫,任向宇,殷兆丽,孙晓琳,福泉,纳仁高娃
1.内蒙古医科大学基础医学院,内蒙古 呼和浩特 010059;2.内蒙古医科大学附属医院,内蒙古 呼和浩特 010050
Toll 样受体(Toll-like receptor,TLR)作为固有免疫识别受体,在识别病原相关分子模式(pathogenassociated molecular patterns,PAMPs)和激活免疫应答中发挥了关键作用[1]。TLR 是由结合和识别PAMPs的胞外结构域及与白细胞介素-1(interleukin-1,IL-1)受体胞质区同源的胞内结构域组成[2]。目前,已发现人体存在的TLR 家族有10 个亚型(TLR1~TLR10)[3],其中TLR3、TLR7、TLR8 和TLR9 定位在胞内,可识别病毒的DNA 或RNA;TLR1、TLR2、TLR4、TLR5 和TLR6 表达于细胞表面,识别胞外细菌和真菌的细胞壁成分及一些病毒蛋白[3-4]。TLR2 可在与黏膜免疫和耐受相关的细胞上表达,包括肠上皮细胞(intestinal epithelial cells,IECs)、树突状细胞(dendritic cells,DCs)、T 细胞和B 细胞[5]。有研究表明,TLR2 可识别细菌和真菌细胞壁成分[6-7],但必须与TLR1、TLR6 结合形成异源二聚体,即TLR1/2 和TLR2/6,这两种TLR2 异源二聚体通过MyD88 依赖的信号通路导致NF-κB 的转录激活[8-9]。也有研究表明,TLR2 在心血管疾病、风湿免疫性疾病、肿瘤等疾病的发生、发展、预后均有一定作用[10]。
miRNA 是一种内源性、非编码小分子RNA,通过抑制表达或降解mRNA 的方式参与调控宿主的多种生理和病理过程,其与靶mRNA 3′非编码区(3′UTR)相结合,可抑制mRNA 的转录后翻译过程[11]。研究发现,多种miRNA 可靶向结合TLR23′ UTR 区,通过调控TLR2 影响其下游信号通路及免疫反应,在不同程度上改变机体对病原的抵抗能力,从而影响多种疾病的发生、发展及预后[12-13],但相关作用机制尚未明确。因此本研究采用PCR 突变技术构建TLR23′UTR 野生型和突变型重组质粒,以期为TLR2功能的深入研究提供实验依据。
1 材料与方法
1.1 细胞、质粒及菌株 293T 细胞购自ATCC;载体pmiR-RB-REPORTTM购自广州锐博生物科技有限公司;感受态E.coli DH5α 由内蒙古医科大学基础医学院病原生物与免疫学实验室保存。
1.2 主要试剂 DNA 纯化回收试剂盒和质粒提取试剂盒均购自天根生化科技(北京)有限公司;DNA聚合酶、限制性内切酶XhoⅠ、NotⅠ及DNA 连接酶均购自美国Thermo 公司;DL2000 DNA marker 购自北京聚合美生物科技有限公司。
1.3 引物设计及合成 根据GenBank 中登录的TLR2 mRNA 的全序列(NM_003264.3),应用Primer premier 5.0 软件设计野生型TLR23′UTR 的引物,野生型上游引物(F-w):5′-GGCGGCTCGAGGATAAAGTCCTAGGTTCCCAT-3′(下划线部分为XhoⅠ酶切位点),下游引物(R-w):5′-AATGCGGCCGCAGA-CAGATCCAGATCACAT-3′(下划线部分为NotⅠ酶切位点),扩增产物大小为880 bp;根据TLR23′UTR 与miR-122的预测结合靶点,设计突变型TLR23′ UTR 扩增引物,突变型上游引物(F-m):5′-ATTTGGGGGTGAGGCCAAAACTTGTTGCTATT-3′(下划线部分为靶序列突变位点),下游引物(R-m):5′-AGTTTTGGCCTCACCCCCAAATACTTTGCCTT-3′(下划线部分为靶序列突变位点)。引物由生工生物工程(上海)股份有限公司合成。
1.4 野生型TLR23′UTR 基因片段的扩增 用DNA质粒提取试剂盒提取293T 细胞的基因组DNA,以其为模板进行PCR 扩增TLR23′UTR 基因片段。PCR 反应体系为:5×Buffer 6 μL,dNTPs(2.5 mmol/L)2.4 μL,F-w/R-w(10 μmol/L)各1 μL,DNA 聚合酶(2 U/μL)0.3 μL,模板100 ng,灭菌蒸馏水补充体积至30 μL。PCR 反应条件为:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃再延伸3 min,4 ℃保存。PCR 产物经1.5%琼脂糖凝胶电泳分析。
1.5 野生型TLR23′UTR 重组质粒的制备 TLR23′UTR 基因PCR 产物采用DNA 纯化回收试剂盒纯化,产物经NotⅠ和XhoⅠ双酶切后,与经相同酶酶切的载体pmiR-RB-REPORTTM以DNA 连接酶于16 ℃连接30 min;连接产物转化至感受态E.coli DH5α,接种至LB(Amp+)固体培养板中,37 ℃过夜培养;挑取单菌落,进行菌落PCR 鉴定。PCR 反应条件为:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火45 s,72 ℃延伸1 min,共35 个循环;72 ℃再延伸3 min,4 ℃保存。PCR 产物经1.5%琼脂糖凝胶电泳分析。将阳性克隆送锐博生物科技有限公司(广州)测序。
1.6 突变型TLR23′UTR 重组质粒的构建 以野生型TLR23′ UTR 质粒为模板,分别扩增含突变序列的2 段序列。反应总体系为:5 × Phusion Buffer 6 μL,dNTP mix(2.5 mmol/L)2.4 μL,F-w/R-m(10 μmol/L)各1 μL,DNA 聚合酶(2 U/μL)0.3 μL,DNA 模板100 ng,用灭菌蒸馏水补足体积至30 μL。PCR 反应条件为:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸3 min。以R-w/F-m 为引物,相同体系和条件扩增。将扩增的2 段突变序列经电泳分析并纯化回收后,进行拼接,以其为模板,R-w/F-w 为引物进行PCR扩增,PCR 反应体系及反应条件同1.4 项。PCR 产物经1.5%琼脂糖凝胶电泳分析并纯化回收,同1.5项方法将突变序列连接至载体pmiR-RB-REPORTTM,连接产物转化至感受态E.coli DH5α,接种至LB(Amp+)固体培养板中,37 ℃过夜培养;挑取单菌落于LB(Amp+)液体培养基,37 ℃摇菌约14 h;挑取单克隆送锐博生物科技有限公司(广州)测序。
2 结果
2.1 野生型TLR23′UTR 基因片段的鉴定 野生型TLR23′UTR 基因PCR 产物经1.5%琼脂糖分析,可见880 bp 的目的基因条带,大小与预期一致,见图1。
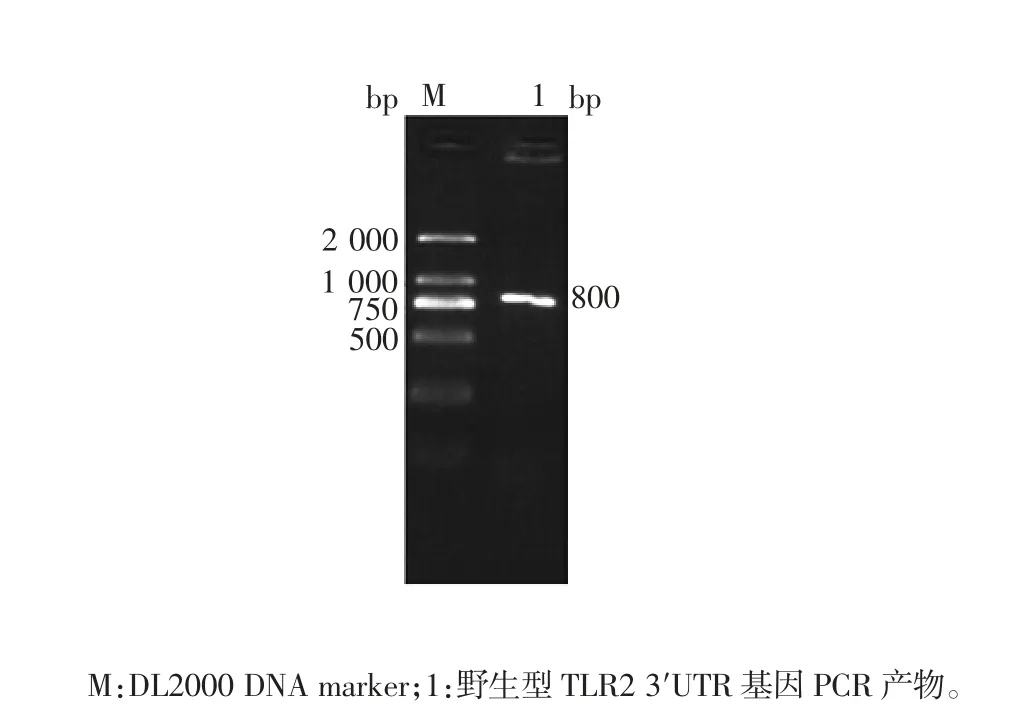
图1 野生型TLR23′UTR 基因PCR 产物电泳图Fig.1 Electrophoretic profile of PCR product of wild type TLR23′UTR gene
2.2 野生型TLR23′UTR 重组质粒的鉴定
2.2.1 菌落PCR 重组菌经菌落PCR 鉴定,可见1000bp 的目的基因片段,大小与预期相符,见图2。表明重组质粒构建正确。
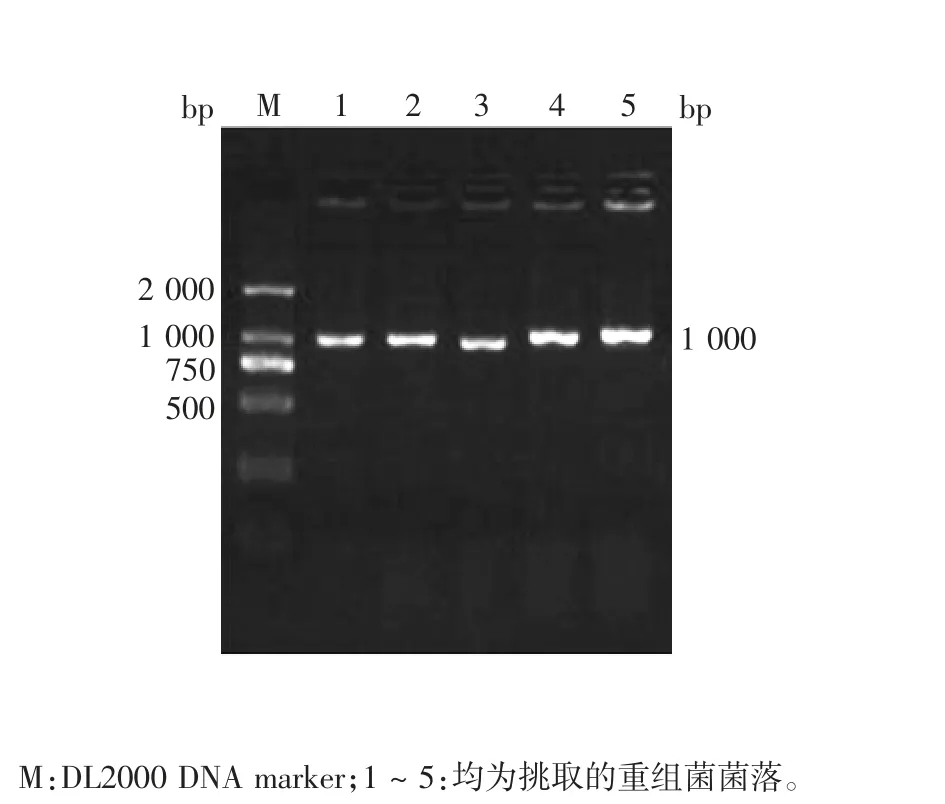
图2 野生型TLR23′UTR 重组菌的菌落PCR 鉴定Fig.2 Identificaton of recombinant E.coli with wild type TLR23′UTR by colony PCR
2.2.2 测序鉴定 测序结果显示,插入序列与TLR23′UTR 序列完全一致,见图3。再次证明重组质粒构建正确。

图3 野生型TLR23′UTR 重组质粒的测序结果Fig.3 Sequencing result of wild type recombinant plasmid with TLR23′UTR
2.3 突变型TLR23′UTR 重组质粒测序鉴定 测序结果表明,靶序列CACTCC 已更改为GTGAGG,见图4。表明突变型TLR23′UTR 重组质粒构建正确。
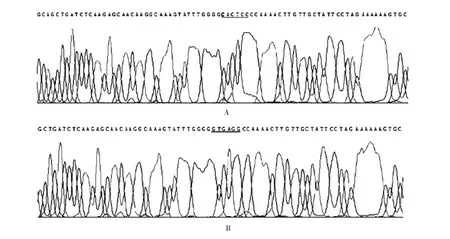
图4 野生型(A)及突变型TLR23′UTR 重组质粒(B)的测序图Fig.4 Sequencing of wild(A)and mutant(B)type recombinant plamids with TLR23′UTR
3 讨论
目前,有许多miRNA 可通过与TLR23′UTR 区结合影响TLR2 的表达,发挥基因调控作用,如miR-101可靶向结合TLR2 的3′UTR 区,抑制TLR2 的表达,与风湿性心脏病相关[14];miR-143 下调可降低TLR2的mRNA 和蛋白的表达,并通过此途径诱导细胞周期捕获[15];miR-143 还可通过调节TLR2 的表达抑制结直肠癌细胞的侵袭和转移[16];miR-154 通过靶向结合TLR2 可抑制结直肠癌细胞生长和迁移[17];TLR2 的激活可上调miR-125a-5p,调节巨噬细胞和炎症的激活[18]。以上研究结果提示,miRNA 对TLR2的调控与多种疾病的发生发展及转归密切相关。
miRNA-122 是肝脏中含量最丰富的miRNA,占总miRNA 的70%以上,在肝脏生理性发育过程中呈持续高表达,是参与肝脏生理性肝细胞分化、发育、细胞代谢和肝细胞免疫应答及肝细胞表型等的重要miRNA,同时在肝癌的病理过程中发挥着重要作用。TLR 在调节慢性炎症和免疫耐受方面发挥着关键作用,也参与了肿瘤的进展和发展。TLR2 可调节炎症细胞因子(IL-6、IL-1β 和IL-8)的产生,从而促进肿瘤细胞的迁移和侵袭[19-20]。TLR2 的激活可能会在肝细胞癌(hepatocarcinoma,HCC)癌变的早期阶段减缓HCC 的起始和发展,即具有抗癌的潜能;而TLR2的激活也可能影响炎症和纤维化的进展,即具有促癌的潜能[21]。表明miRNA-122 和TLR2 在体内感染的发展和控制中发挥重要作用。本课题组前期研究发现,TLR23′UTR 区存在与miRNA-122 靶向结合的位点,且二者在正常肝细胞和肝癌细胞中的表达呈负相关,为进一步分析二者可能的结合位点,本实验构建了野生型和突变型TLR23′UTR 重组质粒,以明确miRNA-122 与TLR2 的靶向关系及其在肝癌中的作用。经菌落PCR 鉴定及测序鉴定,表明本实验构建的野生型和突变型TLR23′UTR 重组质粒均构建正确。本实验构建的重组质粒为双荧光素酶报告质粒,今后会将miRNA-122 与构建的重组质粒共转染,可通过报告基因相对荧光值的变化来验证miRNA-122 与TLR23′UTR 的相互作用,更准确,更直观。本实验为TLR2 功能的深入研究提供了实验依据。
——一道江苏高考题的奥秘解读和拓展

