牛源金黄色葡萄球菌的分离鉴定及生物学特性分析
贾伟娟,张佳奇,张玲艳,何云江,郗珊珊,王学理
1.内蒙古民族大学动物科技学院,内蒙古 通辽 028042;2.吉林农业大学动物科学技术学院,吉林 长春 130033
牛猝死症是一种引起牛发生猝死的综合征,在不同国家和地区均有发生[1]。该病的病因较多且大多具有传染性,主要分为细菌性、病毒性、中毒性及营养代谢性[2]。其中,细菌感染引发的猝死症较为多见,主要病原菌有魏氏梭菌、腐败梭菌、多杀性巴氏杆菌及一些链球菌等[3]。
金黄色葡萄球菌为兼性厌氧的革兰阳性致病菌,是葡萄球菌中毒力最强的菌株[4]。该菌与人和动物的化脓性及毒素介导的感染有关,这些感染均由其产生的毒力因子所导致,可使其入侵机体并逃避机体免疫效应对宿主造成影响。凝固酶是最早发现的金黄色葡萄球菌毒力因子之一,已广泛用于区分金黄色葡萄球菌和其他葡萄球菌[5];该菌的其他毒素还可引起化脓性感染、菌血症、乳房炎及关节炎等人和动物多种疾病,严重的可导致猝死[6]。畜牧业是内蒙古自治区的支柱产业,牛群的健康直接影响本地区畜牧业的发展。为了解通辽市某西门塔尔牛养殖场多头牛猝死的原因,本研究从病死牛的病变组织中分离菌株,并进行鉴定,以期为本地区牛猝死症的流行病学调查及综合防控提供参考。
1 材料与方法
1.1 病畜 猝死牛由通辽市某西门塔尔牛养殖场提供。
1.2 菌株 表皮葡萄球菌[CMCC(B)26069]和金黄色葡萄球菌(CMCC26003)购自广东环凯微生物科技有限公司。
1.3 主要试剂及仪器 Baird-Parker 琼脂购自杭州微生物试剂有限公司;氯化钠及葡萄糖购自上海国药集团化学试剂有限公司;营养琼脂及蛋白胨购自上海博微生物科技有限公司;酵母浸粉购自瑞楚生物科技(江苏)有限公司;DL2000 DNA marker、2 × PCRMatermix、细菌基因组DNA 提取试剂盒、DNA 凝胶回收试剂盒均购自天根生化科技(北京)有限公司;药敏纸片购自赛诺利康生物技术(北京)有限公司;冻干兔血浆购自青岛海博生物科技有限公司;AST 肉汤培养基及BD PhoenixTM100 全自动微生物分析系统购自美国BD 医疗器械有限公司。
1.4 实验动物 SPF 级BALB/c 小鼠,15 只,28 日龄,体重25 ~ 30 g,购自辽宁长生生物技术股份有限公司,动物合格证号为:2018-0001。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,按照动物伦理相关规定进行。
1.5 细菌的分离及形态学观察 采用无菌操作从病死牛的心、肝、脾、肺、肾等病变脏器组织中取样,用接种环划线,接种至LB 固体培养板,于37 ℃培养12 h;挑取单菌落,经革兰染色、镜检,再经纯培养,获得分离菌株,进行后续检测。
1.6 分离菌株的Baird-Parker 氏培养板培养 挑取分离菌菌落,于Baird-Parkershi 氏培养板上划线,置37 ℃恒温箱培养12 h,观察菌落生长特征。
1.7 分离菌株的血浆凝固酶试验 参考文献[7]进行血浆凝固酶试验。将1 mL 稀释血浆(用生理盐水按1 ∶100 比例稀释)加入试管,再分别加入0.6 mL 的分离菌液、标准阴性菌株菌液(表皮葡萄球菌)和标准阳性菌株菌液(金黄色葡萄球菌),置37 ℃恒温箱中培养;每30 min 观察1 次,若血浆不发生凝集,继续培养过夜,观察结果。为避免出现假阳性,可将观察时间延长至24 h[8]。
1.8 分离菌株的生化鉴定 将分离菌浓度调至0.6个麦氏单位时,取25 μL,接种至AST 肉汤培养基,混匀,加至检测板内,置BD PhoenixTM100 全自动微生物分析系统中24 h,检测结果。
1.9 分离菌株的药敏检测 取100 μL 分离菌菌液,接种至LB 固体培养板上,涂布均匀。将11 种药敏纸片分别贴于培养板上,于37 ℃过夜培养,观察结果。
1.10 分离菌株的16S rRNA 同源性分析 参考文献[9]合成细菌16S rRNA 基因扩增引物,上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物:5′-AAGGAGGTGATCCAGCCGCA-3′,扩增片段大小为1496 bp[9]。用细菌基因组DNA 提取试剂盒提取分离菌DNA,以其为模板进行PCR 扩增。PCR 反应体系为:2×Det PCR MasterMix 10.0 μL,模板1.0 μL,上下游引物各0.5 μL,ddH2O 补充至20 μL。PCR反应条件为:95 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸90 s,共35 个循环;72 ℃再延伸10 min;4 ℃保存。PCR 产物经1%琼脂糖凝胶电泳检测,采用DNA 凝胶回收试剂盒纯化,送至深圳华大基因股份有限公司测序。将测序结果在NCBI网站通过BLAST 进行序列对比分析,选取分离于不同地区的具有代表性的金黄色葡萄球菌菌株序列,应用DNAstar 7.1 软件编辑所选取的序列,构建遗传进化树并对比核苷酸同源性。
1.11 分离菌株的动物致病性试验 将15 只小鼠随机分为3 组:低剂量组(106CUF/mL 分离菌)、高剂量组(108CUF/mL 分离菌)及对照组(0.9%氯化钠溶液),均经腹腔注射,0.5 mL/只,注射后每隔30 min观察1 次,连续观察72 h,记录小鼠发病情况。
1.12 动物脏器病理组织观察 将无菌取出的心、肝、脾、肺、肾组织块置10%固定液中浸泡3 d;依次进行脱水、透明、浸蜡、包埋;次日,切片经HE 染色,置显微镜下观察。
2 结果
2.1 分离菌株的形态 分离菌株在LB 固体培养基上有多个表面隆起的白色菌落生长,继续培养12 h 后转为金黄色,均为革兰阳性球菌,且多呈葡萄串状排列。见图1。
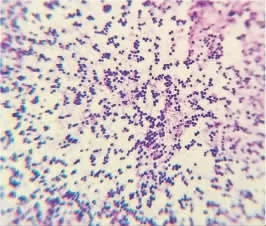
图1 分离菌形态的镜下观察(× 1000)Fig.1 Microscopy of morphology of isolates(× 1000)
2.2 分离菌株在Baird-Parker 氏培养板上的菌落特性分离菌株于Baird-Parker 氏培养板上可见黑色菌落。且菌落周围伴有狭小浑浊带及较宽透明圈,见图2。
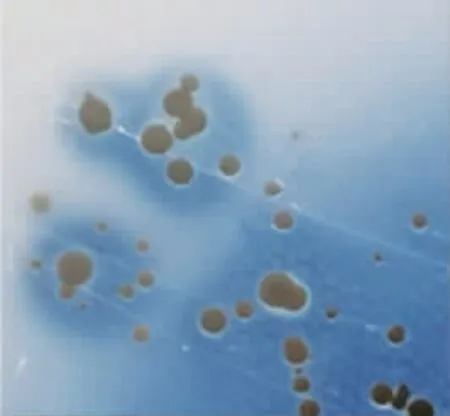
图2 分离菌株于Baird-Parker 氏培养板上的生长形态Fig.2 Colony growth morphology of isolates on Baird-Parker medium
2.3 分离菌株的血浆凝固酶试验结果 2、3 号试管内血浆完全凝固,1 号试管未出现血浆凝固现象,见图3。表明该分离菌株可凝固添加抗凝剂的血浆。
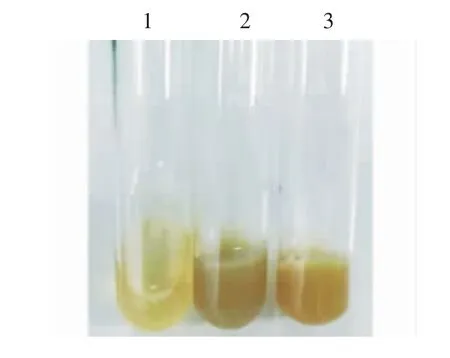
图3 血浆凝固试验结果Fig.3 Plasma coagulation test
2.4 分离菌株的生化鉴定结果 分离菌株的3-甲基戊二酸、黏菌素、D-葡萄糖酸、D-果糖、4 甲基伞型酮-磷酸、对硝基苯-AD-葡萄糖苷、右旋糖、D-蔗糖、D-海藻糖、D-甘露糖、亚氨基二乙酸、α-酮戊二酸、3-甲基己二酸、麦芽糖、尿素、胸腺嘧啶脱氧核苷试验均为阳性,表明分离菌株能分解海藻糖、麦芽糖和尿素等;分离菌株的精氨酸-精氨酸-7-氨基-4-甲基香豆素、L-丙氨酸-7-氨基-4-甲基香豆素、L-组氨酸-7-氨基-4-甲基香豆素、L-异亮氨酸-7-氨基-4-甲基香豆素、L-脯氨酸-7-氨基-4-甲基香豆素、L-焦谷氨酸-7-氨基-4-甲基香豆素、L-色氨酸-7-氨基-4-甲基香豆素、甲硫氨酸-7-氨基-4-甲基香豆素、α-甲基葡萄糖苷、七叶苷、4 甲基伞型酮-BD-纤维素二糖甙、4 甲基伞型酮-BD-葡萄糖苷、4 甲基伞型酮-N-乙酰-BD-氨基葡糖苷、丙氨酸-丙氨酸-对硝基苯胺、L-脯氨酸-对硝基苯胺、对硝基苯-磷酸、β-龙胆二糖、D-塔格糖、麦芽三糖、N-乙酰-葡萄糖胺试验为阴性,表明分离菌株不能分解塔格糖、七叶苷、甲基葡萄糖苷等。符合金黄色葡萄球菌的生化特性。
2.5 分离菌株的药敏检测结果 分离菌株对诺氟沙星、呋喃唑酮、克林霉素等药物敏感,对青霉素耐药,见表1。
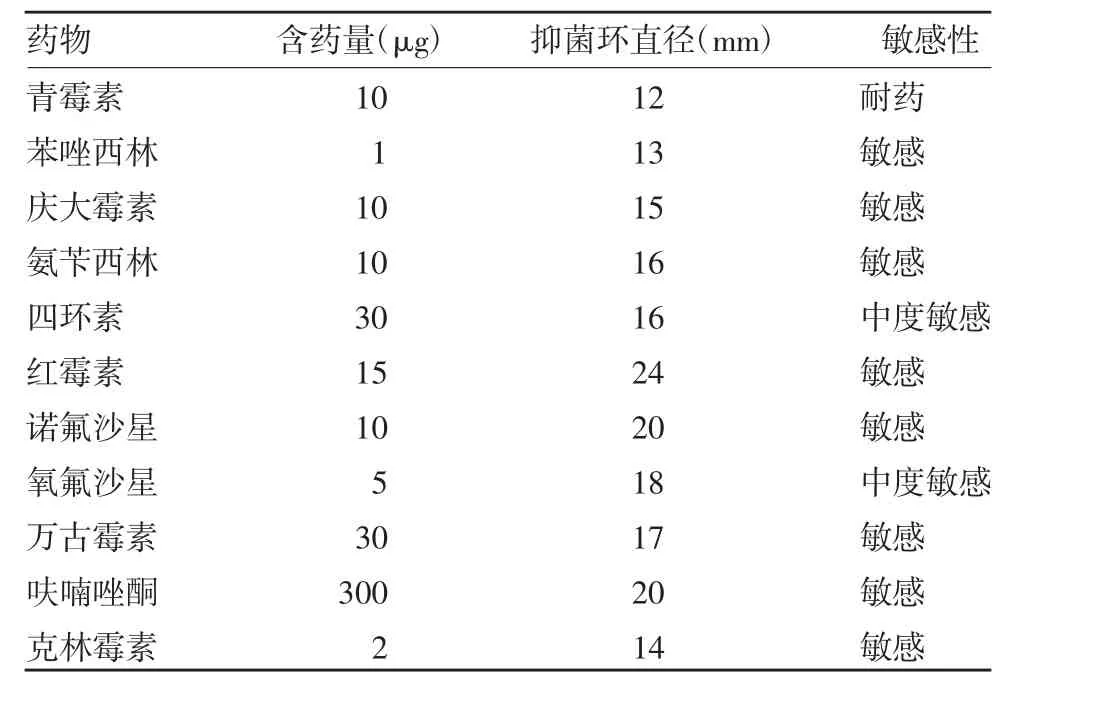
表1 分离菌药物敏感性试验结果Tab.1 Drug sensitivity test of isolates
2.6 分离菌株的16S rRNA 同源性分析 16S rRNA基因PCR 产物经1%琼脂糖凝胶电泳分析,可见1496 bp 的目的基因条带,大小与预期一致,见图4。测序结果表明,扩增产物序列与金黄色葡萄球菌16S rRNA 片段一致。因此,确定分离菌为金黄色葡萄球菌,并命名为TL。进化树分析结果表明,TL 与大连分离株KF495200、陕西分离株MK809243 及伊朗分离株KF254639 核苷酸序列同源性较高,分别为99.3%、99.1%、99.2%;与朝鲜分离株HM181992、北京分离株KT003251、山东分离株MF805761、江西分离株MK88615、印度分离株MN078268、美国分离株MH447033 核苷酸序列同源性相对较低,分别为98.3%、97.1%、95.4%、98.3%、98.2%、95.9%、95.9%。TL 与大连分离株KF495200 位于同一分支,亲源性最近,且二者存在2 处碱基缺失,分别为第959 和981位处缺失碱基C 和A。见图5。
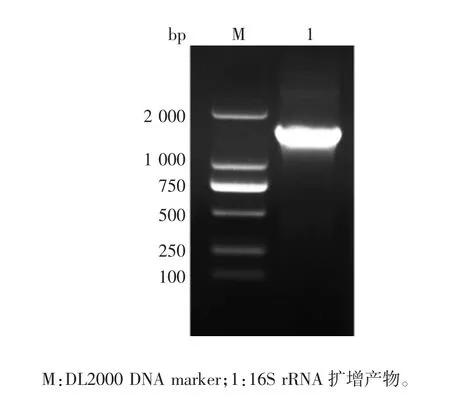
图4 16S rRNA PCR 产物电泳图Fig.4 Electrophoretic profile of PCR product of 16S rRNA
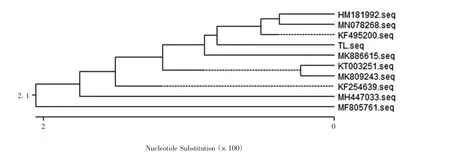
图5 16S rRNA 基因系统发育进化树Fig.5 Phylogenetic tree of 16S rRNA gene
2.7 分离菌株的动物致病性试验结果 注射6 h后,低剂量组小鼠出现食欲废绝、精神不振现象;高剂量组小鼠中,有1 只出现呼吸急促、倒地不起,另外2 只死亡;注射12 h 后,高剂量组小鼠全部死亡。试验期间对照组小鼠全部存活,未见异常。表明分离获得的金黄色葡萄球菌致病性较强。
2.8 动物脏器病理组织观察 镜下观察可见,肝细胞板断裂,肝细胞坏死、溶解、消失,肝血窦扩张;肺脏肺泡扩张,其中肺泡膈断裂增厚,支气管黏膜脱落,多数假复层柱状细胞坏死,细胞核浓缩、核深染;心脏心肌纤维断裂肥大、有瘢痕组织形成;肾脏中肾小球血管集处系膜细胞和内皮细胞增生,尿囊处内皮细胞坏死,呈均质化;脾脏生发中心外缘大量淋巴细胞发生坏死。见图6。
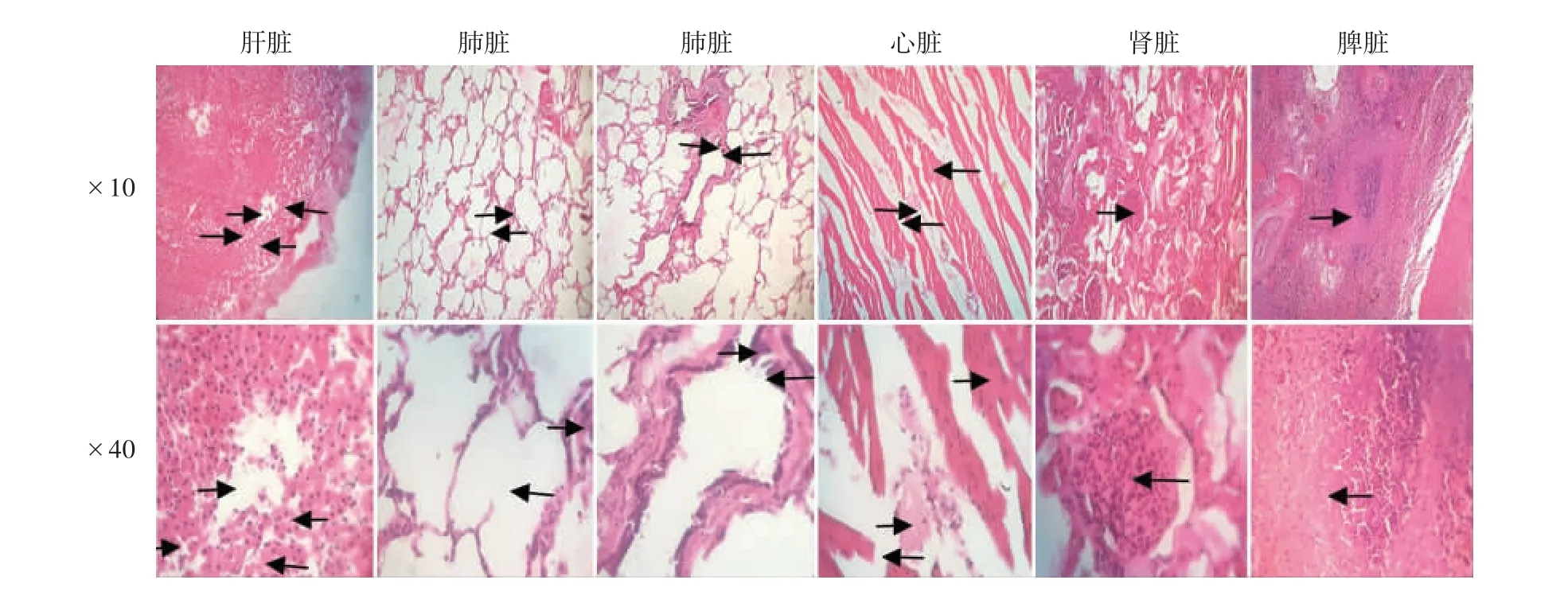
图6 猝死牛各脏器病理组织切片的镜下观察Fig.6 Pathological examination of various organs of cattle which died suddenly
3 讨论
金黄色葡萄球菌为常见易导致牛乳房炎的致病菌,严重影响产乳量,降低养殖企业的经济效益。该菌常规鉴定方法有血浆凝固酶法、生化检测法、免疫学检测法及分子生物学检测等[10-13]。本研究从猝死牛内脏分离获得1 株菌株,经上述方法鉴定,确定为金黄色葡萄球菌,且具有较强的致病性。因此确定该菌为引起牛发生猝死的病原菌。谢昆等[14]研究发现,金黄色葡萄球菌的耐药性具有地域差异性。本研究结果表明,获得的分离菌株对青霉素抗性较强,该结果与吴金花等[15]于内蒙古通辽市所分离菌株的药物敏感性结果不符,表明该菌的药物敏感性发生了改变。系统进化树分析可知,分离菌与大连分离株KF495200 位于同一分支,核苷酸序列同源性为99.3%,且二者存在2 处碱基缺失,分别为第959 和981 位处缺失碱基C 和A。这些碱基的缺失与细菌毒力变化的相关性有待进一步验证。
金黄色葡萄球菌含有2 种凝固酶,一种与菌体表面结合不释放,另一种分泌至菌体外,可使血浆发生凝固。凝固酶与细菌的毒力紧密相关,致病性菌株进入机体后,可使血液中的纤维蛋白凝集在细菌菌体的表面,阻止宿主体内吞噬细胞的吞噬作用,即使被其吞噬后,也不易被胞内杀灭。因此,血浆凝固酶试验是判定葡萄球菌毒力强弱的标准之一。本实验结果显示,血浆凝固酶试验结果呈阳性,菌株对诺氟沙星、呋喃唑酮、克林霉素等药物敏感;动物实验结果还表明,菌株可导致小鼠死亡。因此判断该株金黄色葡萄球菌属于致死性金黄色葡萄球菌。
杜琳等[16]对中国5 个省市自治区的乳房炎奶牛所产牛乳中致病性金黄色葡萄球菌进行检测,结果显示,金黄色葡萄球菌的分离率为12.15%。锡林高娃等[17]对内蒙古通辽市主要产奶地区进行同样的调查,结果显示,采集的19 份牛乳中共分离出24株金黄色葡萄球菌,上述研究表明金黄色葡萄球菌对奶牛的感染率较高,通辽市作为牛养殖聚集地,感染该菌的风险远高于其他地区。本研究从通辽地区分离获得的金黄色葡萄球菌对牛具有致死性,表明金黄色葡萄球菌的致病性有进一步增强的可能,本研究为当地牛猝死症的流行病学调查及金黄色葡萄球菌病的预防提供了实验依据。

