恒温核酸扩增芯片法在呼吸道感染性病原菌检测中的应用
张鹏,商晨,王严
1.皖南医学院弋矶山医院检验科,安徽 芜湖 241001;2.皖南医学院检验学院,安徽 芜湖 241001
呼吸道感染性疾病是临床常见的感染性疾病之一,由病原体侵入呼吸道从而繁殖致病,尤其下呼吸道感染对人体危害更加严重。随着临床抗生素滥用,耐药菌株明显增多,引起下呼吸道感染的几率日益增加,而可供临床选用的抗菌药物越来越少[1]。导致呼吸道感染的病原体主要有细菌、病毒、真菌等[2]。目前临床微生物学检验仍主要采用传统的细菌分离培养生化鉴定法,操作繁琐,检测周期长,且阳性检出率较低[3]。为满足临床诊疗及时性的需求,急需开发高效、准确、快速的检验手段进行病原学鉴定。恒温核酸扩增芯片法作为近来研发的PCR 技术[4],主要针对常见下呼吸道感染病原菌的靶基因设计引物并进行扩增和检测,理论上具有速度快、结果准确和多重病原体检出能力的优点。本研究同时应用恒温核酸扩增芯片法和传统微生物分离培养生化法对临床疑似呼吸道感染住院患者痰液样本进行检测并比较,评价恒温核酸扩增芯片法在呼吸道感染性病原菌诊断中的临床价值。
1 资料与方法
1.1 研究对象 478 例痰液样本来自2019 年12月— 2020 年5 月皖南医学院弋矶山医院重症医学科、神经外科、呼吸内科、血液内科、老年医学科、感染科、急诊内科、神经内科、消化内科、心血管内科疑似呼吸道感染住院患者,均按照临床微生物标本采集规范进行样本采集。本研究获得皖南医学院弋矶山医院伦理委员会批准(WF2020015)。
1.2 菌株 质控菌株均为国家卫生健康委临床检验中心提供的标准菌株。
1.3 主要试剂及仪器 iChip-400 四通道芯片恒温核酸扩增分析仪及配套的呼吸道病原菌核酸检测试剂盒(批号:01190701)购自天津百康芯生物科技有限公司;Vitek-2 全自动微生物鉴定仪及配套的细菌鉴定卡(批号:GN2411172403/GP2421134403)购自法国bio-Merieux 公司。
1.4 细菌鉴定
1.4.1 恒温核酸扩增芯片法 样本均经4% NaOH痰液消化,用200 μL 核酸提取液震荡悬浮并100 ℃金属浴5 min;漩涡振荡瞬时离心进行核酸提取,70 μL 总反应体系(35 μL 恒温扩增试剂+ 35 μL模板DNA 溶液芯片加样),37 ℃3 min,65 ℃47 min。检测完成后,仪器采用二阶导数法计算S 扩增曲线进入快速扩增期的第1 个拐点,拐点对应的时刻与原点时刻的差值定义为Tp 值,根据Tp 值并结合待测样本判断值进行结果判读,判读完成后,在荧光曲线区域显示归一化曲线,完成质控和待测样本的检验。
1.4.2 微生物分离培养生化法 样本经细菌培养分纯后,采用全自动微生物鉴定仪进行菌种鉴定,按照仪器及试剂说明书进行操作。
1.5 统计学分析 采用SPSS 21.0 软件进行数据处理及统计学分析,计数资料比较采用χ2检验,计量资料以均数± 标准差(±s)表示,组间比较采用独立样本t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 恒温核酸扩增芯片法病原菌鉴定结果 478 例痰液样本共检出病原菌312 例,阳性检出率65.27%。单病原菌感染256 例(82.05%),混合病原菌感染56 例(17.95%),见图1。312 例阳性样本共检测出10 种病原菌,前5 位分别为肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、金黄葡萄球菌和鲍曼不动杆菌,见表1。病原菌分布前5 位的科室分别为重症医学科、神经外科、呼吸内科、血液内科和老年医学科,见表2。
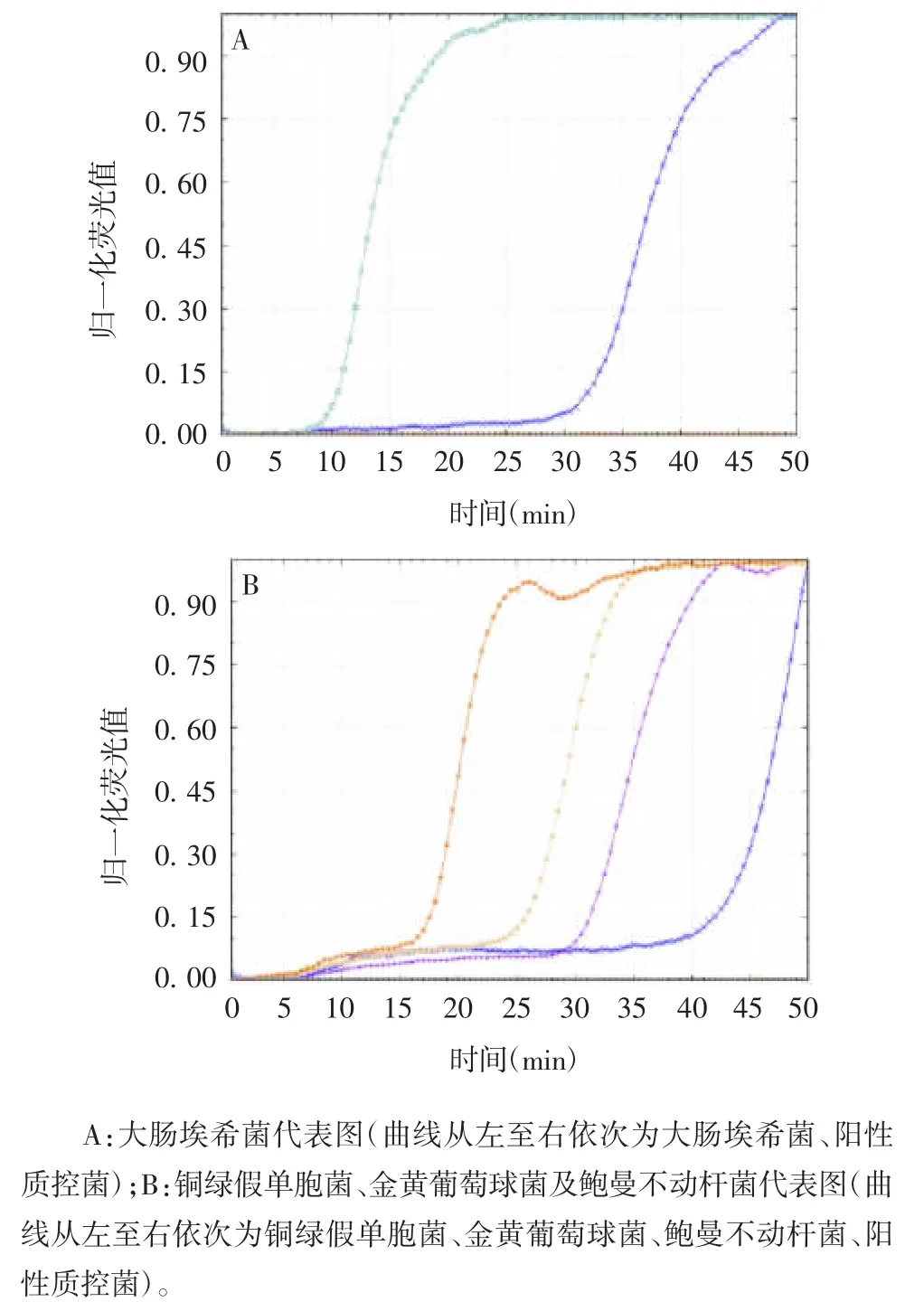
图1 单病原菌和混合病原菌恒温核酸扩增芯片法归一化荧光曲线Fig.1 Normalized fluorescent curve of loop-mediated isothermal amplification of single and mixed pathogens
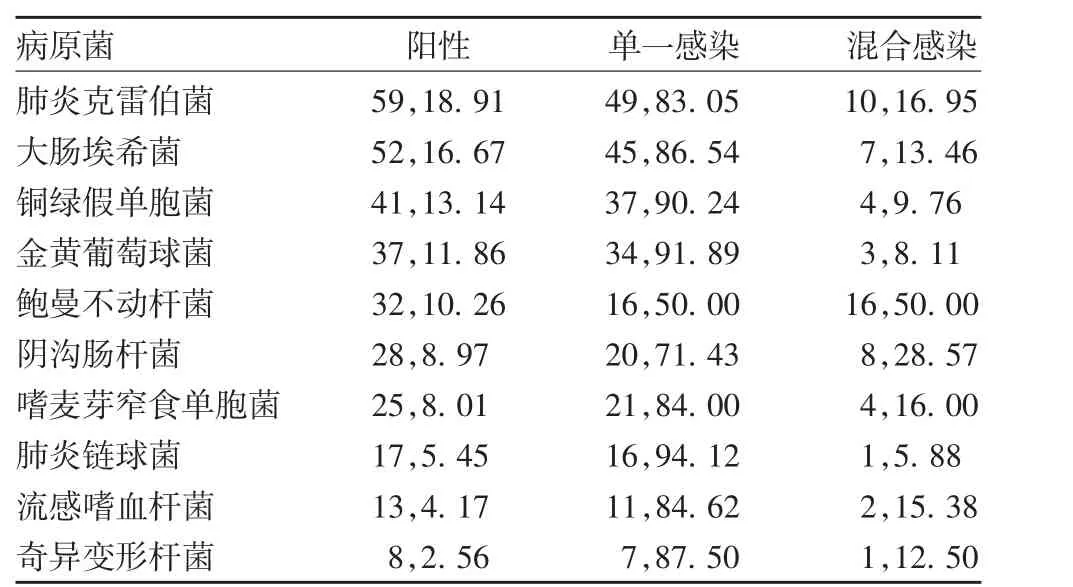
表1 恒温核酸扩增芯片法检测病原菌种类分布情况(例数,%)Tab.1 Distribution of species of pathogens detected by loopmediated isothermal amplification(case,%)

表2 病原菌来源科室分布Tab.2 Distribution of departments with pathogens detected
2.2 分离培养生化法病原菌鉴定结果 478 例痰液样本共检出病原菌165 例,阳性检出率34.52%。单病原菌感染145 例(87.88%),混合病原菌感染20例(12.12%)。165 例阳性样本共检测出10 种病原菌,前5 位分别为肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、金黄葡萄球菌、鲍曼不动杆菌,见表3。
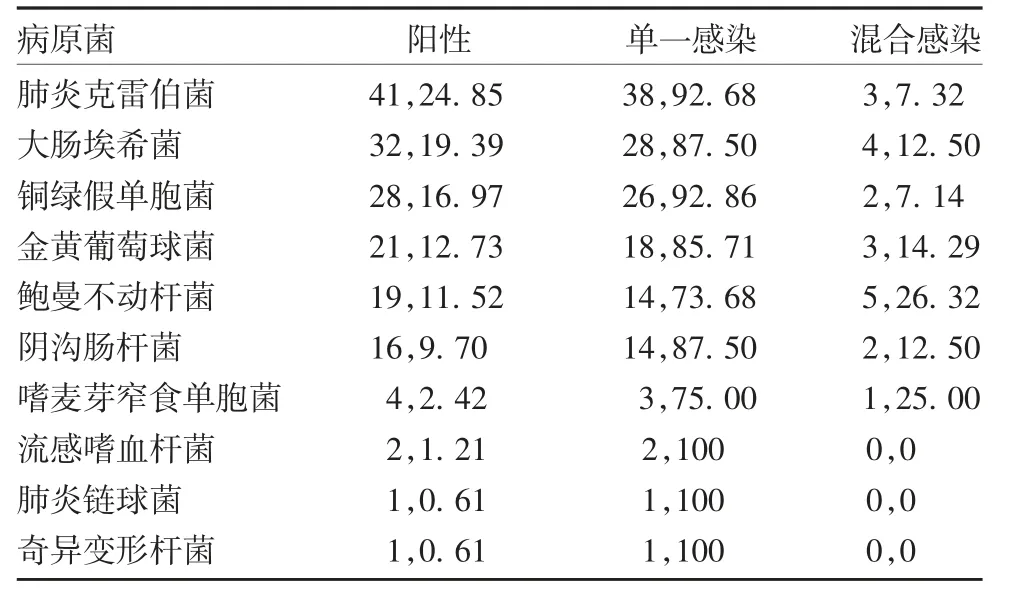
表3 分离培养生化法检测病原菌种类分布情况(例数,%)Tab.3 Distribution of species of pathogens detected by biochemical identification in isolation and culture(case,%)
2.3 两种方法对病原菌鉴定结果的比较 478 例痰液样本,恒温核酸扩增芯片法和分离培养生化法分别检出病原菌312 和165 例,经培养,阳性样本病原菌鉴定结果与核酸鉴定结果均一致。恒温核酸扩增芯片法病原菌检出率显著高于分离培养生化法,差异有统计学意义(χ2= 90.415,P <0.001),而鉴定时间[(4.67 ± 2.93)h]明显低于分离培养生化法[(49.87±10.27)h],差异有统计学意义(F =69.24,P <0.001)。
3 讨论
全球疾病负担研究中心2016 年统计结果显示,呼吸系统感染是全世界感染性疾病发病及死亡的重要原因之一[5],而引起下呼吸道感染最主要的病原体为细菌。现阶段临床诊断细菌性肺炎仍主要依靠微生物实验室病原菌培养和生化反应鉴定菌种这一传统方法,虽然从痰液样本中分离到菌株被公认为是金标准,但该方法费时长,检出率低,有些病原体培养条件苛刻,甚至无法进行培养,因此,不能满足临床早期诊断和治疗的要求。其他一些方法如血清学检测等,缺乏一定的灵敏度和特异性[6]。因此,临床要求更加高效、便捷的病原菌检测方法以用于及时诊疗。
2000 年,NOTOMI 等[7]报道了一种新的核酸扩增方法,即环介导恒温扩增技术。该方法针对靶基因6 个区域设计4 条特异性引物,在65 ℃恒温条件下,通过置换DNA 聚合酶完成核酸扩增反应。在此过程中无需经过变性、退火、延伸等常规步骤,极大缩短了检测时间,反应灵敏度和特异性也明显提高[8]。近来环介导恒温扩增技术已被应用于细菌、真菌、病毒、寄生虫等方的生物学检测,同时逐渐衍变为临床寻找病原学证据的检测手段[9-12]。如2019年底至2020 年初,YAN 等[13]利用逆转录-环介导恒温扩增法同时检测60 例新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)临床样本的ORF1ab、S 两种基因靶标,结果显示该方法灵敏度高,特异性强,全程自动化且高效便捷,为COVID-19 的精准防控做出了重要贡献。
针对恒温核酸扩增芯片法检测病原菌的国内外报道较少。本研究对478 例临床疑似呼吸道感染住院患者痰液样本同时进行恒温核酸扩增芯片法和传统微生物分离培养生化法的检测,结果显示,恒温核酸扩增芯片法共检出病原菌312 例,单病原菌感染256 例,混合病原菌感染56 例。分离培养生化法共检出病原菌165 例,单病原菌感染145 例,混合病原菌感染20 例。两种方法均共检出10 种细菌,其中肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、金黄葡萄球菌、鲍曼不动杆菌检出率较高,与李艳燕等[14]报道基本一致。两种方法病原菌阳性检出率比较,恒温核酸扩增芯片法明显高于分离培养生化法(P <0.001),原因可能如下:①恒温核酸扩增芯片法属于PCR 技术,待测样本即使含有少量拷贝也可获得目的基因[15];②恒温核酸扩增芯片实验过程中,环境相对封闭,干扰因素少;③传统培养方法培养周期长,易受培养条件、人员操作等因素影响;④部分苛养菌本身培养条件苛刻,阳性率低[16]。两种方法病原菌检出时间比较,恒温核酸扩增芯片法明显低于传统分离培养生化法(P <0.001)。本实验不足之处是研究对象仅为引起呼吸道感染的病原菌,未对常见引起呼吸系统感染的病毒、真菌、寄生虫等其他病原体进行检测,且实验周期较短,在今后的临床科研中可进一步完善。
综上所述,本实验建立了从呼吸道样本中通过恒温核酸扩增芯片技术直接检测病原菌的方法,该方法敏感度高、特异性强,优于传统的分离培养生化鉴定法。另外,恒温核酸扩增芯片法检测时间控制在约4 h,缩短了病原菌检出时间,能够为临床及时诊治提供高效可靠的实验室依据,对临床早诊断和精准治疗具有重要意义。

