姜黄素协同米托蒽醌对小鼠TC-1 肿瘤细胞发生免疫原性细胞死亡的诱导作用及其作为肿瘤疫苗的潜力
杨颖,杨英,胡永茂,刘清文,马雁冰
1.昆明医科大学,云南昆明 650500;2.中国医学科学院北京协和医学院医学生物学研究所,云南 昆明 650000;3.云南大学,云南 昆明 650000
宫颈癌是世界范围内女性第三大常见癌症,每年约有529800 例新发病例和275100 例死亡病例[1-2]。在世界范围内,宫颈癌是仅次于乳腺癌的女性癌症死亡原因,严重危害全球女性健康。人乳头瘤状病毒(human papillomavirus,HPV)已经被确定为宫颈癌发生发展的主要致病因素,尤其是高危型别的HPV,如16、18、31 和33 型等。近年来随着HPV预防性疫苗的上市及接种,宫颈癌发病率和死亡率在发达地区呈现明显下降趋势。然而在较多发展中和落后地区,昂贵的HPV 多价疫苗目前尚无法实现普遍接种,因此宫颈癌仍严重威胁女性健康。由于现有的预防性疫苗对已有的持续感染和由此引发的宫颈癌无治疗效果,目前仍然存在大量因HPV 感染而患宫颈癌的人群。
近年来,肿瘤免疫治疗已成为肿瘤研究及临床应用的热点,正在改变肿瘤治疗的新格局,并且发展十分迅速。其宗旨在于减轻免疫抑制作用或激活、增强机体免疫系统正常的抗肿瘤免疫功能,依靠自身的免疫机能杀伤肿瘤细胞。目前肿瘤临床免疫治疗面临的挑战主要为:肿瘤细胞的低免疫原性;肿瘤抑制性免疫微环境的存在;肿瘤形成的一系列免疫逃逸机制使机体免疫系统无法发挥正常抗肿瘤作用。
免疫原性细胞死亡(immunogenic cell death,ICD)通过释放肿瘤抗原并暴露“危险信号”以刺激机体免疫系统产生免疫应答[3-4]。其特点是释放和/ 或增加表达损伤相关的分子模式(danger associated molecular patterns,DAMPs)、前体抗原炎性细胞因子[4]和炎性介质。主要的DAMPs 包括三磷酸腺苷(adenosine triphosphate,ATP)、钙网蛋白(calreticulin,CALR)、高迁移率族蛋白B1(high mobility group box protein B1,HMGB1)、热休克蛋白(heat shock protein,HSP)、Ⅰ型干扰素(IFN-Ⅰ)和膜联蛋白1(Annexin 1,ANXA1)等,继而激活和募集抗原递呈细胞(antigen-presenting cells,APCs)后活化T 细胞,产生针对肿瘤抗原的适应性免疫应答[5]。DAMPs 与模式识别受体(pattern recognition receptors,PRRs)结合后引起一系列事件。如肿瘤细胞释放至胞外的ATP作为“发现我”的信号,具有招募、激活APCs 和激活炎性体通路的双重作用。细胞膜表面暴露的钙网蛋白(ecto-CALR)作为一个强有力的“吃掉我”信号,能增强APCs 对死亡癌细胞的免疫原性识别和吞噬[6]。提示诱导肿瘤细胞发生ICD 有潜在的肿瘤治疗作用。
化疗和放疗能够通过诱导肿瘤细胞发生ICD 从而赋予肿瘤细胞免疫原性,加强机体对肿瘤细胞的识别和清除。尽管这些诱导剂具有广阔的潜力,但单独的化学药物不能诱导足够的ICD,而充分诱导肿瘤细胞发生ICD 在临床上往往需要高剂量的化疗药物,因其严重的毒副作用难以实现。药物的组合可能因其机制协同,带来诱导条件及结果的优化。研究表明,放疗与轻度热疗[7]、新型免疫调节剂IMMUNEPOTENT CRP 与奥沙利铂[8]、吉西他滨与缺氧诱导因子-1 抑制剂PX-478[9]的组合等均可激发可观的DAMPs 的释放及肿瘤组织中更多的免疫细胞浸润,对肿瘤生长具有显著抑制作用。因此,联合治疗诱导肿瘤细胞发生ICD 的方法值得进一步开发应用。
米托蒽醌(mitoxantrone,MTX)是一种广泛用于前列腺癌治疗的抗肿瘤细胞毒性药物[10],在黑色素瘤、骨肉瘤和小鼠结肠癌细胞系中均可诱导ICD[11]。此外,MTX 通过前列腺癌细胞中p53 依赖蛋白激酶R 样ER 激酶(P53-dependent protein kinase R-like ER kinase,PERK)的表达触发ICD[12]。姜黄素(curcumin,Cur)是1815 年从姜黄根茎中提取的一种具有抗癌作用的多酚类物质,通过靶向不同的细胞信号通路,包括生长因子、细胞因子、转录因子以及调节细胞增殖和凋亡的基因等,显示出抗癌能力[13]。Cur可通过抑制激活蛋白1(inhibitory activator protein 1,AP-1)和核因子κB(nuclear factor kappa B,NF-κB)因子在不同模型中发挥抗癌特性[14],如乳腺癌、肺癌、血液肿瘤和消化道肿瘤等[13]。也有研究表明,Cur 可通过激活miR-125a/ERRα 信号通路促进骨肉瘤细胞的死亡[15]。最值得一提的是,Cur 还可通过增加ROS 的生成和脂质过氧化来施加氧化应激,这在ICD 的发生发展过程中可起到一定的辅助作用。真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)的磷酸化对于CALR 的暴露至关重要。有研究发现,Cur 能够显著诱导eIF2α 的磷酸化,进而通过内质网应激导致前列腺癌细胞凋亡,使前列腺癌细胞对化疗药物多西紫杉醇(docetaxel,DTX)致敏。Cur 还可通过激活caspase-1 和增加HMGB1 的释放来诱导细胞的焦亡[16]。上述研究表明,Cur 具有诱导肿瘤细胞发生ICD 以及联合其他化疗药物增强ICD 治疗的潜力。
本研究在前期化疗药物初步筛选中,使用不同药物处理小鼠宫颈癌TC-1 细胞,筛选出能有效诱导ICD 的药物,并根据其药物毒性动力学特征优化诱导策略,为进一步以其为模式,基于小鼠模型探讨诱导肿瘤细胞ICD 在肿瘤免疫治疗中的潜力奠定基础。
1 材料与方法
1.1 细胞 小鼠宫颈癌TC-1 细胞系是由HPV E6、E7 和ras 基因共转染的C57BL/6 小鼠肺上皮细胞,购自中国医学科学院肿瘤细胞库。用含10%胎牛血清、1% 100 U/mL 青霉素和0.1 mg/L 链霉素的RPMI1640 完全培养基,置37 ℃,5% CO2恒温细胞培养箱培养,每2 ~ 3 d 传代1 次。
1.2 实验动物 SPF 级C57BL/6J 小鼠,雌性,6 ~ 8周龄,体重16 ~ 18 g,购自中国医学科学院医学生物学研究所(IMBCAMS)中心动物护理服务中心,动物许可证编号:SYXK(滇)K2019-0003。所有动物实验均经IMBCAMS 动物护理和福利伦理委员会批准,所有的努力均是为了尽量减少动物痛苦。
1.3 主要试剂及仪器 HPV 16 型CTL 表位E749-57肽由上海吉尔生化有限公司合成;RPMI1640 细胞培养基购自以色列Biologicalindustrial 公司;胎牛血清(FBS)购自美国Gibco 公司;基质胶和70 μm 无菌细胞筛网购自美国BD Bioscience 公司;小鼠淋巴细胞分离液购自北京达科为生物技术有限公司;Cell Activation Cocktail、Brefeldin A、Cell Staining Buffer、流式抗体、Fixation Buffer 和Permeabilization Wash Buffer 购自美国Biolegend 公司;Tween-20 购自中国Biosharp 公司;Collagenase A 购自瑞士Roche 公司;ECL 化学发光底物试剂盒购自美国ThermoFisher Scientific 公司;MTX 和Cur 购自美国MCE 公司;小鼠抗β-actin 单克隆抗体购自美国Proteintech 公司;兔抗HMGB1 单克隆抗体和HRP 标记的山羊抗鼠IgG 购自英国Abcam 公司;HRP 标记的山羊抗兔IgG、ATP 检测试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自碧云天生物技术有限公司;多功能检测酶标仪购自美国Biotek 公司;转膜仪、凝胶成像仪购自美国Biorad 公司;流式细胞仪购自美国Beckman 公司。
1.4 药物处理对TC-1 细胞形态影响的检测 将TC-1细胞以1 × 105个/ mL/孔的密度接种至12 孔板,置37 ℃,5% CO2恒温培养箱培养过夜后,用2、10、20、35、50 μmol/L MTX 或20、50、80、100、120 μmol/L Cur 或3 μmol/L MTX 与50 μmol/L Cur 联合处理,以不进行任何处理的细胞作为对照,继续培养。显微镜下观察细胞情况和形态变化。
1.5 细胞培养上清中LDH 释放的检测 细胞培养及处理同1.4 项。检测前1 h,在细胞最大酶活性孔中加入10%培养基体积的LDH 释放剂,收集上清,400 × g 离心5 min 后,取120 μL 加至96 孔板,再加入60 μL 监测工作液(乳酸溶液、1 × INT 溶液及酶溶液按体积比1 ∶1 ∶1 充分混匀)反复抽吸混匀,避光反应20 min。于490 nm 波长处检测A 值,并按下式计算细胞死亡率。
1.团长、副团长:主要负责上下级沟通,统筹全团总体事务,把握项目方向和进度,及时调整策略,解决带有普遍性和全局性的问题,不兼任队长、副队长或组长。

1.6 MTX 与Cur 协同诱导TC-1 细胞发生ICD 的检测
1.6.1 ATP检测 将TC-1 细胞以每孔1×105个/mL的密度接种至12 孔板,37 ℃培养过夜后,进行3 μmol/L MTX、50 μmol/L Cur 单独或3 μmol/L MTX 与50 μmol/L Cur 联合处理,37 ℃继续培养至4、6、8、12 和24 h 收集上清,4 ℃,12000 × g 离心5 min 后置于冰上。配置不同浓度(10、1、0.1、0.01 μmol/L及1 和0.1 nmol/L)的ATP 标准液,在96 孔板中加入100 μL 稀释好的ATP 检测工作液,避光室温放置5 min;加入20 μL 样品和标准液,反应2 min;上化学发光仪测定荧光值,以ATP 浓度为横坐标,荧光值为纵坐标,绘制标准曲线后求得样品中ATP含量。
1.6.2 HMGB1 检测 将TC-1 细胞以每孔1×106个/2 mL 的密度接种至6 孔板,37 ℃培养过夜后,进行3 μmol/L MTX、50 μmol/L Cur 单独或3 μmol/L MTX 与50 μmol/L Cur 联合处理,37 ℃继续培养至4、8、12、24、30 和36 h 收集上清,进行Western blot分析:取相同体积的上清液,经12% SDS-PAGE 分离后,半干法转移至孔径为0.2 μm 的PVDF 膜上,加入50 mL 5%脱脂奶粉,室温封闭2 h;分别加入兔抗HMGB1 单克隆抗体、小鼠抗β-actin 单克隆抗体(均1 ∶5000 稀释),4 ℃孵育过夜;1 × TBST(1 L TBS + 500 μL 吐温20)洗涤3 次,每次10 min,加入HRP 标记的山羊抗兔IgG(1 ∶3000 稀释)及HRP标记的山羊抗鼠IgG(1 ∶8000 稀释),室温孵育2 h;1 × TBST 洗涤3 次,每次10 min,使用ECL 化学发光显色液(A 液∶B 液按体积比1 ∶1 充分混匀)显色,用凝胶成像仪成像并拍照。试验重复3 次。
1.7 动物免疫 TC-1 细胞生长至70% ~ 80%密度时,加入3 μmol/L MTX 与50 μmol/L Cur 联合处理,继续置37 ℃培养箱培养24 h;收集细胞,于C57BL /6J 小鼠左侧皮下免疫1 × 106个细胞/ 100 μL(疫苗组),对照组注射同体积PBS。1 个月后右侧皮下接种正常的TC-1 细胞1 × 105个/ 100 μL,进行免疫挑战,期间密切监测和记录肿瘤生长情况。
1.8 小鼠脾脏淋巴细胞的分离 在实验终点,断颈处死小鼠,分离小鼠脾脏;在生物安全柜中,将70 μm 无菌细胞筛网置于50 mL 离心管中,脾脏置于细胞筛网中,分多次加入5 mL 小鼠淋巴细胞分离液,用5 mL 注射器活塞轻轻研磨,将研磨的细胞悬液转移至15 mL 离心管中,于液面上缓慢添加500 μL RPMI1640 培养基并保持液面分界明显;室温,800 × g 离心30 min,设置较低升速和降速,离心后可见细胞分层,吸出白色淋巴细胞层,加入10 mL RPMI1640 培养基重悬洗涤细胞,室温,250 × g 离心10 min,弃上清,用RPMI1640 完全培养基重悬细胞进行计数。
1.9 小鼠肿瘤淋巴细胞的分离 将小鼠肿瘤组织用灭菌剪刀剪碎,加入700 μL(1 mg/mL)Collagenase溶液(用RPMI1640 培养基溶解),37 ℃,120 r/min消化1 h;在生物安全柜中,将消化后的肿瘤组织置于细胞筛网中研磨,具体步骤参照1.8 项。
1.10 细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)水平的检测 采用流式细胞术。分离各组小鼠脾脏和肿瘤淋巴细胞计数后,以1 × 107个/ mL 细胞浓度分别加至96 孔U 形细胞培养板中,100 μL/孔,加入合成的HPV CTL 表位E749-57 肽至终浓度为5 μg/mL,刺激总时间为7 h,在刺激2 h 后加入BrefeldinA;室温,500 × g 离心5 min,吸出上清,用Cell Staining Buffer 洗涤细胞2 次,100 μL Cell Staining Buffer 重悬细胞,加入CD8α-APC 抗体,4 ℃避光孵育30 min;Cell Staining Buffer 洗涤2 次,200 μL预冷Fixation Buffer 重悬细胞,室温避光孵育固定20 min;Cell Staining Buffer 洗涤3 次,加入200 μL Permeabilization Wash Buffer 重悬细胞,室温,500 × g离心5 min,弃上清,重复2 次,用100 μL Permeabilization Wash Buffer 重悬细胞,加入IFNγ-PE 抗体,室温避光孵育20 min;Permeabilization Wash Buffer 洗涤2 次,离心弃上清,用200 μL Cell Staining Buffer重悬细胞转移至1.5 mL EP 管中后上机检测。
1.12 统计学分析 应用GraphPadPrism 进行数据整理、分析及图形绘制。组间比较采用非配对t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 不同剂量MTX 和Cur 对TC-1 细胞死亡的影响 不同剂量MTX 和Cur 处理TC-1 细胞24 h,显微镜下观察结果显示,随着MTX 和Cur 浓度的增加,细胞状态越来越差,出现形态改变,死亡细胞数量也随之增多。其中2 μmol/L MTX 和20 μmol/L Cur处理后即可引起细胞轻微程度死亡;50 μmol/L MTX 和120 μmol/L Cur 处理后出现大量死亡细胞漂浮。见图1 和图2。上清LDH 释放检测结果显示,MTX 和Cur 诱导细胞死亡的程度呈剂量依赖性(t = 1591982 ~ 345266064,P <0.0001;t =1224744838 ~ 14268811274,P <0.0001),见图3。
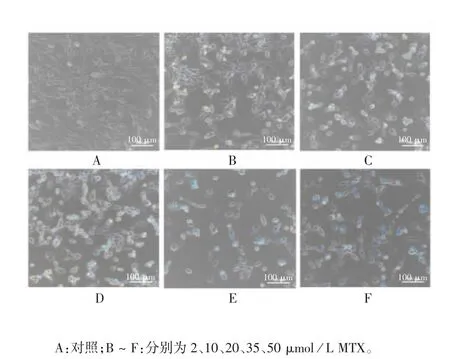
图1 不同剂量的MTX 对TC-1 细胞毒性的显微镜观察(× 200)Fig.1 Microscopy of toxicity of MTX at various dosages to TC-1 cells(× 200)

图2 不同剂量的Cur 对TC-1 细胞毒性的显微镜观察(×200)Fig.2 Microscopy of toxicity of Cur at various dosages to TC-1 cells(× 200)
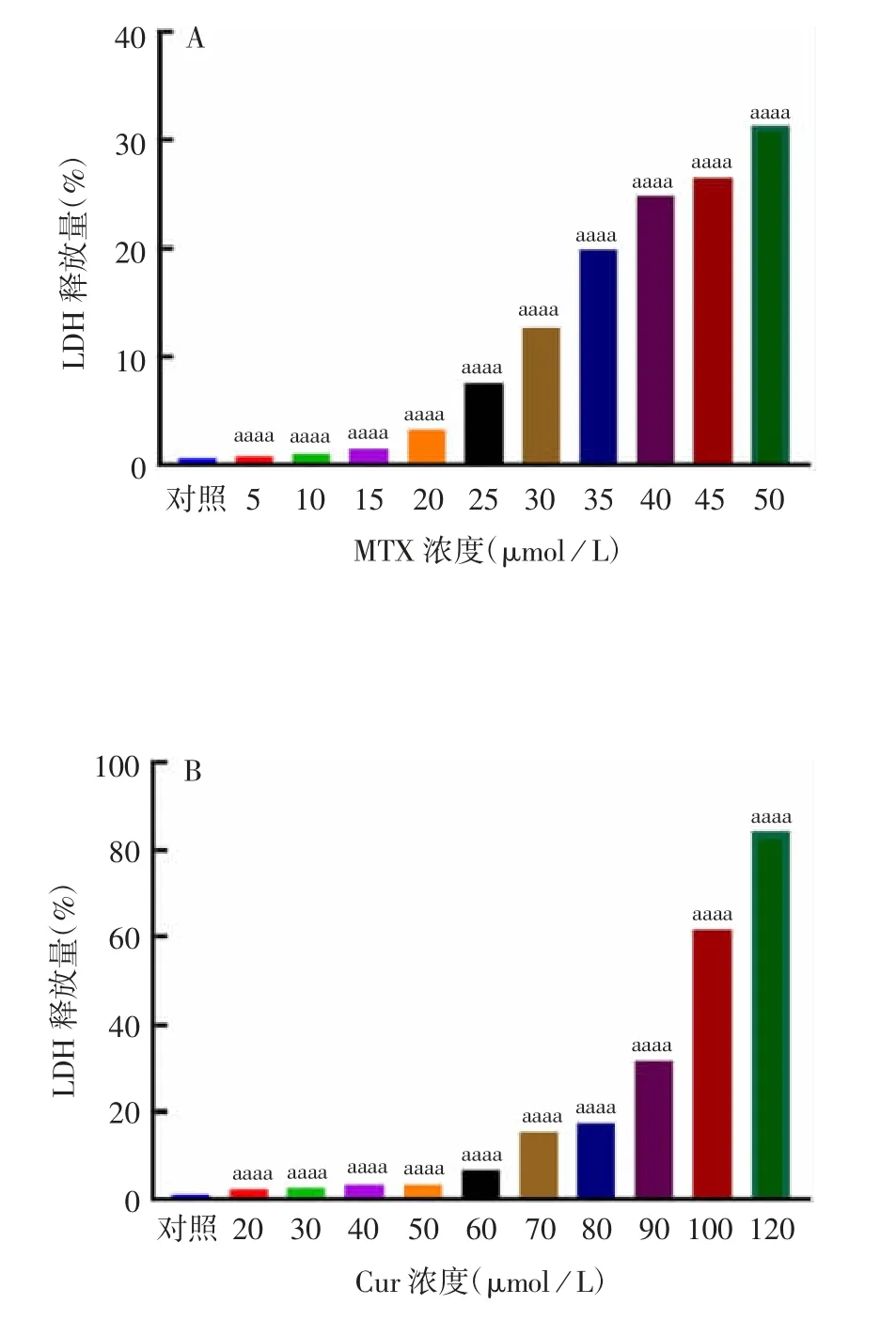
图3 不同浓度的MTX(A)和Cur(B)对TC-1 细胞LDH释放的影响Fig.3 Effects of various concentrations of MTX(A)and Cur(B)on LDH release from TC-1 cells
2.2 MTX 和Cur 处理不同时间对TC-1 细胞死亡的影响 显微镜下观察结果显示,经10 μmol/L MTX 和60 μmol/L Cur 处理后的TC-1 细胞随时间延长,死亡形态越显著,死亡率也逐渐增加。其中10 μmol/L MTX 处理24 h 和60 μmol/L Cur 处理6 h 即可观察到细胞死亡状态出现。见图4 和图5。上清LDH 释放检测结果也显示,MTX 和Cur 诱导细胞死亡的程度呈时间依赖性(t = 879260525 ~3651753555,P <0.0001;t = 33768736 ~1685428676,P <0.0001),见图6。

图4 10 μmol/L MTX 处理不同时间后对TC-1 细胞毒性的显微镜观察(× 200)Fig.4 Microscopy of toxicity of treatment with 10 μmol/L MTX for various hours to TC-1 cells(× 200)

图5 60 μmol/L Cur 处理不同时间后对TC-1 细胞毒性的显微镜观察(× 200)Fig.5 Microscopy of toxicity of treatment with 60 μmol/L Cur for various hours to TC-1 cells(× 200)
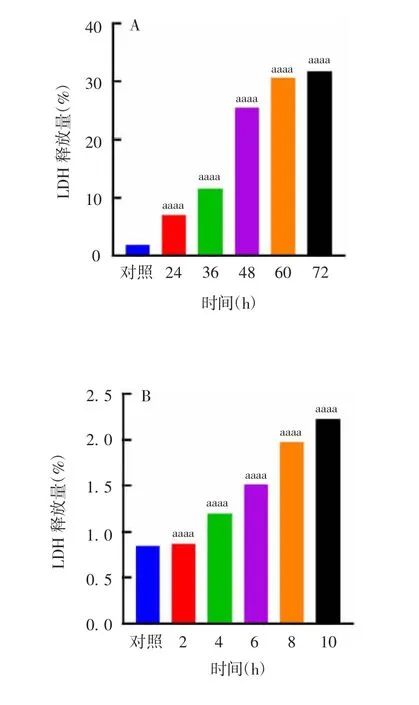
图6 10 μmol/L MTX(A)和60 μmol/L Cur(B)处理不同时间对TC-1 细胞LDH 释放的影响Fig.6 Effects of treatment with 10 μmol/L MTX(A)and 60 μmol/L Cur(B)on LDH release from TC-1 cells
2.3 MTX 与Cur 联合对TC-1 细胞死亡的影响 显微镜下观察显示,MTX 与Cur 不同浓度联合处理12 h后的TC-1 细胞与高浓度单独处理呈现出相似的死亡情况,见图7。3 μmol/L MTX 与50 μmol/L Cur联合处理24 h 后的TC-1 细胞,呈现出细胞变圆、死亡漂浮细胞少以及有明显细胞形态改变等较为理想的死亡状态,见图8。MTX 与Cur 联合处理不同时间点,上清LDH 释放量呈时间依赖性,并且比单独用药释放了更多的LDH(t=700668866~8839039349;P <0.0001),见图9。两者联合处理在降低了各自药物使用剂量的同时也呈现出比高浓度单独处理更好的细胞死亡状态,因此,接下来以此药物联合浓度配方探究其对TC-1 细胞特性的影响。

图7 不同浓度的MTX 与Cur 联合处理对TC-1 细胞毒性的显微镜观察(× 200)Fig.7 Microscopy of toxicity of treatment with various concentrations of MTX combined with Cur to TC-1 cells(× 200)
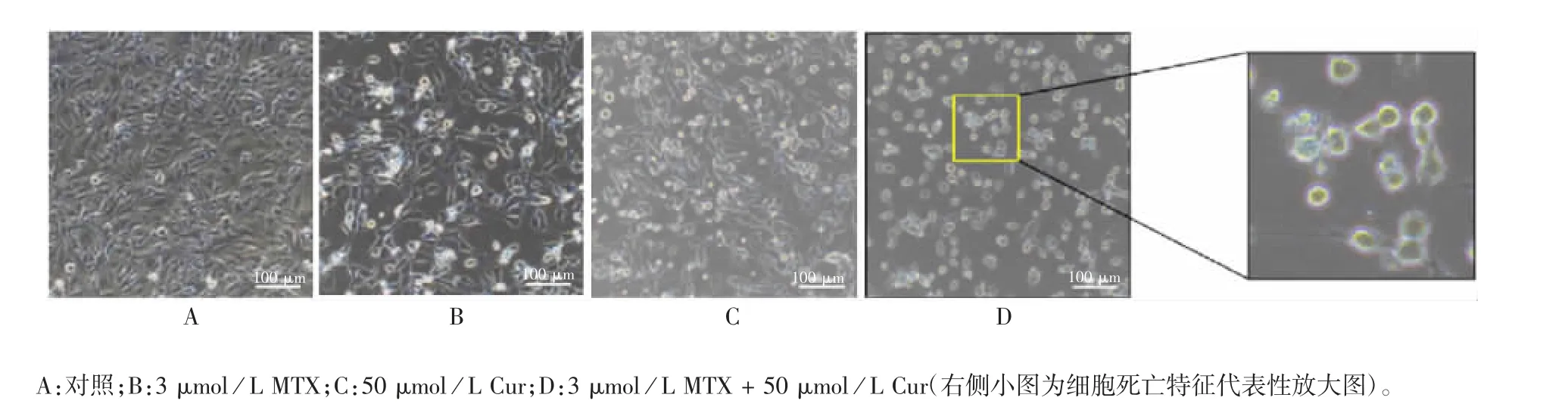
图8 MTX 与Cur 单独或联合处理对TC-1 细胞毒性的显微镜观察(× 200)Fig.8 Microscopy of toxicity of treatment with MTX and Cur alone or in combination to TC-1 cells(× 200)
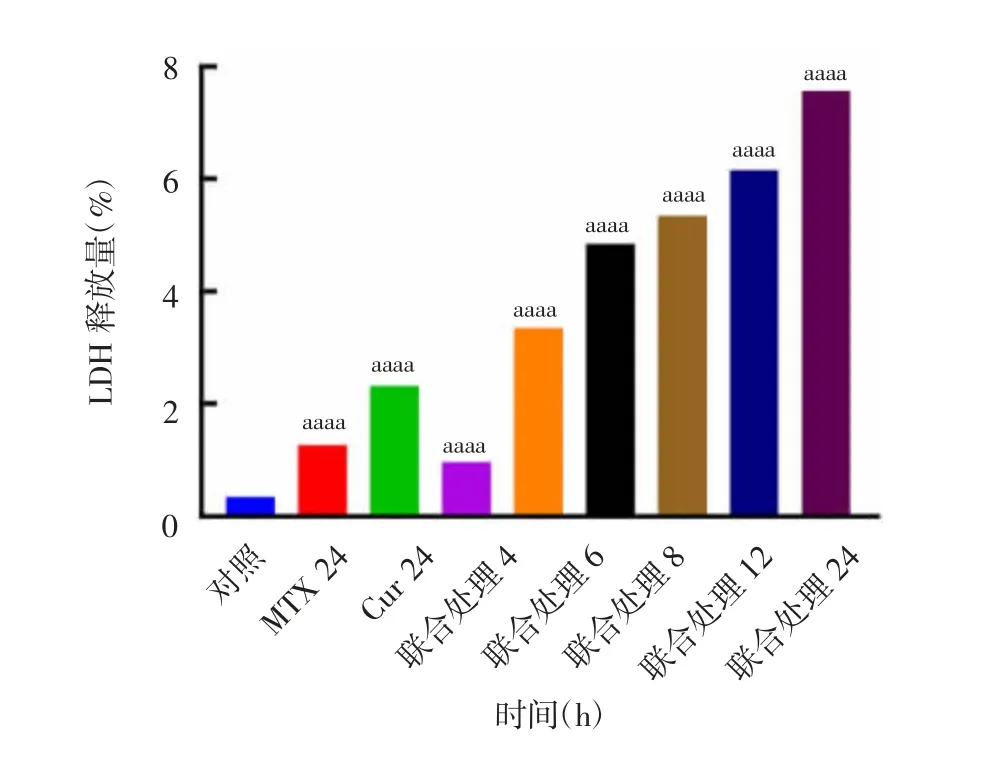
图9 3 μmol/L MTX 与50 μmol/L Cur 联合处理对TC-1 细胞的毒性Fig.9 Toxicity of treatment with 3 μmol/L MTX combined with 50 μmol/L Cur to TC-1 cells
2.4 MTX 与Cur 协同处理对TC-1 细胞发生ICD的影响 3 μmol/L MTX 与50 μmol/L Cur 联合处理TC-1 细胞不同时间后,随着处理时间的延长,细胞上清中释放了比单独处理更多的ATP(t =4092041436 ~ 13672247592;P <0.0001),见图10。3 μmol/L MTX 与50 μmol/L Cur 联合处理后细胞上清中释放的HMGB1 也较单独处理明显增多,且呈现时间依赖性,见图11。表明MTX 与Cur 能够协同诱导TC-1 细胞发生ICD,引起较为理想的免疫原性介质释放。
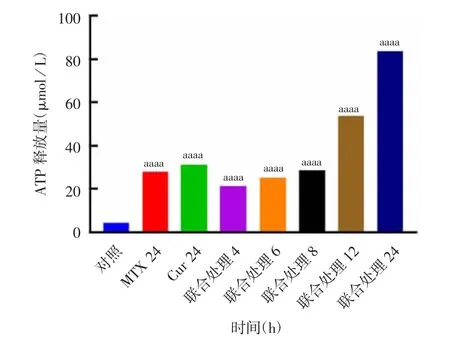
图10 MTX 与Cur 联合处理对细胞上清中ATP 释放的影响Fig.10 Effect of treatment with MTX combined with Cur on ATP release in cell supernatant
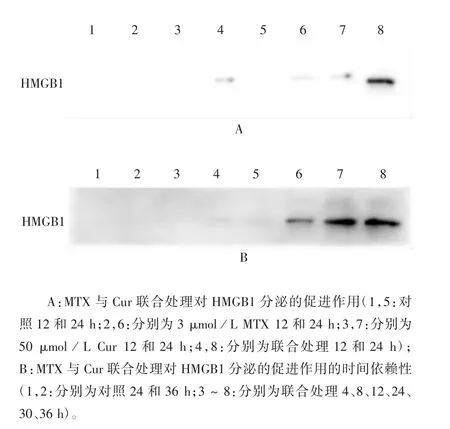
图11 MTX 与Cur 联合处理对细胞上清中HMGB1 释放的影响Fig.11 Effect of treatment with MTX combined with Cur on HMGB1 release in cell supernatant
2.5 MTX 与Cur 联合处理的TC-1 细胞作为肿瘤疫苗的潜力 体内动物实验结果显示,疫苗组小鼠肿瘤得到一定程度控制(t = 2.792,P <0.05);至实验终点,分离死亡小鼠肿瘤和脾脏称重,疫苗组小鼠肿瘤和脾脏重量均低于对照组(t 分为2.864 和3.035;P 均<0.05);两组小鼠体重在监测期间差异无统计学意义(t = 0.7217;P >0.05)。见图12。证明了疫苗的安全性。
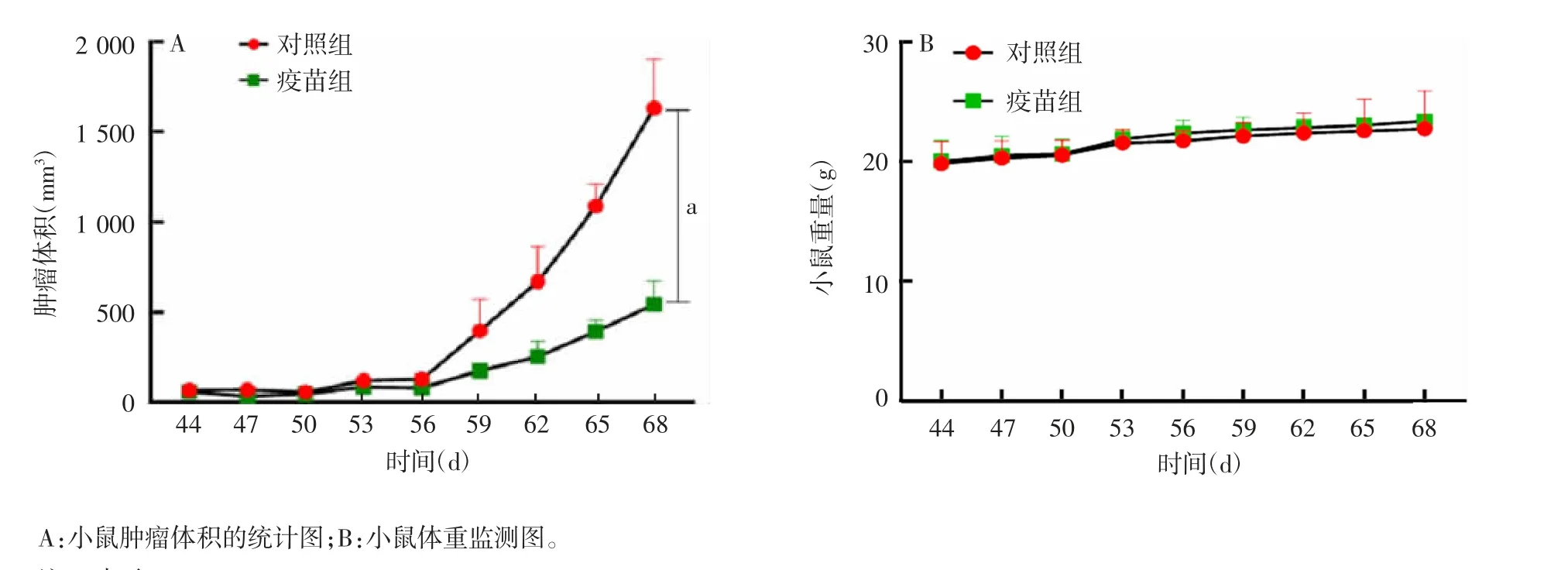
图12 MTX 与Cur 联合处理对C57BL/J 小鼠肿瘤生长的抑制作用Fig.12 Inhibitory effect of treatment with MTX combined with Cur on tumor growth in C57BL/J mice
2.6 MTX 与Cur 联合处理的TC-1 细胞免疫小鼠脾脏、肿瘤组织中分泌IFNγ 的CTL 水平和MDSC水平 流式细胞术分析结果显示,与对照组相比,疫苗组小鼠脾脏和肿瘤组织中分泌IFNγ 的CTL 水平升高(t 分别为8.692 和5.891;P 均<0.01)。与对照组相比,疫苗组小鼠脾脏和肿瘤组织中的MDSC数量被抑制(t 分别为5.745 和9.338;P 均<0.01)。见图13。这与2.5 项肿瘤大小结果一致。
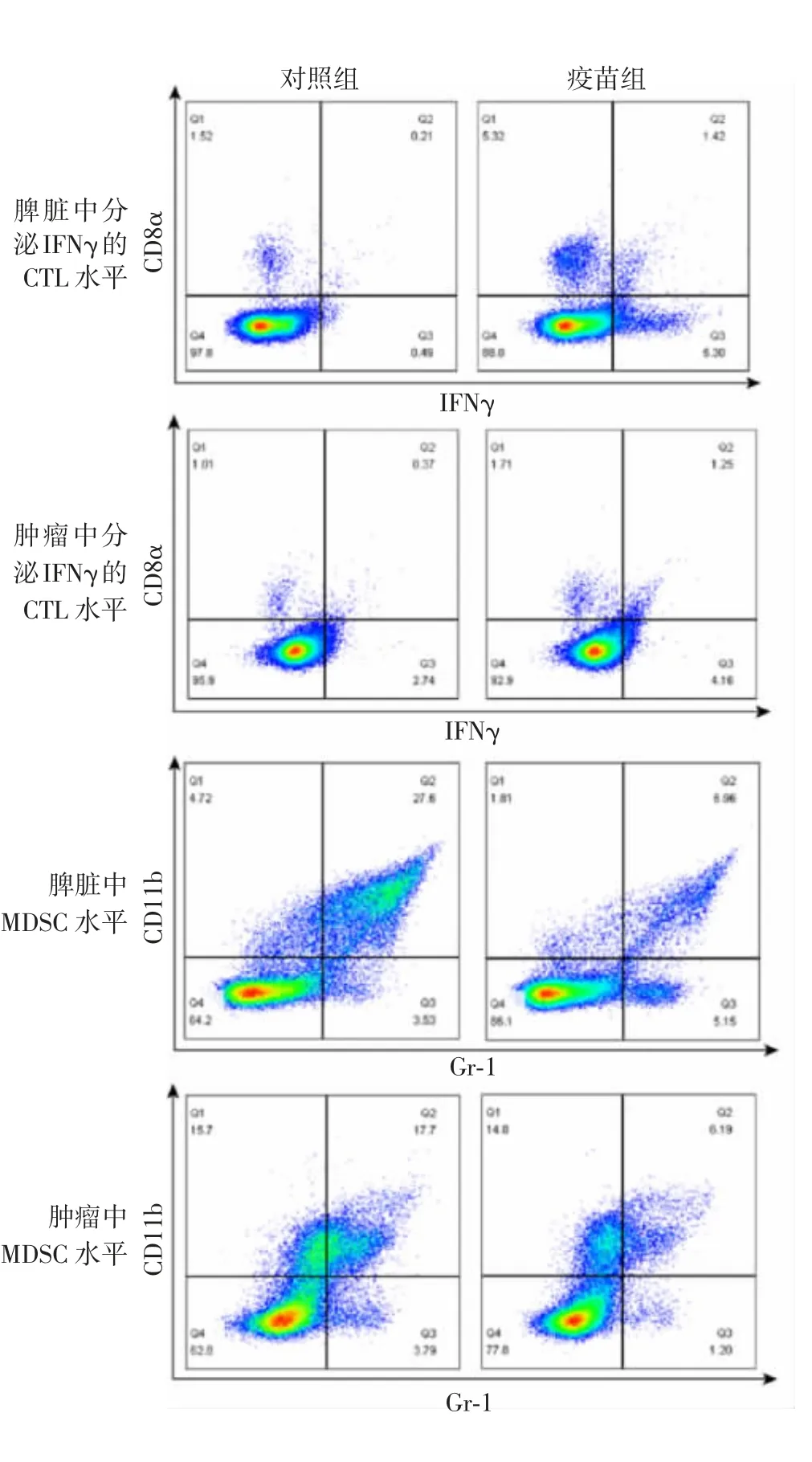
图13 流式细胞术分析小鼠脾脏和肿瘤中分泌IFNγ 的CTL 水平和MDSC 水平Fig.13 Flow cytometry of IFNγ-secreting CTL and MDSC levels in spleen and tumor of mice
3 讨论
目前恶性肿瘤的治疗主要依赖于手术、放疗和化疗,而有效新药的寻找以及药物的毒副作用仍然是临床面临的挑战。免疫疗法在某种程度上似乎为癌症患者带来了全新的希望,如嵌合抗原受体T 细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)、PD-1/PD-L1[17]和细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte antigen 4,CTLA-4)免疫检查点疗法等新手段在临床上展现出较好的疗效。虽然已在多种肿瘤如黑色素瘤,非小细胞肺癌、肾癌和前列腺癌等实体瘤的治疗中展现出强大的抗肿瘤活性,且多个肿瘤免疫治疗药物已经获得美国FDA 批准进入临床应用。但此类药物仅对部分肿瘤有一定疗效,临床上仍有大量患者无法获益。近年来发现化疗药物可诱导肿瘤细胞发生ICD,从而激发理想的抗肿瘤免疫。如何能高效安全地诱导肿瘤细胞发生ICD 并实现肿瘤的免疫治疗应用成为研究的新热点。摸索出低毒高效性且适用于诱导广谱肿瘤细胞发生ICD 的最优配方对有效利用ICD 以达到理想的广谱和个性化治疗均具有重要意义,从而为癌症的临床治疗提供新的思路和方法。
MTX 为合成的含氨基的蒽环类药物,是细胞周期非特异性抗肿瘤药,通过与DNA 分子结合抑制核酸合成而导致细胞死亡。目前已被证实可诱导多种肿瘤细胞发生ICD,且作为疫苗在动物模型中也能激发有效的肿瘤免疫效应[18]。Cur 作为最有前景的一类生物活性天然化合物,在癌症治疗方面具有独特的潜力,其可促使细胞发生氧化应激的特点或许可在ICD 的发生发展中扮演一个理想的辅助角色。目前Cur 与其他药物联合抗肿瘤的研究逐渐被关注,与抗EGFR 单克隆抗体联合治疗皮肤鳞状细胞癌被认为是一种非常有效的疾病控制策略[19]。本研究利用MTX 与Cur 分别或联合对宫颈癌相关细胞TC-1 进行了体外处理,对联合处理后的细胞形态、免疫介质和ICD 分子进行了考察,发现两者均能有效诱导细胞死亡,且联合后效果更佳。此外,经过联合处理的TC-1 细胞作为疫苗可在一定程度上抑制小鼠体内肿瘤生长。肿瘤特异性效应细胞的产生和在肿瘤组织中积累及其功能对于肿瘤细胞的清除起到至关重要的作用。当肿瘤已建立,免疫抑制细胞MDSC 成熟由脾脏迁移至肿瘤组织促使肿瘤免疫抑制微环境的形成,阻碍肿瘤特异性CTL 的杀肿瘤效应并介导免疫逃逸。本研究证明,经过联合处理的TC-1 细胞作为疫苗可在提高脾脏和肿瘤中CTL 水平的同时也降低MDSC 的数量,这对抗肿瘤免疫来说至关重要。
目前临床上使用的药物中可诱导ICD 的不多,且往往能诱导ICD 产生的药物剂量已经对癌症患者造成了严重的毒副作用,因此,高效低剂量的诱导物配方值得进一步探索。本研究发现,MTX 与Cur 联合后能在各自较低浓度时带来诱导结果的理想化,这在临床药物的使用和研究上有一定的指导作用。此外,还可通过将MTX 与Cur 共同整合至纳米肿瘤靶向递送材料中,实现体内直接ICD 的诱导。在ICD诱导物的探索中,存在诱导后细胞状态以及关键条件把控的问题。我们希望诱导ICD 的发生呈现一种缓慢持续的过程,细胞在该过程中持续不断地释放肿瘤抗原和DAMPs,并在诱导物撤除的情况下也能在继续死亡过程的同时依旧释放相关免疫介质,并最终走向死亡。诱导至“将死”状态的细胞才能作为ICD 肿瘤疫苗,因此对诱导物、诱导时间以及细胞状态的把控需要更精细地探索。
综上所述,本研究初步确立了Cur 协同MTX 诱导TC-1 细胞发生ICD 的优化条件,考察了其基本特征并在动物实验中进行了证实,为相关研究的进一步开展以及临床用药奠定了基础。

