H5N1 型流感病毒神经氨酸酶在小鼠模型中的免疫保护性评价
邓涛 ,周建花 ,马宁,刘京,吕传硕,张国梅,周蓉,乐洋,张家友,杨晓明
1.武汉生物制品研究所有限责任公司,湖北武汉 430207;2.国家联合疫苗工程技术研究中心,湖北 武汉 430207;3.中国生物技术股份有限公司,北京 100029
禽类是A 型H5N1 流感病毒的天然宿主,但已证实该病毒可打破物种屏障,在不同宿主甚至人与人之间传播,具有大流行潜力[1-2]。据WHO 统计,2003 — 2018 年全球报告H5N1 确诊病例共860例,其中死亡病例454 例,死亡率超过50%[3]。虽然H5N1 在人群中的确诊病例较少,但极高的死亡率让人们不得不采取预防措施。接种疫苗是预防控制流感的有效措施。目前流感疫苗主要成分为流感病毒血凝素(hemagglutinin,HA),但HA 常发生抗原漂移(antigenic drift)和/ 或抗原转换(antigenic shift),造成疫苗毒株的抗原性与流行毒株不匹配[4-5],从而导致目前的流感疫苗不能有效预防季节性和大流行性流感。据报道,全球范围内季节性流感疫苗效力仅为10% ~60%,大流行性流感疫苗保护率则可能更低[6-7]。
流感病毒表面另一种主要糖蛋白为神经氨酸酶(neuraminidase,NA)。NA 是由4 个完全相同的单体通过非共价结合形成的蘑菇状四聚体,A 型流感病毒根据NA 抗原性分为11 个亚型(N1 ~ N11),B 型和C 型流感病毒NA 不分亚型[8]。NA 是流感病毒传播所必需的蛋白之一,其通过水解宿主细胞膜上的病毒唾液酸受体,从而破坏连接病毒与细胞之间、病毒与病毒之间的唾液酸糖蛋白,防止子代病毒在细胞表面聚集,促进病毒颗粒释放,从而使整个病毒复制周期顺利完成[8-10]。研究表明,NA 的年突变率低于HA,分别为0.45% ~ 1.01%和1% ~ 2%,同时发现HA 和NA 的抗原变化是相互独立的[11]。因此,当HA 发生抗原漂移时,使用NA 免疫可能提供一定程度的保护。还有研究表明,自然感染和免疫接种产生的NA 特异性抗体均具有独立的保护作用[12]。在动物模型中,NA 特异性抗体可防止致命流感病毒的攻击,并与肺部病毒滴度呈负相关[13-16]。此外,豚鼠的NA 疫苗接种可防止病毒在豚鼠间传播[17]。更重要的是,在人类挑战性研究中,NA 特异性抗体与机体感染程度呈负相关[18-20]。
本研究基于前期建立的流感疫苗NA 的分离纯化方法(磁珠法)[21],对制备的H5N1 型流感病毒裂解疫苗原液进行分离纯化获得H5N1 NA 纯蛋白,免疫BLAB/c 小鼠,并进行攻毒试验,在动物模型中评价NA 的免疫原性和免疫保护作用。
1 材料与方法
1.1 病毒和鸡胚 病毒A/reassortant/NIBRG-14(Viet NAm/1194/2004 × Puerto Rico/8/1934,H5N1)工作种子批(代次:3 代)由武汉生物制品研究所有限责任公司病毒性疫苗研究二室提供,批号:202101W01H5;8 ~ 10 日龄SPF 级鸡胚由该公司流感疫苗室提供。
1.2 主要试剂及仪器 TritonX-100(货号:T8787)购自美国Sigma 公司;HRP 标记的山羊抗鼠IgG(货号:D110087)购自生工生物工程(上海)股份有限公司;10 kD 超滤管(货号:MRCPRT010)购自德国Merck公司;TMB 显色底物(货号:421101)购自美国Bio-Legend 公司;PierceTMBCA 蛋白定量试剂盒(货号:A53225)、预染蛋白marker(货号:26617)、Multiskan FC 型酶标仪购自美国Thermo Fisher 公司;12% SDSPAGE 预制胶(货号:M01215C)、Tris-MOPS-SDS(货号:M00138)、4 × SDS 上样缓冲液(货号:M00676)购自南京金斯瑞生物科技有限公司;MF59 佐剂购自湖北葛店人福药用辅料有限责任公司;普通96 孔酶标板(货号:42592)购自美国Corning 公司;非接触式红外体温计购自广州市倍尔康医疗器械有限公司。1.3 实验动物 SPF 级BALB/c 小鼠,雌性,6 ~ 8周龄,体重16 ~ 18 g,由武汉生物制品研究所有限责任公司实验动物室提供并饲养,动物生产许可证号:SCXK(鄂)2017-0013,动物使用许可证号:SYXK(鄂)2014-0012。动物实验已经武汉生物制品研究所有限责任公司动物伦理委员会审查。
1.4 H5N1 型流感病毒裂解疫苗原液的制备及NA的分离纯化 将-80 ℃储存的H5N1 型流感病毒工作种子批室温解冻后接种至鸡胚,每个鸡胚加入100 μL病毒液,37 ℃培养72 h 后,置4 ℃冰箱8 h 冷胚;收获尿囊液,1000×g 离心10 min,去除沉淀杂质,使用10 kD 超滤离心管760 × g 离心10 min,浓缩病毒收获液,置56 ℃灭活病毒1 h;使用0.5% TritonX-100室温裂解病毒3 h,获得H5N1 型流感病毒裂解疫苗原液。采用本研究前期建立的磁珠法[21]分离纯化H5N1 NA,12% SDS-PAGE 分析NA 纯度,BCA 法测定NA 蛋白浓度。
1.5 动物分组及免疫 将BALB/c 小鼠随机分为7组:2 μg NA、10 μg NA、50 μg NA、2 μg NA + MF59、10 μg NA + MF59、50 μg NA + MF59 和MF59 组,每组10 只。MF59 佐剂浓度为100 μg/mL,按体积1 ∶1 与NA 混合均匀后肌内注射。初次免疫2 周后,相同程序/ 剂量进行加强免疫,加强免疫2 周后眼眶后静脉丛采血分离血清,置37 ℃2 h 后,-80 ℃保存备用。
1.6 血清效价检测 采用ELISA 法。用0.05 mol/L 碳酸盐缓冲液(pH 9.6)稀释H5N1 NA 至0.5 μg/mL,4 ℃包被过夜;洗涤拍干,加入200、400、800、1600、3200、6400、12800、25600 倍稀释的血清,100 μL/孔,37 ℃孵育1 h;洗涤拍干,加入HRP 标记的山羊抗鼠IgG(1 ∶25000 稀释),100 μL/孔,37 ℃孵育1 h;洗涤拍干,加入显色液,100 μL/孔,室温避光显色15 min;加入2 mol/L H2SO4溶液,50 μL/孔,终止显色;使用酶标仪测定A450值,cut-off 值定义为PBS测定A450的2.1 倍,高于cut-off 值的最大稀释倍数为相应血清抗体的效价。
1.7 体内保护效果评价 于加强免疫后3 周对BALB/c小鼠进行攻毒。将10-3.5CCID50/0.1 mL 的H5N1型病毒对小鼠进行滴鼻,100 μL/只,监测小鼠攻毒后2 周内体重和体温变化,同时观察临床症状并记录评分。小鼠体重减轻超过攻毒前体重的25%,定义为死亡[22]。使用非接触式红外体温计测定小鼠腹部体温,每只小鼠重复3 次,取均值。临床评分参考GONZALEZ 等[22]所述,即小鼠在以下4 种情况中的每一种情况的严重程度评分(无/ 0 分、轻微/ 1分、中等/ 2 分、严重/ 3 分):皮毛褶皱/ 竖毛、嗜睡/蜷缩不好动、瘦弱/ 驼背和呼吸困难,每日记录小鼠的临床症状评分。
1.8 统计学分析 采用SPSS 22.0 软件进行统计学分析,组间均数采用非配对的t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 NA 的纯度及浓度 纯化的NA 经12% SDSPAGE 分析,纯度为90%,见图1。纯化后NA 浓度为201.23 μg/mL,标准曲线见图2。
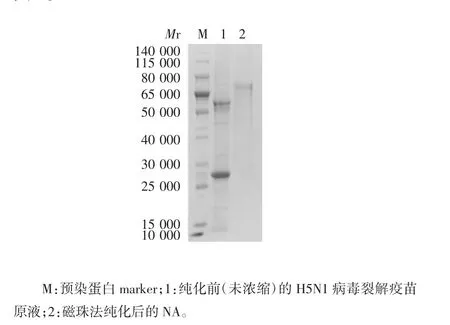
图1 磁珠法纯化H5N1 NA 的SDS-PAGE 分析Fig.1 SDS-PAGE profile of H5N1 NA purified with magnetic beads
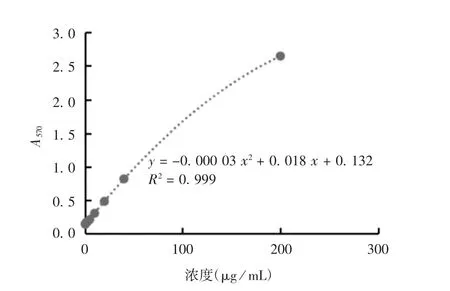
图2 BCA 法标准曲线Fig.2 Standard curve of BCA
2.2 NA 特异性抗体效价 2 μg NA、10 μg NA、50 μg NA、2 μg NA+MF59、10 μg NA+MF59、50 μg NA +MF59 和MF59 组抗体平均效价分别为20000、40000、73600、46400、38400、121600、400,各剂量组血清效价呈剂量依赖性,2、10、50 μg NA+MF59组血清效价均高于相应未加佐剂的2、10、50 μg NA组(t 分别为2.611、4.254 和2.835;P 均< 0.05),见图3。50 μg NA + MF59 组效价最高,因此,后续选择该组随机8 只小鼠和MF59 组随机8 只小鼠进行攻毒试验。
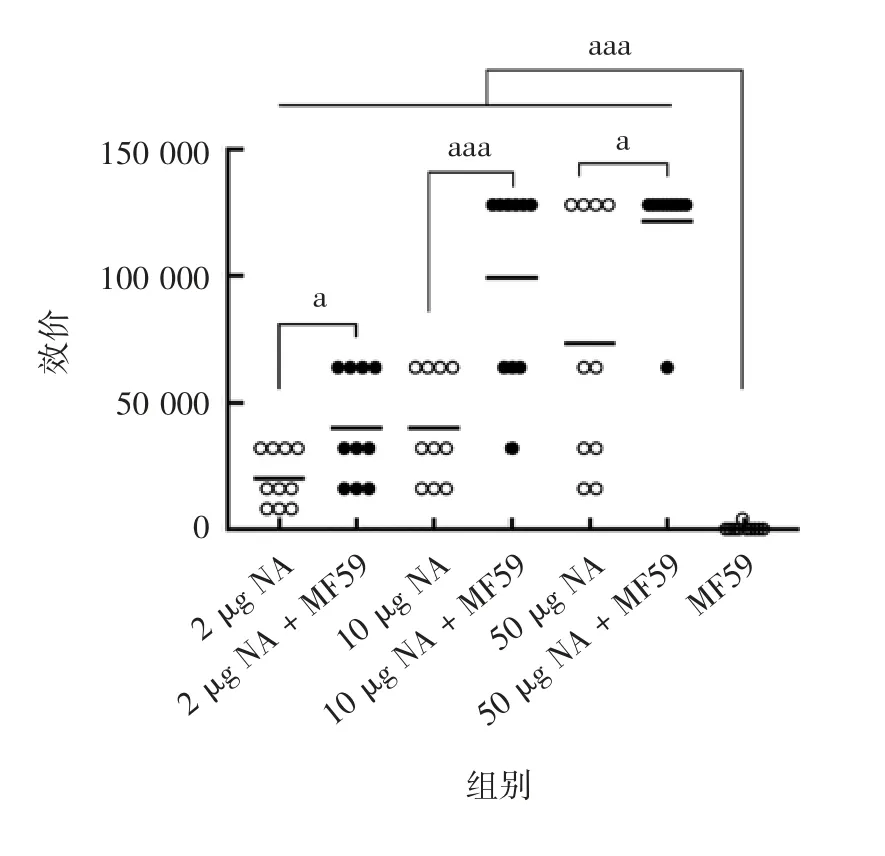
图3 血清抗体效价ELISA 检测结果Fig.3 ELISA of serum antibody titer
2.3 体内保护效果 与攻毒前1 天小鼠体重比较,MF59 组小鼠体重从攻毒后开始下降,至攻毒后第6天平均体重变化率下降至最低后逐渐恢复,而50 μg NA+MF59 组小鼠体重未见明显变化,见图4。MF59组攻毒后导致50%小鼠(4 只)死亡,而50 μg NA +MF59 能保护100%(8 只)小鼠免受同种病毒致命攻击,见图5。
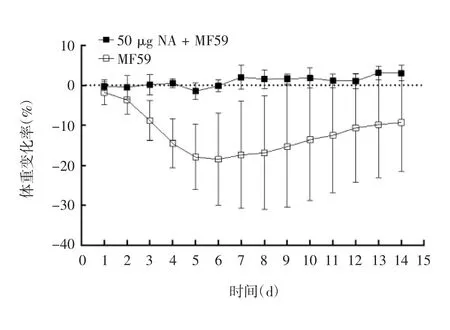
图4 攻毒后小鼠体重变化Fig.4 Change of body weight of mice after challenge
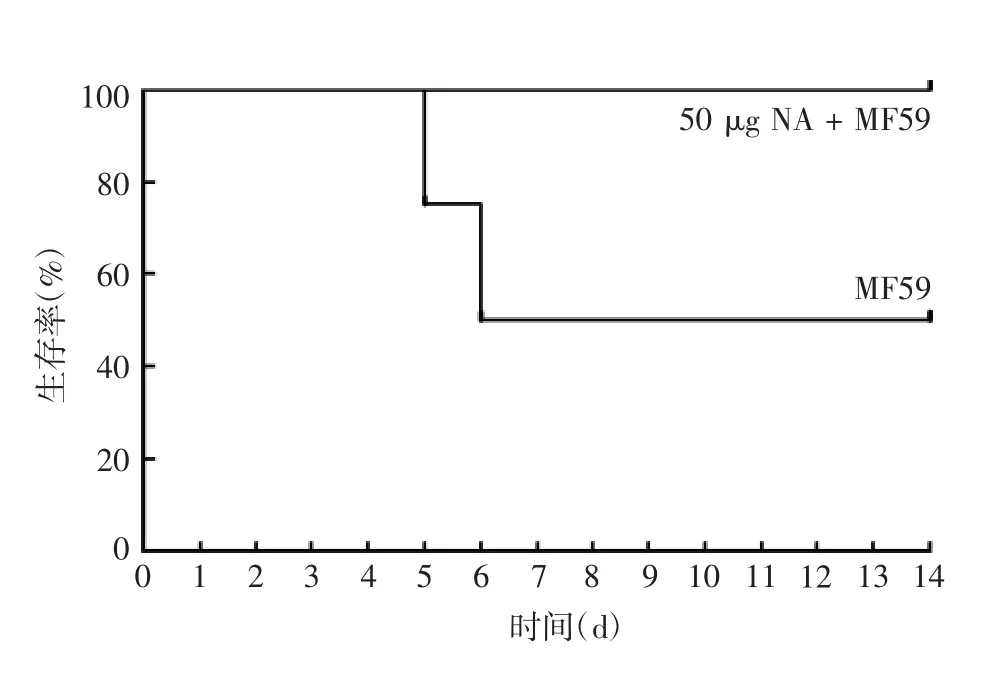
图5 H5N1 攻毒后小鼠生存曲线Fig.5 Survival curve of mice after challenge with H5N1 influenza virus
攻毒后临床症状监测发现,免疫NA 能够减轻小鼠感染H5N1 后的临床症状,见图6。两组小鼠体温差异无统计学意义(t = 0.8691,P > 0.05),见图7。
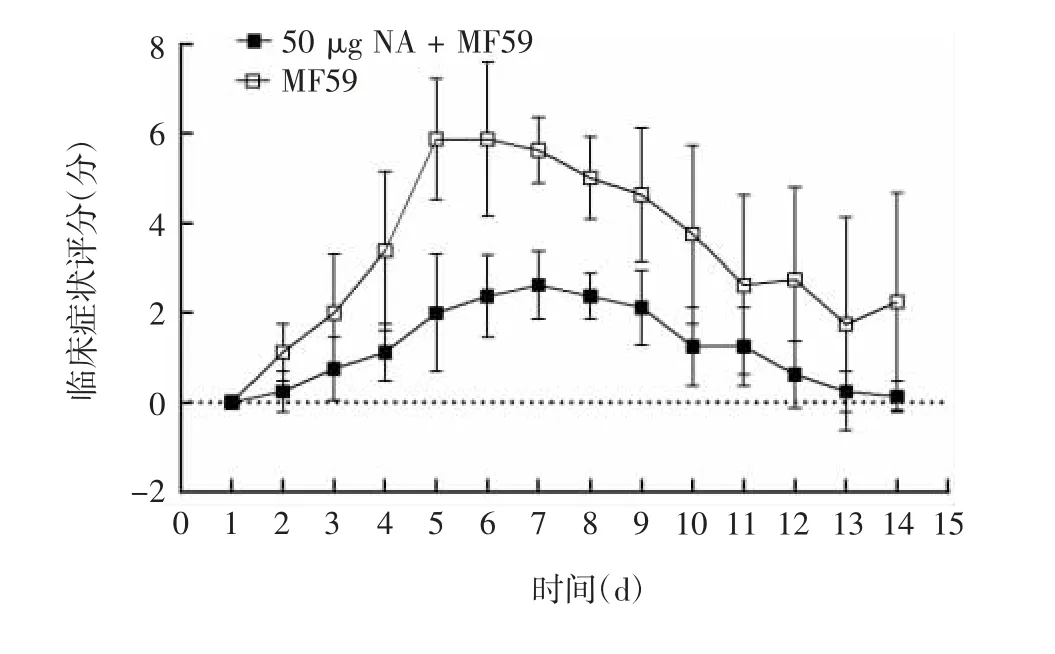
图6 H5N1 攻毒后小鼠临床症状评分Fig.6 Scores for clinical symptom of mice after challenge with H5N1 influenza virus
图7 H5N1 攻毒后小鼠体温变化Fig.7 Change of body temperature of mice after challenge with H5N1 influenza virus
3 讨论
H5N1 跨越物种传播的能力,以及毒性的增强,对制定明确的战略以防止这一高致病性禽流感病毒的大流行提出了挑战[23]。当前流感疫苗研究仍集中在HA 上,但由于HA 存在的抗原漂移或抗原转换,导致目前的流感疫苗保护效力并不理想。研究表明,无论自然感染还是免疫接种诱导产生的NA抗体均具有独立的保护作用[12]。在临床前研究中,使用NA 免疫的动物可抵抗致死剂量流感病毒的攻毒挑战[15-16]。此外,人体的NA 特异性免疫反应也与保护受试者免受病毒感染有关[19-20]。因此本实验着重研究了物理方法纯化的H5N1 NA 的免疫原性,并进行攻毒试验。
MF59 是一种水包油乳剂,其是将吐温80、山梨糖醇三油酸酯和角鲨烯混合后于高压条件下进行微流化形成的均一的小滴状乳液。MF59 也是目前唯一用于商用流感疫苗的佐剂,能够增强免疫力低下人群对流感疫苗的免疫原性[24]。本研究使用MF59佐剂相同剂量免疫2 次后,加MF59 相应剂量组的滴度均远高于相应未加MF59 剂量组,最高滴度组(50 μg NA + MF59 组)平均滴度达121600。磁珠法纯化的NA 免疫BALB/c 小鼠诱导产生的抗体呈剂量依赖性,使用MF59 佐剂组能提高抗体滴度。攻毒试验结果显示,50 μg NA + MF59 组小鼠平均体重在第5 天观察到轻微下降,而MF59 组小鼠平均体重从攻毒后第2 天开始下降,第6 天最低,第7 天开始升高。MF59 组组内差异较大,表明不同小鼠因个体差异,对H5N1 反应有所不同。MF59 组有50%小鼠死亡,而50 μg NA + MF59 组100%保护H5N1攻击。我们同时还监测了临床症状,发现免疫NA与纯佐剂组比较,能够有效减轻H5N1 攻毒后临床症状。但未观察到体温变化差异,与BELSER 等[25]报道一致,小鼠在流感病毒感染后不会发热或出现易于测量的呼吸道临床症状。
综上所述,免疫磁珠法纯化的H5N1 NA 在BALB/c小鼠体内均能诱导产生NA 特异性抗体,MF59 佐剂能够显著提高抗体效价。免疫H5N1 NA + MF59 能够保护BALB/c 小鼠受到H5N1 攻击,还能明显减轻临床症状。

