非小细胞肺癌患者化疗前后肠道微生态菌群多样性变化及其与预后的相关性
印滇, 杨莉, 王以浪, 曹莉莉
(南通市第一人民医院 & 南通大学第二附属医院 肿瘤科, 江苏 南通 226001)
非小细胞肺癌(non-small celllung cancer,NSCLC)是肺癌的一种类型,多发于老年人,严重威胁着患者的生命健康和安全,研究NSCLC的预后相关因素具有重要的临床意义[1-3]。肠道微生态菌群是人体内最复杂的微生物系统,参与机体物质代谢过程,肠道菌群失调可能导致疾病的发生[4-6]。研究发现[7],肠道菌群可能影响部分恶性肿瘤的发病,与肿瘤关系密切,当肠道菌群失调时,肠道对致病菌、条件致病菌的拮抗作用减弱,导致致病菌数量、种类增加以及构成比变化,使肠道黏膜出现炎症与损伤,促使化疗引起的消化道上皮杯状细胞进一步减少、肠道菌群营养失衡引发异常修复,最终可致胃肠道肿瘤形成[8]。产丁酸菌作为肠道内菌群的一种,报道认为产生的丁酸盐可进入肿瘤细胞的细胞核内影响肿瘤细胞DNA的复制和转录,在肿瘤的发生发展中有一定作用[9],研究发现肺癌患者的肠道产丁酸菌明显少于健康人群[10]。关于肠道菌群的多样性变化对化疗患者的预后影响较少有相关报道,本研究旨在探讨肠道微生态菌群多样性变化与NSCLC患者化疗预后的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年5月—2019年5月确诊的NSCLC患者40例。纳入标准:经病理检查确诊为NSCLC;首次进行化疗,方案为顺铂、培美曲塞联合化疗;所有患者肠道微生态菌群标本采集前均未接受过手术或放化疗治疗;所有患者因基因不匹配或经济等原因未选择免疫治疗或靶向治疗。排除标准:(1)合并冠心病、糖尿病、高血压等疾病;(2)合并消化系统手术史;(3)合并细菌性肺炎、胆囊炎、胃肠炎等感染性疾病;(4)入组前21 d内使用抗生素、肠道微生态制剂、口服通便药等。40例NSCLC患者,男25例、女15例,年龄47~75岁、平均(60.16±14.23)岁;病理类型,腺癌21例、鳞癌13例、鳞腺癌6例;临床分期,Ⅰ期22例、Ⅱ期15例、Ⅲ期3例。另选择同时期健康体检者40例为对照组,男23例、女17例,年龄49~76岁、平均(62.05±15.27)岁,均排除恶性肿瘤、高血压、糖尿病、冠心病以及血脂异常者。
1.2 方法
1.2.1治疗方法 所有患者采取培美曲塞联合顺铂的化疗方案:化疗前1 d开始口服地塞米松,4 mg/次,2次/d,连续3 d;化疗当天予以生理盐水100 mL+培美曲塞(500 mg/m2)静滴,10 min以上,5%葡萄糖溶液500 mL+顺铂(75 mg/m2)静滴4 h;3周为1个疗程。
1.2.2检测方法 对照组采集新鲜粪便1次,NSCLC患者采集新鲜粪便两次(化疗前1 d和化疗后第3 天各1次),粪便分别置入采集管中[含有脱氧核糖核酸(deoxyribonucleic acid,DNA)稳定剂],分装至EP管中,保存于-80 ℃的冰箱中备用;提取所有样本菌群DNA,进行定量聚合酶链反应(quantitative PCR,Q-PCR)检测,统计分析肠道中微生物的种类以及相对丰度,记录微生物多样性。检测产丁酸菌(普拉梭菌、Atopobiumcluster-specificprimes、柔嫩梭菌、Roseburiaspp. andE.rectale、梭菌组1、ClusterⅣRuminococcusspp、ClostridialclusterⅩⅣa、直肠真杆菌)表达水平,因数据差异过大本研究取对数值进行比较。
1.3 观察指标
(1)比较NSCLC组与对照组肠道产丁酸菌差异。(2)比较NSCLC患者化疗前后肠道产丁酸菌差异。(3)比较NSCLC患者化疗前后肠道菌群的丰富度(R=s,s为物种数目)、多样性指数[D=1-Σ(ni/N)2,Σ上面是S,Σ下面是i=1,S为物种数目,ni表示第i个物种的个体数,N为所有物种的个体总数]。(4)开始化疗后随访1年,记录患者生存情况,分析化疗前后肠道菌群的丰富度、多样性指数变化与预后的相关性。
1.4 统计学方法
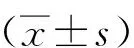
2 结果
2.1 一般资料
纳入符合研究标准的NSCLC患者45例,因化疗不耐受或其他原因中途退出研究5例,实际完成入组40例。NSCLC组与对照组一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 NSCLC组与对照组一般资料比较Tab.1 Comparison of general data between NSCLC group and control group
2.2 肠道产丁酸菌表达水平
NSCLC组患者粪便中普拉梭菌、Atopobiumcluster-specificprimes、柔嫩梭菌、Roseburiaspp.andE.rectale、梭菌组1、ClusterⅣRuminococcusspp、ClostridialclusterⅩⅣa、直肠真杆菌表达均低于对照组,差异具有统计学意义(P<0.05)。见表2。
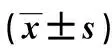
表2 两组受试者的肠道产丁酸菌表达水平比较Tab.2 Expression level of intestinal butyrate-produced
2.3 NSCLC患者化疗前后肠道产丁酸菌表达水平比较
化疗后,NSCLC组患者粪便中普拉梭菌、Atopobiumcluster-specificprimes、柔嫩梭菌、Roseburiaspp.andE.rectale、梭菌组1、ClusterⅣRuminococcusspp、ClostridialclusterⅩⅣa、直肠真杆菌的表达均低于化疗前(P<0.05)。见表3。
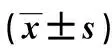
表3 NSCLC组患者化疗前后肠道产丁酸菌表达水平比较Tab.3 Expression of intestinal butyrate-produced bacteria in patients with NSCLC before and
2.4 NSCLC患者化疗前后肠道菌群丰富度、多样性指数
NSCLC患者化疗后肠道菌群丰富度、多样性指数低于化疗前,差异有统计学意义(P<0.05)。见表4。
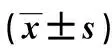
表4 NSCLC患者化疗前后肠道菌群丰富度及多样性指数Tab.4 Changes of intestinal flora in patients with NSCLC before and after
2.5 NSCLC患者肠道菌群变化与预后的相关性
化疗后1年随访,12例患者死亡,28例患者存活。丰富度和多样性指数降低的患者1年后死亡的比例更大Pearson相关性分析结果显示,化疗前后肠道菌群的丰富度和多样性指数变化与预后有相关性(r=0.214、0.302,P<0.05)。见表5。
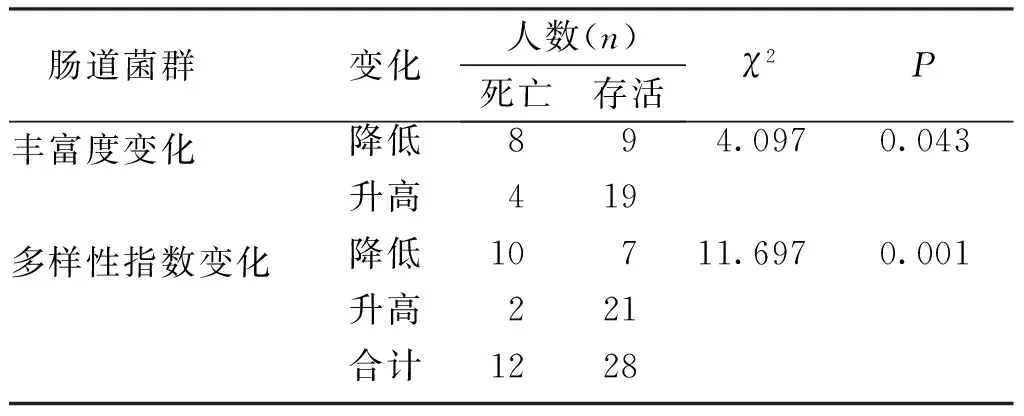
表5 NSCLC患者肠道菌群变化与预后的相关性Tab.5 Correlation between intestinal flora changes and prognosis in patients with NSCLC
3 讨论
肠道菌群主要通过代谢、营养吸收、参与免疫应答等机制参与调节机体平衡,在人体健康状态下处于动态平衡状态,但机体处于中毒或受到其他恶性环境刺激时,可引起菌群失调,进而使人体的代谢及免疫平衡紊乱[11-13]。产丁酸菌作为一种益生菌,其作用是抑制有害细菌生长、促进营养物质吸收以及协同乳酸杆菌改善肠道功能[14-15]。产丁酸菌在组蛋白的乙酰化和去乙酰化进程中的发挥重要作用,可通过肠道内的代谢产物丁酸调控去乙酰化酶活性,进而对细胞周期、基因转录、DNA复制等生理过程产生影响[16-17]。此外,丁酸可通过下调结肠癌细胞的癌基因表达抑制细胞增生,也可下调环氧化酶表达来抑制肠微血管生成,提示肠道产丁酸菌有抑制肿瘤生长的作用[18-19]。
本研究对NSCLC患者和健康人的肠道产丁酸菌表达情况进行了检测,结果显示,NSCLC组普拉梭菌、Atopobiumcluster-specificprimes、柔嫩梭菌、Roseburiaspp.andE.rectale、梭菌组1、ClusterⅣRuminococcusspp、ClostridialclusterⅩⅣa、直肠真杆菌表达低于对照组,表明NSCLC患者存在肠道菌群紊乱。化疗是治疗NSCLC的主要手段之一,但药物在治疗过程中会损伤机体正常的组织机构,因此患者发生院内感染、骨髓抑制等并发症的概率较高,不利于预后[20-21]。本研究对患者化疗前后肠道菌群的变化进行了探讨,发现NSCLC患者化疗后普拉梭菌、Atopobiumcluster-specificprimes、柔嫩梭菌、Roseburiaspp.andE.rectale、梭菌组1、ClusterⅣRuminococcusspp、ClostridialclusterⅩⅣa、直肠真杆菌表达低于化疗前,说明化疗可能加重肠道菌群失衡,下调患者肠道产丁酸菌表达水平,患者并发感染的概率增加,不利于预后。
肠道菌群种类较多,丰富度、多样性指数是评价肠道菌群总体情况的有效指标。陈晓慧等[22]研究认为,肺癌患者铂类药物化疗后肠道菌群的丰富度和多样性下降,菌群构成发生改变,益生菌减少而条件致病菌增加。本研究结果显示,NSCLC患者化疗后肠道菌群丰富度、多样性指数低于化疗前,差异有统计学意义(P<0.05);40例患者中,17例患者出现肠道菌群种类丰富度、多样性指数降低,其余患者升高,且丰富度和多样性指数降低的患者1年后死亡的几率更大,证明化疗前后肠道菌群的丰富度和多样性指数变化与预后有相关性。分析原因认为,人体肠道菌群平衡被破坏后,条件致病菌增加而益生菌减少,可能引起感染等并发症,从而导致预后不佳;产丁酸菌等益生菌有抑制肿瘤血管生成的作用,有利于改善患者预后[23-24]。因此临床上需密切关注NSCLC患者化疗过程中的肠道菌群变化,发现多样性出现不良改变时可考虑予以益生菌干预,辅助增强化疗效果。
综上所述,NSCLC患者肠道产丁酸菌产生减少,经化疗治疗后会进一步减少,而肠道菌群的丰富度和多样性指数降低不利于患者预后,因此在NSCLC患者化疗过程中应密切关注其肠道菌群变化,可适当的予以益生菌干预以改善预后。

