Ndfip2表达对肝癌细胞增殖和凋亡的影响及机制*
张强, 罗彩云, 孙达权, 曾志锐, 郑志菊, 徐国强,3**
(1.贵州医科大学 基础医学院, 贵州 贵阳 550025; 2.贵阳市第二人民医院 手术室, 贵州 贵阳 550023; 3.贵州医科大学第三附属医院 医学研究中心, 贵州 都匀 558000)
肝细胞癌(hepatocellular carcinoma, HCC)是常见的原发性肝癌,也是癌症相关死亡的第二大主要原因[1-3]。手术切除是根治性治疗肝癌最常见的方法,但是术后5年生存率并不理想,根本原因在于手术切除后肿瘤复发和远处转移的几率很高[4-5]。因此,更好地了解肝癌增殖及凋亡的分子机制对预防肝癌细胞的复发与转移具有重要意义。Nedd4家族交互作用蛋白2(nedd4 family interacting protein 2,Ndfip2)是Nedd4家族交互作用蛋白中的一员,可与Nedd4家族蛋白的 WW 结构域结合,能够激活E3泛素蛋白连接酶中Nedd4家族成员[6]。近年来,有研究发现,Ndfip2通过PTEN/Akt信号通路、MAP激酶信号通路等调控细胞的增殖和转移等生物学行为[7-8],然而Ndfip2基因对肝癌细胞生物学行为的影响仍旧不清楚。因此,为了进一步探究Ndfip2对肝癌细胞增殖和凋亡能力的影响,本实验通过沉默Ndfip2在肝癌细胞SMMC-7721和HepG2中的表达,观察Ndfip2低表达对肝癌细胞增殖和凋亡能力的影响,探讨其可能的作用机制。
1 材料与方法
1.1 细胞及试剂
人正常肝细胞株LO2、人肝癌细胞株SMMC-7721、HepG2购自中国科学院昆明细胞库, RPMI-1640培养基和青-链霉素购自美国HyClone公司,新生牛血清(FBS) 购自四季青公司,二甲基亚砜(DMSO)购自Sigma公司,Ndfip2-siRNA序列由上海吉玛基因公司合成。LipofectamineTM 2000购自美国Invitrogen公司,SDS-PAGE凝胶制备试剂盒购自北京索莱宝生物公司,BCA蛋白浓度定量试剂盒购自上海碧云天生物技术公司,RIPA裂解液和PMSF酶抑制剂购自武汉博士德生物公司,PVDF膜购自Millipore公司,高敏ECL曝光液购自上海碧云天生物技术公司,兔抗人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten,PTEN)多克隆抗体购自美国Abcam公司,兔抗人Nedd4家族交互作用蛋白2(nedd4 family interacting protein 2,Ndfip2)多克隆抗体购自美国Affinity公司,兔抗人磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、兔抗人磷酸化Akt (Ser473) [phospho-Akt(Ser473),p-Akt(S473)]、兔抗人蛋白激酶B(protein kinase B,PKB、又称为Akt) 、兔抗人基质金属蛋白酶1(matrix metalloproteinase 1, MMP-1)、兔抗人半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、鼠抗人Bcl2关联X蛋白(Bcl2-associated X protein,Bax) 、兔抗人B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl2)多克隆抗体购自武汉三鹰公司,兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体购自巴傲得生物科技有限公司,辣根过氧化物酶标记的山羊抗兔、山羊抗鼠IgG(二抗)购自武汉三鹰公司,CCK-8试剂购自武汉博士德生物工程有限公司。
1.2 研究方法
1.2.1细胞培养 人正常肝细胞株LO2、人肝癌细胞株SMMC-7721及HepG2,在37 ℃、5%培养箱内常规培养,当细胞融合率70%~80%时,用0.25%胰酶消化并传代、进行后续的实验,此3种细胞均为贴壁生长。
1.2.2si-RNANdfip2沉默细胞株的构建 将细胞按1×106个/孔,铺于12孔板待长到50%~70%时对细胞进行瞬时转染,转染前2 h将12孔换成新鲜无血清RPMI-1640培养基,取siRNA(1D),瞬时离心后加入125 μL DEPC处理水配成工作溶液。取两个1.5 mL离心管,一管加入4 μL Lipo2000与200 μL 无血清RPMI-1640培养基后混匀,另一管加入4 μL siRNA与无血清200 μL RPMI-1640培养基后混匀、室温静置5 min;混匀上述两个离心管中的液体,室温静置20 min,实验组中每孔各加入204 μL混合液,然后每孔补充796 μL 无血清RPMI-1640培养基,继续培养6 h后换成含20 % FBS的新鲜RPMI-1640培养基,转染完成后,采用蛋白印迹法检测转染效率。Ndfip2特异性si-RNA的正义链序列为5′-GGAAGAGUGUCCACCAACATT-3′,反义链序列为5′-UCUUGGUGGACACUCU- UCCTT-3′,阴性对照的正义链序列为5′-UUCUCCGAACGUGUCACGU-3′,反义链序列为5′-ACGUGACACGUUCGGAGAA-3′。
1.2.3实验分组 SMMC-7721细胞分为Ndfip2-siRNA沉默对照组(NC)和Ndfip2沉默组(si-Ndfip2),HepG2细胞分为Ndfip2-siRNA沉默对照组(NC)和Ndfip2沉默组(si-Ndfip2)。
1.2.4CCK-8实验检测肝癌细胞的增殖能力 将转染完成的各组细胞按每孔5×103个细胞悬液接种于96 孔板中,使用CCK-8 试剂盒检测细胞增殖,每组3个或以上复孔,在0、24、48 h时分别按照试剂说明书加入CCK-8试剂,37 ℃培养箱孵育1 h后酶标仪检测各组细胞450 nm处的吸光度。计算细胞增殖率,细胞增殖率(%)=[(实验孔-空白孔)/(对照孔-空白孔)] ×100%。
1.2.5平板克隆形成实验检测肝癌细胞的增殖能力 将转染完成的各组细胞接种于6孔板,每孔细胞为1 000个,常规培养10~12 d,当出现肉眼可见的克隆集落时终止培养;弃去培养液,小心用PBS冲洗1~2次,加入4%多聚甲醛溶液固定细胞15 min,然后用0.1%结晶紫溶液染色20 min;弃去染料,用PBS进行冲洗,在自然光状态下拍照、并进行计数统计分析。
1.2.6流式细胞术检测肝癌细胞凋亡能力 将转染完成的各组细胞用不含EDTA的胰酶消化后,进离心2 000 r/min 、4 ℃ 5 min;弃去上清液,用预冷的PBS洗涤细胞两次,每次洗涤后4 ℃离心2 000 r/min 5 min;收集细胞,用移液枪吸尽PBS,然后加入100 μL的1×Binding buffer,将细胞重悬,接着依次加入Annexin V-FITC 5 μL和PI Staining Solution 10 μL,轻轻震荡混匀。避光,反应约15 min,最后加入1×Binding buffer 400 μL、混匀并放置于冰上,流式细胞仪分析各组细胞的凋亡能力。
1.2.7蛋白印迹法(Western blot)检测肝癌细胞中Ndfip2、凋亡相关蛋白(Caspase3、Bax、Bcl2)以及PTEN-PI3K/Akt通路蛋白[PTEN、PI3K、Akt、p-Akt(S473)、MMP1]的表达 收集各组细胞,经RIPA裂解液裂解,使用BCA定量法进行定量,配制10%的SDS-PAGE凝胶进行电泳,每孔蛋白上样量为10 μL;后将蛋白转至PVDF膜,37 ℃、5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,洗膜(1×TBST,3次,5 min/次),二抗[辣根过氧化物酶标记的山羊抗兔(稀释度均为1 ∶2 000)]室温孵育2 h,洗膜,在膜上均匀铺上曝光液ECL,在凝胶成像系统内测定结果;用Quantity One系统分析目的条带并获取目的条带的灰度值进行分析。本实验使用GAPDH作为蛋白质标准化的内参,用目的蛋白的灰度值与内参蛋白的灰度值的比值表示目的蛋白的相对表达量,p-Akt(S473)蛋白相对表达量为p-Akt(S473)蛋白条带灰度值与总Akt蛋白条带灰度值的比值。
1.3 统计学分析
2 结果
2.1 Ndfip2的表达水平
结果显示,与正常肝细胞LO2组比较,Ndfip2在肝癌细胞SMMC-7721组、HepG2组中表达升高,差异有统计学意义(P<0.05)。见图1。
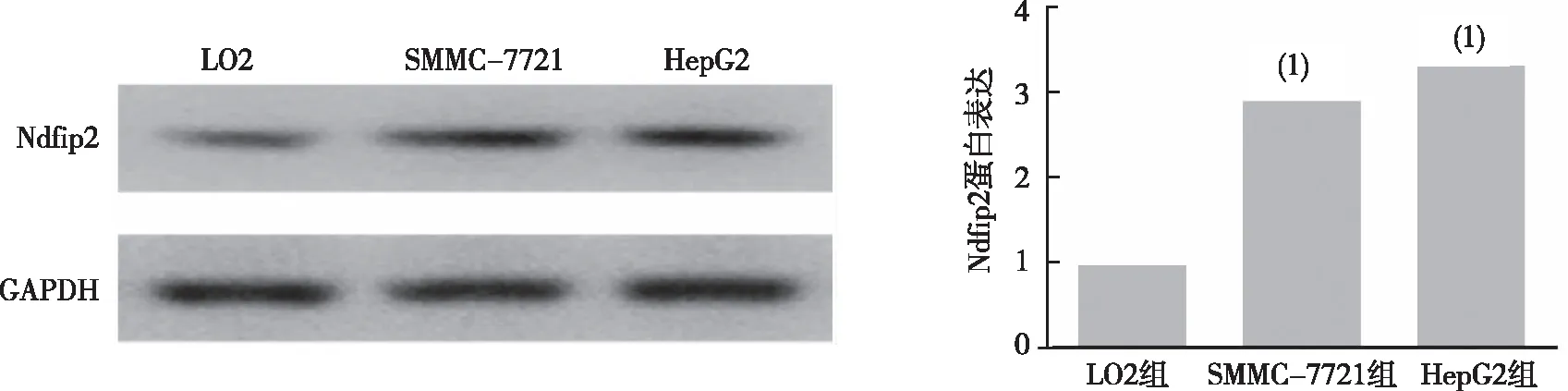
注:(1)与LO2组比较,P<0.05。图1 Ndfip2在正常肝细胞LO2、肝癌细胞株SMMC-7721和HepG2组中的表达Fig.1 Ndfip2 expression levels in normal liver cell line LO2, HCC lines SMMC-7721, and HepG2
2.2 Ndfip2 siRNA转染肝癌细胞株
结果显示,si-Ndfip2组SMMC-7721和HepG2细胞中的Ndfip2的表达水平较NC组细胞下调,差异有统计学意义(P<0.05),提示Ndfip2低表达肝癌细胞构建成功。见图2。
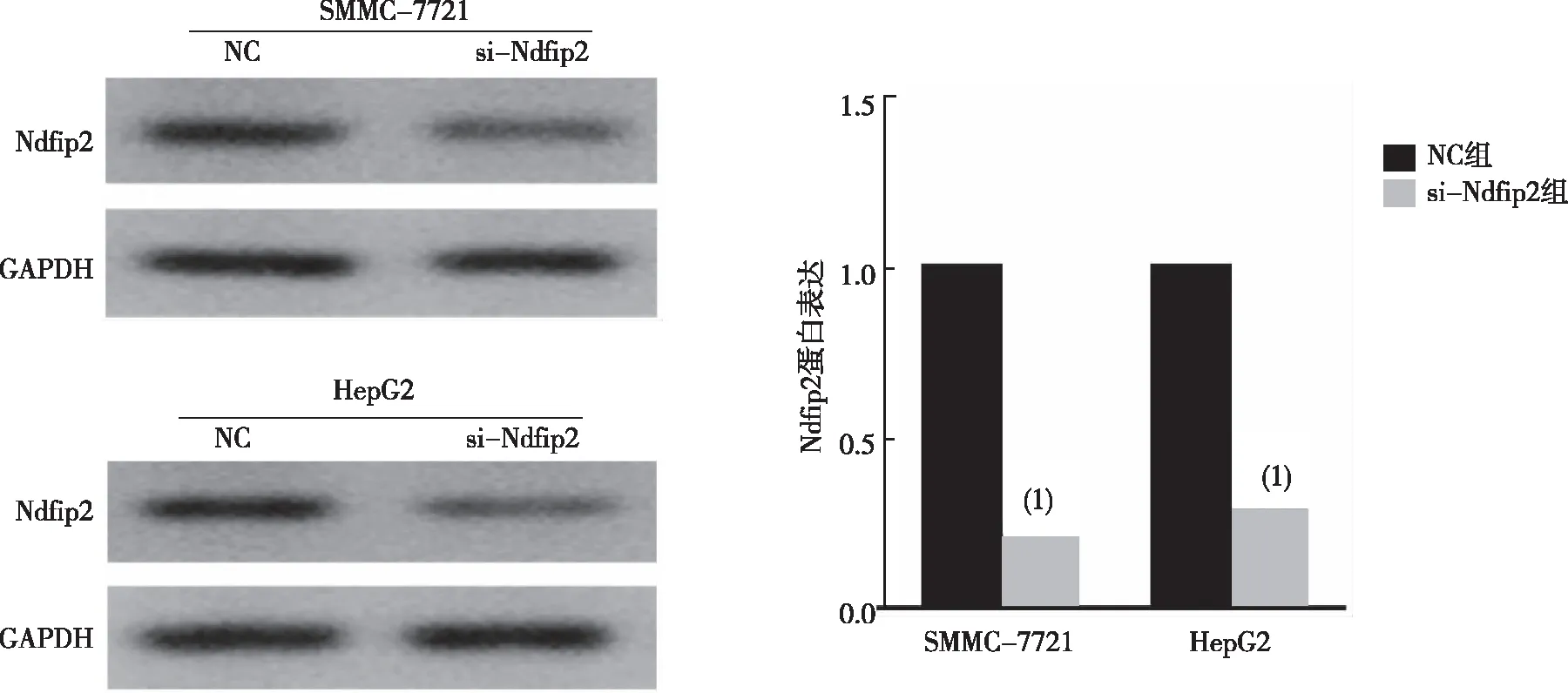
注:(1)与NC组比较,P<0.05。图2 构建Ndfip2低表达细胞株Fig.2 Construction of silencing Ndfip2 expression in HCC lines
2.3 沉默Ndfip2对肝癌细胞增殖能力的影响
CCK-8实验(图3A)结果显示,与NC组比较,48 h时SMMC-7721和HepG2细胞si-Ndfip2组D值均明显减少,差异有统计学意义(P<0.05)。平板克隆形成实验(图3B、C)结果显示,si-Ndfip2组的SMMC-7721和HepG2细胞克隆形成数低于NC组,差异有统计学意义(P<0.05)。
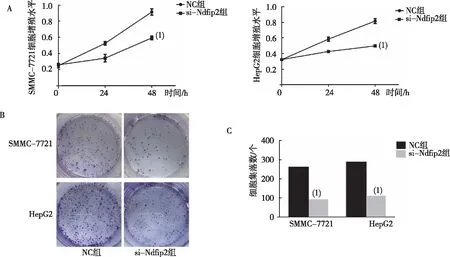
注:A为CCK-8实验结果,B、 C为平板克隆形成实验结果;(1)与NC组比较,P<0.05。图3 沉默Ndfip2对肝癌细胞增殖能力的影响Fig.3 Effect of silencing Ndfip2 on HCC proliferation
2.4 沉默Ndfip2对肝癌细胞凋亡率及凋亡相关蛋白的影响
流式细胞仪(图4A、B)结果表明,与NC组比较,si-Ndfip2组细胞凋亡率上升,差异具有统计学意义(P<0.05)。Western blot(图4C、D、E、F)结果显示,与NC组比较,si-Ndfip2组中Caspase3和Bax蛋白表达量上调,而Bcl2表达下调,差异有统计学意义(P<0.05)。
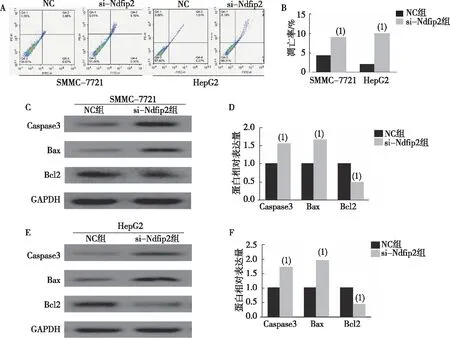
注:A为两组细胞凋亡水平结果,B为两组细胞凋亡水平定量结果,C、E为条带灰度结果,D、F为相对定量结果;(1)与NC组比较,P<0.05。图4 沉默Ndfip2对肝癌细胞凋亡率及凋亡相关蛋白的影响Fig.4 Effect of silencing Ndfip2 on the apoptosis rate and the expression levels of apoptosis-related proteins in HCC lines
2.5 沉默Ndfip2对肝癌细胞中PTEN-PI3K/Akt信号通路的影响
Western blot(图5)结果显示,与NC组比较,si-RNA组SMMC-7721和HepG2细胞中的PI3K、p-Akt(S473)和MMP1蛋白表达水平下调,而PTEN水平则升高,差异有统计学意义(P<0.05)。
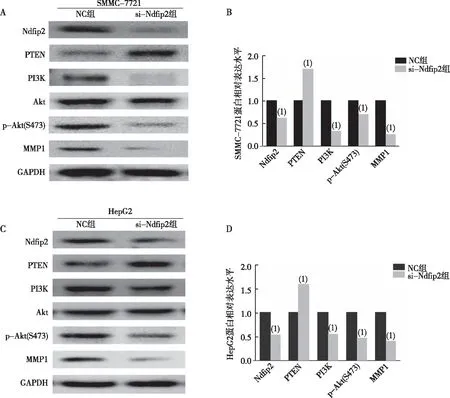
注:A、C为条带灰度结果,B、D为相对定量结果;(1)与NC组比较, P<0.05。图5 沉默Ndfip2对肝癌细胞中PTEN-PI3K/Akt信号通路的影响Fig.5 Effect of silencing Ndfip2 on PTEN-PI3K/Akt signaling pathway in HCC lines
3 讨论
肝癌是严重危害人类健康的恶性肿瘤之一,目前来说肝移植是治疗肝癌的主要方法,但是术后高复发率和转移率严重影响其治疗效果[9]。随着生物信息学等相关学科的发展,发现了很多与术后肝癌复发和转移的生物分子标记物,对此类分子标记物的研究有助发发现新的靶点,为肝癌的治疗提供新的思路与方向[10-12]。近年来,泛素化的研究受到广大研究者的关注,其中HECT型E3泛素连接酶由于其固有的酶促活性,以及能够特异性识别蛋白底物而受到广泛研究[13-14],例如HECT型E3泛素连接酶的典型代表Nedd4亚家族,研究发现该家族成员在晚期胃癌、肺癌中均发生过表达,对肿瘤的生长与发展产生了重要的影响[15-16]。Ndfip2,全称Nedd4家族相互作用蛋白2,是一种参与泛素化的多功能蛋白,因其可与Nedd4特异性结合,所以在泛素化过程中作为Nedd4蛋白家族成员的激活蛋白而存在[17]。最新研究发现NEDD4可通过下调胰腺癌细胞中PTEN的表达来抑制细胞凋亡,同样在肝癌细胞中NEDD4通过调节LATS1(Hippo通路的肿瘤抑制因子)而促进肝癌细胞的增殖,抑制肝癌细胞的凋亡[18]。实验通过CCK-8、平板克隆实验和流式细胞术等实验研究发现沉默Ndfip2可以抑制肝癌细胞的增殖能力,促进其凋亡能力,提示Ndfip2可能促进肝癌细胞的增殖,抑制肝癌细胞的凋亡。
PI3K/Akt信号通路是调节多种生物过程信号传导的重要途径,例如细胞生长、增殖和凋亡[19-20]。磷酸酶和张力蛋白同源物(PTEN)是一种肿瘤抑制因子,也是PI3K的主要拮抗剂,研究发现在多种人类肿瘤中PTEN的缺失或失活将导致PI3K /Akt信号转导过快,从而驱动肿瘤的发生,因此也被描述为癌症的动力途径之一[21-23]。Mund等[7]研究发现,Ndfip2能够通过调控PTEN而影响PI3K/Akt信号通路,最终影响细胞的增殖和凋亡活动。研究发现在肝癌细胞SMMC-7721和HepG2中,沉默Ndfip2使得PI3K、p-Akt(S473)蛋白表达显著降低,而PTEN表达水平则显著升高,提示在肝癌细胞中,沉默Ndfip2可以抑制PTEN-PI3K/Akt信号通路的活化。凋亡机制的缺失也是导致肿瘤发生的重要因素之一, Bcl2、Bax和Caspase3是关系密切的3个凋亡相关蛋白,其中抗凋亡基因Bcl2与促凋亡基因 Bax均为Bcl2家族蛋白成员,Caspase3则作为凋亡执行者而存在,参与多种因素诱导的凋亡[24-25]。流式细胞术结果发现当在肝癌细胞SMMC-7721和HepG2中中沉默Ndfip2时,Caspase3和Bax蛋白表达显著上升,而Bcl2却显著下降,提示沉默Ndfip2而导致肝癌细胞SMMC-7721和HepG2凋亡能力的提升,可能与Bcl2/Bax通路有关。
综上所述,沉默Ndfip2能够显著抑制肝癌细胞SMMC-7721和HepG2的增殖能力,促进其细胞的凋亡能力,其机制可能PTEN-PI3K/Akt的失活有关,这有助于能够更好地理解肝癌的发展和转移过程,为肝癌的临床治疗提供一定的理论基础。

