经验方糖通饮对2型糖尿病合并非酒精性脂肪肝大鼠脂质代谢的影响及机制*
陈俞如, 潘艳伶, 马欢, 伏红颖
(1.贵州医科大学 临床医学院 中医学教研室, 贵州 贵阳 550004; 2.贵州医科大学附属医院 中医科, 贵州 贵阳 550004)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种以肝细胞脂肪样变为特征的常见慢性代谢性肝病,2型糖尿病(type 2 diabetes mellitus,T2DM)是引起NAFLD的重要危险因素[1]。有研究表明,T2DM患者出现NAFLD的几率高达60%,已成为临床高发疾病,如未能对其采取及时有效的防治措施,可进展为肝硬化、肝纤维化,甚至导致肝癌发生[2-3]。目前,研究者们普遍认可胰岛素抵抗(insulin resistance,IR)是T2DM和NAFLD共同发病的基础[4],因此将改善IR作为治疗该病的切入点意义重大。本课题组前期研究已表明,经验方糖通饮(简称糖通饮)可明显改善T2DM大鼠IR并能显著降低其血脂水平[5-7],但其对T2DM合并NAFLD模型大鼠是否具有疗效及机制尚不清楚。由于IR的发生发展与JNK通路的异常活化关系密切[8],因此,本研究通过对T2DM合并NAFLD模型大鼠进行糖通饮干预,观察大鼠相关指标的变化,探讨糖通饮对T2DM合并NAFLD模型大鼠的治疗作用及可能的机制,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1实验动物 8周龄SPF级SD雄性大鼠44只,体质量(180±20)g,购自重庆腾鑫生物技术有限公司[SCXK(黔)2015-005];大鼠自由饮食饮水,饲养温度21~26 ℃,湿度40%~60%,避免噪音干扰,保持环境清洁,适应性饲养1周。
1.1.2药品及饲料 糖通饮饮片(生地12 g、黄芪15 g、山药15 g、山茱萸15 g、茯苓15 g、丹皮10 g、丹参15 g、草决明15 g、泽泻9 g及地骨皮15 g)由贵州医科大学附属医院中药房提供,高脂高糖饲料(普通饲料58%、精炼猪油20%、糖20%及胆固醇2%)由贵州医科大学动物中心提供。
1.1.3主要试剂及仪器 链脲佐菌素(streptozotocin,STZ)、血清胰岛素(serum insulin,FINS)酶联免疫(ELISA)测定试剂盒(北京索莱宝科技有限公司),非酯化脂肪酸(nonesterifiedfatty acid,NEFA)测定试剂盒、甘油三酯(triglycerides,TG)含量测定试剂盒(南京建成生物公司),苏木素染液和伊红染液(武汉赛维尔生物公司),磷酸化c-Jun氨基末端激酶-1(phosphorylated JNK amino-terminal kinase-1,p-JNK1)、c-Jun氨基末端激酶-1(c-Jun N-terminal kinase-1,JNK1)及磷酸化胰岛素受体底物-1(phosphorylated insulin receptor substrate-1,p-IRS-1)抗体(美国CST公司),胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)抗体(北京博奥森生物技术有限公司),β-肌动蛋白(β-actin)、辣根酶标记山羊抗兔二抗(HRP-labeled goat anti-rabbit IgG,上海艾比玛特生物公司);DM 4000B型倒置显微镜(德国Leica公司),DR-200Bs型酶标仪(Diatek公司)及chemidoc型凝胶成像分析系统(上海天能科技公司)。
1.2 实验方法
1.2.1造模及分组 随机取10只大鼠作正常组,给予普通饲料喂养,注射等剂量柠檬酸-柠檬酸钠缓冲液。其余34只大鼠以高脂高糖饲料喂养8周后,禁食、不禁水12 h,予含1% STZ的柠檬酸-柠檬酸钠缓冲液(pH 4.5)小剂量多次腹腔注射以建立T2DM合并NAFLD大鼠模型;首次剂量为20 mg/kg,每隔72 h检测1次空腹血糖(fasting blood glucose,FBG),FBG<16.7 mmol/L者视为未达标,在首次剂量基础上增加5 mg/kg剂量;待造模大鼠FBG>16.7 mmol/L时,则随机从正常组及造模大鼠中各抽取2只大鼠进行苏木精-伊红染色法 (hematoxylin-eosin staining,HE)染色,若光镜下观察到造模大鼠较正常组大鼠肝细胞内存在明显脂肪样变性,则表明T2DM合并NAFLD造模成功[9]。取造模成功大鼠32只,采用随机数字表法均分为模型组及糖通饮低、中、高剂量组,每组8只。
1.2.2药物制备 将糖通饮饮片置于专用器皿中注入适量双蒸水,浸泡30 min,熬制成煎剂,低剂量浓缩为含生药0.6×103g/L的药液,中剂量浓缩为含生药1.2×103g/L的药液,高剂量浓缩为含生药1.8×103g/L的药液,灌胃容积为20×10-3L/kg[10]。
1.2.3干预治疗 根据成人与大鼠体表面积等效剂量比值表折算大鼠用药剂量。糖通饮低、中、高剂量组分别按12 g/kg、24 g/kg、36 g/kg灌胃给药,正常组及模型组予等容积双蒸水灌胃,各组大鼠连续灌胃8周,1次/d。灌胃期间大鼠死亡6只,其中模型组及糖通饮低剂量组各死亡2只,糖通饮中、高剂量组各死亡1只。
1.2.4FBG、FINS检测及相关指标计算 各组大鼠连续灌胃8周后,称取体质量,禁食、不禁水12 h,尾静脉针刺采血约50 μL,使用血糖仪检测FBG;按300 mg/kg予10%水合氯醛腹腔注射麻醉大鼠后,于腹主动脉取血8 mL,以3 000 r/min离心10 min,取上清液,按试剂盒方法进行测定备测FINS、游离脂肪酸(free fatty acid,FFA),并根据公式计算胰岛素抵抗指数(insulin resistance index,HOMA-IR)及胰岛素敏感指数(insulin sensitivity index,ISI)。具体公式如下:HOMA-IR=FBG×FINS/22.5;ISI=1/(FBG×FINS)[11]。
1.2.5肝脏指数计算 各组大鼠在1.2.4项下取血后迅速摘取肝组织,予生理盐水洗净,称取大鼠肝脏湿质量,计算肝脏指数(肝脏指数=肝脏湿质量/体质量×100%)。
1.2.6HE染色法检测肝组织形态学特征 取1.2.5项下各组大鼠部分肝组织,4%多聚甲醛溶液固定,常规脱水、包埋、切片;切片于65 ℃烘箱烤40 min,二甲苯脱蜡,脱水,清洗;苏木素染液染色5 min、清洗;分化液分化4 s,伊红染色5 min,清洗、脱水、透明、封片,显微镜下观察并进行图像采集及分析。
1.2.7肝组织TG含量检测 取1.2.5项下各组大鼠部分肝组织,置于-80 ℃冰箱冻存,加无水乙醇匀浆0.9 mL,按试剂盒方法进行检测肝组织TG含量。
1.2.8Western blot法检测肝组织p-JNK1/JNK1、p-IRS-1/IRS-1蛋白的表达 取1.2.7项下各组大鼠部分肝组织,根据目的蛋白分子量大小分别制作8%和12%十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAG)凝胶,注入适量电泳缓冲液,置于4 ℃冰箱备用;取肝组织0.1 g,加裂解液1 mL,置于自动匀浆机中匀浆,静置冰上20 min裂解,4 ℃下1 200 r/min离心20 min,取上清液;制备好的蛋白样品采用聚氰基丙烯酸正丁酯(bicinchonininc acid,BCA)法进行浓度测定,根据浓度加适量loading buffer置于沸水10~15 min;依次进行SDS-PAG凝胶电泳(300 mA转膜 1.5~2 h),将蛋白条带转移到PVDF膜上,将膜置于5%脱脂牛奶室温封闭1 h,予TBST缓冲液洗膜后,再分别将膜置于加p-JNK1、JNK1、p-IRS-1及IRS-1抗体(1 ∶1 000)的孵育盒中、4 ℃摇床孵育过夜,次日予TBST缓冲液洗膜,加入二抗(1 ∶1 000)室温孵育1 h;将增强型化学发光试剂(enhanced chemiluminescence,ECL)中鲁米诺和过氧化氢按1 ∶1充分混匀,再将上述PVDF膜充分浸润于以上配置好的混合液中,最后置于凝胶成像分析系统中进行观察。
1.3 统计学分析
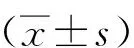
2 结果
2.1 造模情况
正常大鼠肝细胞形态完整、排列整齐、结构清晰,造模大鼠肝细胞内存在大小不等的脂肪空泡(图1),FBG>16.7 mmol/L,且FBG[(20.6±1.30)mmol/L]高于正常大鼠[(7.6±2.20)mmol/L],差异有统计学意义(t=538.752,P=0.001),提示T2DM合并NAFLD大鼠模型复制成功。见图1。

注:黑色箭头所示为脂滴空泡。图1 正常大鼠和造模大鼠的肝组织染色(HE,×400)Fig.1 Staining of liver tissues in normal and model groups(HE,×400)
2.2 HOMA-IR和ISI水平
与正常组相比,模型组大鼠HOMA-IR升高、ISI降低,差异均有统计学意义(P<0.05);与模型组相比,糖通饮各剂量组HOMA-IR降低、ISI增高,差异均有统计学意义(P<0.05);糖通饮各剂量组间HOMA-IR、ISI比较,差异均无统计学意义(P<0.05)。见表1。

表1 各组大鼠HOMA-IR和ISI水平Tab.1 Levels of HOMA-IR and ISI in each group
2.3 血清FFA和TG水平
与正常组相比,模型组大鼠血清FFA、肝组织TG水平均升高,差异均有统计学意义(P<0.05);与模型组相比,糖通饮各剂量组大鼠血清FFA、肝组织TG水平均降低,差异均有统计学意义(P<0.05);糖通饮各剂量组间血清FFA、肝组织TG水比较,差异均无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清FFA和肝组织TG水平Tab.2 Levels of serum FFA and liver TG in each group
2.4 肝脏指数
与正常组相比,模型组大鼠肝脏指数增加,差异均有统计学意义(P<0.05);与模型组相比,糖通饮各剂量组大鼠肝脏指数均降低,差异均有统计学意义(P<0.05);糖通饮高剂量组大鼠肝脏指数分别较低、中剂量组下降,差异均有统计学意义(P<0.05)。见表3。
表3 各组大鼠的肝脏指数Tab.3 Liver index of rats in each
2.5 肝脏组织学特征
正常组大鼠肝细胞形态正常,排列整齐,细胞核清晰可见;与正常组相比,模型组大鼠肝细胞排列不齐,存在明显水肿、变性,细胞核脂滴空泡挤压;与模型组相比,糖通饮各剂量组大鼠肝细胞内脂滴数量减少,其中以高剂量组改善效果最佳。见图2。
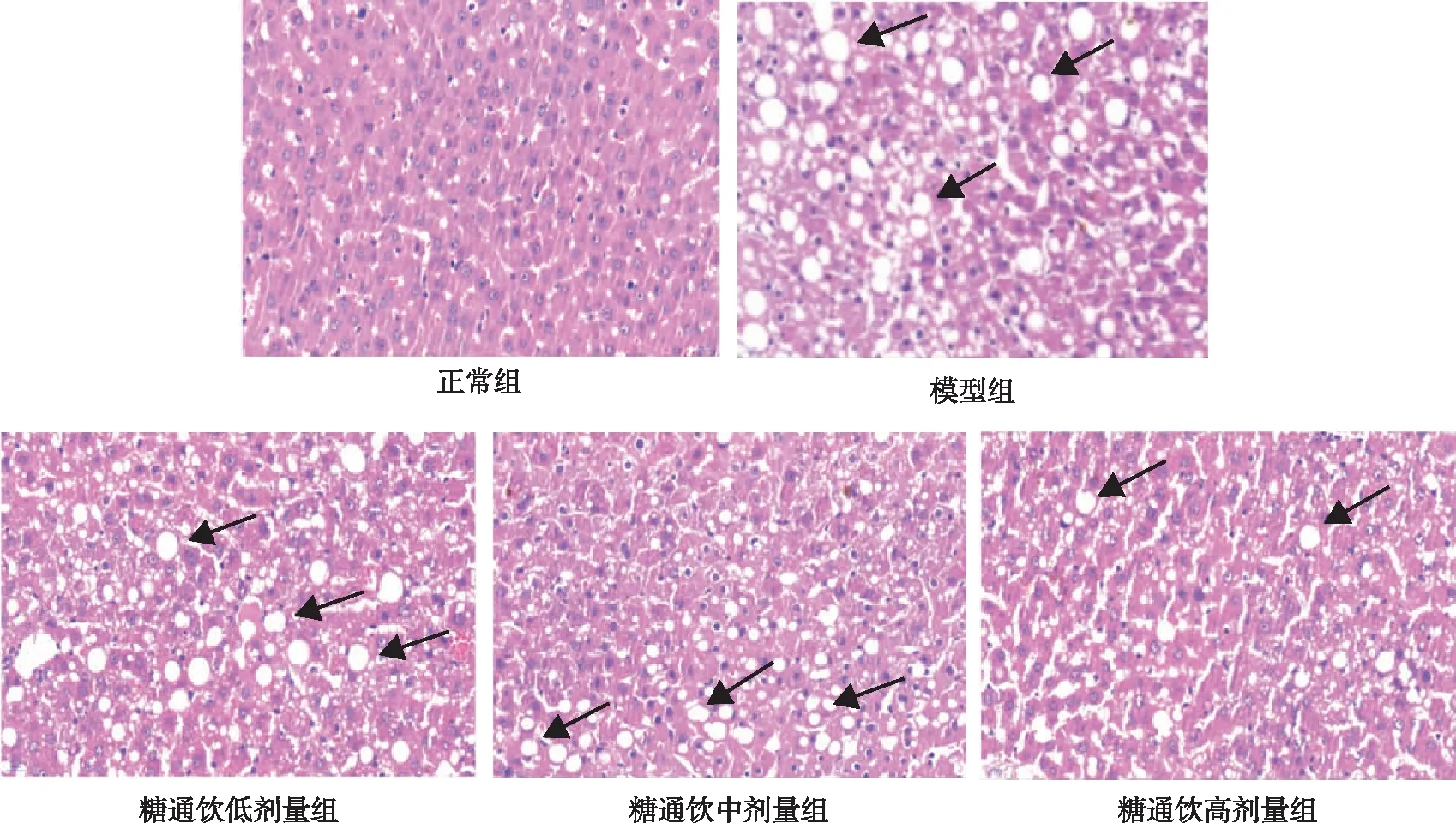
注:黑色箭头所示为脂滴空泡。图2 各组大鼠肝组织的染色结果(HE,×400)Fig.2 Staining of liver tissues in each group(HE,×400)
2.6 肝组织p-JNK1/JNK1和p-IRS-1/IRS-1蛋白的表达
与正常组相比,模型组大鼠肝组织p-JNK1/JNK1和p-IRS-1/IRS-1蛋白表达水平均增高,差异均有统计学意义(P<0.05);与模型组相比,糖通饮各剂量组大鼠肝组织p-JNK1/JNK1和p-IRS-1/IRS-1蛋白表达水平均下降,差异均有统计学意义(P<0.05);糖通饮各剂量组大鼠肝组织p-JNK1/JNK1和p-IRS-1/IRS-1蛋白表达比较,差异无统计学意义(P>0.05)。见图3。
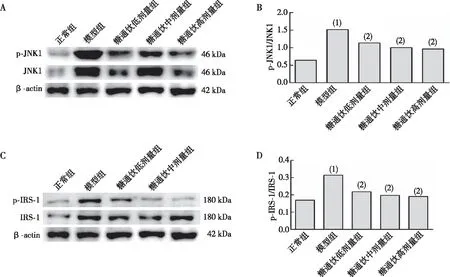
注:A为p-JNK1、JNK1蛋白的Western blot检测结果,B为p-JNK1/JNK1蛋白定量结果,C为p-IRS-1、IRS-1蛋白的Western blot检测结果,D为p-IRS-1/IRS-1蛋白定量结果;(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。图3 各组大鼠肝组织 p-JNK1/JNK1和p-IRS-1/IRS-1蛋白的表达Fig.3 Protein expression levels of p-JNK1/JNK1 and p-IRS-1/IRS-1 in rat liver tissues of each group
3 讨论
IRS-1是细胞内胰岛素反应的重要配体,胰岛素受体底物可通过与胰岛素受体键合,从而使胰岛素发挥正常生理作用[12]。JNK是丝裂原活化蛋白激酶家族重要成员之一,该通路通常可被FFA等因素特异性活化,被激活的JNK可通过与IRS-1结合,促使IRS-1丝氨酸位点发生磷酸化,从而阻止IRS-1与胰岛素受体结合,进而影响胰岛素下游信号通路正常表达,妨碍胰岛素发挥其正常生理功能,最终诱导IR的发生[8,13]。当IR发生时,胰岛素对脂肪代谢的调节作用减弱,脂肪分解能力增强,FFA在血液中大量产生,经门静脉途径进入肝脏,在肝内合成TG,并异常积聚于肝细胞内,致使肝细胞出现肿胀、变性形成脂肪样变[14]。目前,西医治疗T2DM合并NAFLD主要以增加胰岛素敏感性及调脂为主,该类药物可一定程度地延缓该病病情进展,但存在一定的毒副作用[15];中医药在防治T2DM合并NAFLD的过程中收效显著,且具备毒副作用小、治疗成本低的优势。有研究表明,六味地黄丸、降脂汤、祛湿化瘀方等能明显改善大鼠IR,减轻肝细胞脂肪变性,对肝组织具有一定的保护作用[16-18]。
祖国医学虽未明确记载T2DM合并NAFLD病名,但根据临床表现,可归属于“消渴”、“肥气”、“肝着”等范畴。目前,众医家大多认可T2DM合并NAFLD为“本虚标实”[19-20],“本虚”以气阴两虚为主,“标实”多为痰浊、瘀血阻滞。肾为人的先天之本,肾阴亏损致使水不涵木,肝阴不足,则气郁化火煎灼津液,酿为痰浊,阻滞气机,致使血液运行不畅形成瘀血,痰浊、瘀血积聚肝络,最终导致T2DM合并NAFLD的发生。中药方剂糖通饮是凌湘力教授在传统方剂六味地黄丸的基础上,结合多年临床经验加以化裁而成,该方以具有清热凉血、养阴生津之效的生地黄作为君药,辅以臣药黄芪、山茱萸、山药益气养阴以治本,泽泻、茯苓、丹皮、丹参、草决明及地骨皮共为佐使药,祛瘀泄浊以治其标,诸药合用,共奏益气养阴、祛瘀泄浊之功[5-7]。现代药理研究表明,黄芪多糖可通过改善胰岛素抵抗及脂质代谢异常,来减缓单纯的非酒精性脂肪肝向非酒精性脂肪肝炎进展[21];山药多糖能显著降低糖尿病大鼠血糖水平,提高其糖耐量、糖原和c肽含量,并可改善高脂大鼠血清TC、TG、LDL-C含量[22];地骨皮可显著改善T2DM大鼠IR及脂代谢异常,并可缓解肝细胞脂肪变性[23];泽泻提取物能有效减少高脂血症小鼠肝组织中脂类物质的过量沉积,且具有降低血脂水平及保护胰岛细胞的作用[24];丹参可通过降低血清中IL-6、IL-17、TNF-α水平,抑制RORγt基因表达,从而减轻NAFLD大鼠肝脏脂质沉积及炎症损伤[25]。
本研究结果显示,糖通饮可显著降低T2DM合并NAFLD模型大鼠HOMA-IR及肝脏指数,增高ISI,减少血清FFA及肝组织TG含量,并减轻肝细胞脂质沉积及脂肪变性程度,提示糖通饮对T2DM合并NAFLD模型大鼠存在的IR、肝细胞脂肪样变、肝内脂质过量堆积的情况具有改善作用。本研究还表明,糖通饮可下调T2DM合并NAFLD模型大鼠肝组织中p-JNK1/JNK1、p-IRS-1/IRS-1蛋白的表达水平,揭示糖通饮对T2DM合并NAFLD模型大鼠的治疗作用可能与良性调控肝组织中JNK信号通路相关蛋白表达有关。以上结果为临床应用糖通饮治疗T2DM合并NAFLD提供了一定的理论依据。

