小鼠脊髓源原代星形胶质细胞与小胶质细胞的同步培养及鉴定*
吴雪, 黄彩云, 袁佳钰, 付雅芬, 马佳雪, 杨洁, 张前,**
(1.陕西中医药大学 药学院, 陕西 咸阳 712000; 2.陕西师范大学 生命科学学院, 陕西 西安 710000)
胶质细胞约占哺乳动物中枢神经系统细胞总量的90%,在维持中枢神经系统内环境稳态方面具有不可替代的作用。胶质细胞主要包括大胶质细胞(星形胶质细胞、少突胶质细胞)和小胶质细胞,其中小胶质细胞与星形胶质细胞在调节中枢神经炎症反应过程中尤为关键,二者在炎症损伤机制中所扮演的角色正成为中枢神经系统疾病研究领域的热点。目前文献中获取这两种细胞的组织材料主要来源于动物大脑[1-4],以昆明胎鼠脊髓作为组织材料的文献未见报道。胶质细胞培养周期长,一般需要9~14 d才能达到较高的汇合度。现有报道中,获得高纯度的星形胶质细胞和小胶质细胞的方法各异,效率不一,步骤较复杂。本研究采用孕晚期昆明胎鼠的脊髓作为组织来源,采用机械吹打结合自然沉降获得混合胶质细胞、摇床振摇结合传代进行分离纯化,可以在较短的时间内(6~9 d)获得高纯度的星形胶质细胞和小胶质细胞,操作简便、重复性好,为后期研究与星形胶质细胞、小胶质细胞相关的脊髓源疾病提供了良好的实验材料,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1动物 昆明小鼠(孕晚期)购自西安交通大学实验动物中心。
1.1.2主要试剂 高糖伯克改良伊格尔培养基(dulbecco's modified eagle medium, DMEM)、0.25% 胰蛋白酶[含0.038% 乙二胺四乙酸(EDTA)]、青霉素(100 000 U/L)、杜式磷酸盐缓冲液(dulbecco's phosphate buffered saline,DPBS)、Dylight 488二抗、4%多聚甲醛溶液均购自博士德公司(中国,武汉),多聚赖氨酸(Poly-L-lysine, PLL)购自Sigma公司(美国,圣路易斯),Triton X-10购自Amresco公司(美国,华盛顿),二脒基苯基吲哚(DAPI)购自巴傲得公司(中国,南京)。
1.1.3主要仪器 光学显微镜、倒置荧光显微镜、解剖显微镜均购自徕卡公司(德国,维茨拉尔),CO2培养箱购自默赛飞世尔科技有限公司(中国,上海),水浴恒温摇床购自一恒科学仪器有限公司(中国,上海)。
1.2 实验方法
1.2.1混合胶质细胞培养 孕晚期昆明小鼠麻醉后脱颈处死,浸泡于75%酒精内消毒10 min,剖腹剥离胎盘与羊膜,取出胎鼠。解剖显微镜下分离胎鼠脊髓步骤如下:以背部正中位置的红色血管为标记,沿下方5 mm处划破椎管,暴露脊髓;固定小鼠两侧臀部,从尾部挑出脊髓末端,分离背根神经与脊髓的粘连,快速剥离脊髓(尽量维持组织完整)。移至预冷的DPBS中,剥去表面血管与脊膜并漂洗1~2次。取材步骤见图1,操作均在医用冰盒上进行。将脊髓组织剪碎至黏稠糊状,加入0.25%含EDTA的胰蛋白酶,混匀,消化15~20 min,加入1.5~2倍体积的完全培养基(DMEM高糖培养基+10%胎牛血清+1%青霉素+1%链霉素)终止消化,移入离心管,轻柔吹打制成细胞悬液,静置5 min,待组织碎片自然沉降,收集上层2/3液体。剩余组织团块中再添加适量完全培养基,轻柔混匀后静置5 min,收集上层2/3液体。合并2次细胞悬液,1 000 r/min离心3 min,弃上清液。细胞沉淀中加入适量完全培养基重悬,接种于培养瓶中(25 mg/L PLL提前包被30 min),置于37 ℃、5% CO2培养箱中培养,2 d全量换液1次。
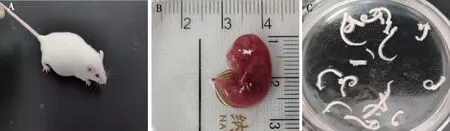
注:A为昆明孕鼠,B为胎鼠,C漂洗干净的脊髓。图1 胎鼠脊髓取材Fig.1 The procedure of collecting spinal cords of fetal mice
1.2.2星形胶质细胞与小胶质细胞分离纯化 细胞培养4~5 d后,汇合度约为90%~95%,此时的细胞为混合胶质细胞;将混合胶质细胞置于37 ℃、300 r/min轨道摇床中,振摇4~6 h后收集瓶内培养基。由于小胶质细胞贴壁不牢固,收集的培养基中绝大多数为振摇下来的小胶质细胞,1 000 r/min离心3 min,弃去上清,加入完全培养基重悬均匀,接种于另一培养瓶内进行培养,该瓶细胞即为原代(P0)小胶质细胞。原培养瓶中未被振摇下来的细胞即为P0星形胶质细胞,由于星形胶质细胞的数量远远多于小胶质细胞,振摇后瓶底细胞的汇合度也已达到75%~85%;对P0星形胶质细胞进行一次传代,先用PBS清洗1~2次,添加胰蛋白酶2 mL,恒温消化3 min;细胞形态出现回缩变圆、呈片状脱落时,立即加入完全培养基终止消化;细胞悬液移至离心管1 000 r/min离心3 min,弃去上清液;细胞沉淀中加入4 mL完全培养基制成细胞混悬液,按1 ∶2传代,传代后的细胞即为P1星形胶质细胞。
1.2.3星形胶质细胞和小胶质细胞鉴定 光学显微镜下观察细胞形态,利用细胞荧光染色法鉴定P1星形胶质细胞纯度或P0小胶质细胞纯度,步骤如下:将细胞接种于玻璃爬片,汇合达到60%左右时,4%多聚甲醛室温固定15 min,再加0.1%的TritonX-100室温孵育10 min进行细胞穿透;10%山羊血清室温封闭1 h,兔多抗克隆GFAP抗体(1 ∶200,鉴定星形胶质细胞)或兔多抗克隆CD11b抗体(1 ∶200,鉴定小胶质细胞);4 ℃孵育过夜;Dylight 488羊抗兔二抗(1 ∶200)室温避光孵育1 h,DAPI室温避光染核5 min;甘油封片后,于倒置荧光显微镜下观察拍照。
2 结果
2.1 细胞形态观察
2.1.1星形胶质细胞 经恒温摇床(300 r/min,4~6 h)纯化、尚未传代的星形胶质细胞为P0星形胶质细胞,其胞体延伸出的突起短而粗大,呈单层扁平星状,细胞核大,呈卵圆形或圆形,核仁不明显。传代后,P1星形胶质细胞的胞体逐渐变大,生长速度加快,12 h后汇合度即可达到60%,1~2 d细胞即可铺满瓶底。随着传代次数的增加,细胞的生长速度不断增加,但从第5代开始细胞活力逐渐下降。因此,在实验中应选择4代内的星形胶质细胞。见图2。
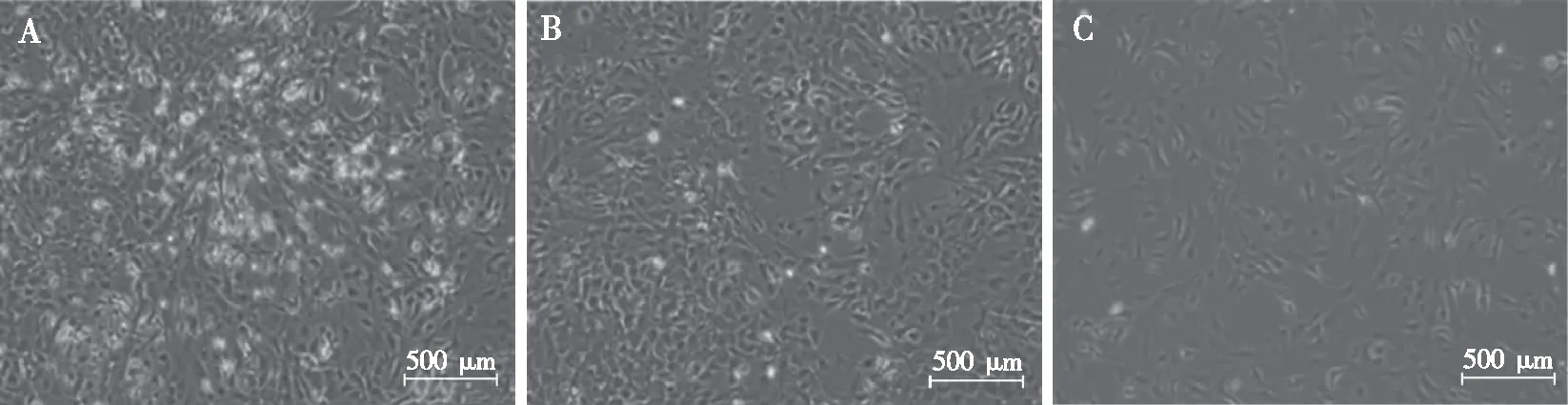
注:A为未经纯化的混合胶质细胞,B为P0星形胶质细胞,C为接种12 h后的P1星形胶质细胞。图2 纯化过程中星形胶质细胞的形态变化(10×)Fig.2 The morphological changes of astrocytes in different cell passages during purification process(10×)
2.1.2P0小胶质细胞 P0小胶质细胞是混合胶质细胞经振摇后从上清液中收集得到的,其数量远远少于星形胶质细胞,生长速度也较慢。接种第3天,镜下可见小胶质细胞形态多为圆形、杆状、阿米巴状(均为激活态)或细长分支状(静息态)。接种第8天,其突触延长,汇合度到达60%~70%。约在10~12 d,细胞呈多分枝状,细胞间相互交织,汇合度达到90%。见图3。

注:A为接种后第3天,B为接种后第8天,C为接种第12天。图3 纯化后的P0小胶质细胞形态变化(10×)Fig.3 The morphological changes of P0 microglia at different time points after purification(10×)
2.2 细胞纯度鉴定
2.2.1星形胶质细胞 经过轨道摇床和传代后,采用免疫荧光法对P1星形胶质细胞进行鉴定。如图4所示,绿色荧光为阳性细胞,蓝色荧光为细胞核。结果表明星形胶质细胞的阳性率可达97%以上。
2.2.2P0小胶质细胞 经过轨道摇床纯化后,采用免疫荧光法对P0小胶质细胞进行鉴定。如图4所示,绿色荧光为阳性细胞,蓝色荧光为细胞核。结果显示纯化后的小胶质细胞的阳性率可达97% 以上。
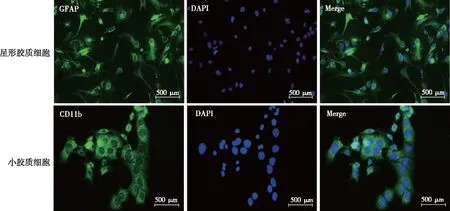
图4 免疫荧光法鉴定星形胶质细胞和小胶质细胞纯度(20×)Fig.4 The purity of astrocytes and microglias were identified by immunofluorescent staining(20×)
3 讨论
星形胶质细胞与小胶质细胞是中枢神经系统中重要的胶质细胞,协同维持中枢神经系统的稳定。近年来,它们被广泛作为中枢神经系统疾病如帕金森(parkinson,s disease, PD)、肌萎缩侧索硬化症(amyotrophic lateral sclerosis, AST)、阿尔茨海默症(alzheimer disease, AD)等的体外研究对象[5]。因此,快速、便捷获得高纯度的星形胶质细胞与小胶质细胞是研究中枢神经系统相关疾病的重要前提。
目前,大部分文献以大脑皮质作为提取原代胶质细胞的组织来源[1, 6-9],采用脊髓进行胶质细胞培养的文献报道较少,而以昆明胎鼠作为组织来源更是未见报道。本研究从昆明胎鼠(孕晚期)的脊髓组织中提取混合胶质细胞,并在较短的时间内同时获得数量多、纯度高的星形胶质细胞与小胶质细胞。考虑到孕晚期昆明胎鼠的神经系统内神经元已经基本发育完全,而胶质细胞正处于旺盛增殖阶段。此时取材有利于得到的状态好、污染少的胶质细胞。
混合胶质细胞若未经分离、纯化,通常掺杂神经元和成纤维细胞。神经元适合于无血清培养,而本研究采用的是含血清的胶质细胞培养基,神经元中会逐渐自然死亡。成纤维细胞与胶质细胞的培养条件相似,两者会长期共存,因此需要人为将其除去。现有研究多采用差速贴壁法以去除成纤维细胞[9-10],然而在实际操作中,需要精准控制成纤维细胞贴壁的时间。时间过长则部分胶质细胞也会随之贴壁,致使目的细胞流失;时间过短则不能有效剔除成纤维细胞,最终导致实验失败。由于成纤维细胞来源于脊膜等粘膜结缔组织,可以从源头减少其来源。因此在我们的实验中,通过反复摸索,调整剥离脊髓组织的方法可有效减少了成纤维细胞的来源。
在星形胶质细胞的培养方面,文献报道未纯化的星形胶质细胞需要9~14 d才能达到90%的汇合度[11-14],细胞生长缓慢,不利于后续实验的开展。在本研究中,采用胰酶消化法与机械吹打提取混合胶质细胞,采用恒温定轨摇床结合传代进行除杂,无需滤网,手法简单,操作容易,细胞流失少,污染风险小。能在6~8 d获得数量多、纯度高的目的细胞,显著提高了工作效率。
在小胶质细胞的培养方面,文献报道的分离纯化方法主要有:(1)胰酶消化法。即采用0.062 5%的胰酶作用于混合胶质细胞,边消化边摇晃,减少小胶质细胞对底部胶质细胞黏附性[15]。此方法确实可去除部分杂细胞,但黏附在瓶底的星形胶质细胞需再次经历胰酶消化、吹打后进行传代,增加了对细胞的二次损伤;(2)十字手摇法[12],即按“十”字轨道摇动培养瓶获得小胶质细胞;但实际操作中,操作人员不同,力度无法统一;力度太小,目的细胞无法脱落,力度过大,容易形成气泡,破碎的气泡张力又会影响细胞活力;(3)拍打法[16],即通过拍打培养瓶底,促使小胶质细胞脱落,此方法与十字手摇法一样,难以统一拍打力度。在本研究采用的恒温摇床振荡法(300 r/min,37℃,4~6 h),条件稳定,获得的小胶质细胞纯度高,10~12 d即可达到90%以上的汇合度。
此外,本文建立的方法简便易行,但操作时应注意以下几方面:(1)消化时间要适宜,时间过短获得的细胞数量少,时间过长容易致细胞破碎死亡[17];脊髓组织消化时间应控制在15~20 min,星形胶质细胞与小胶质细胞传代的消化时间控制在3~5 min与1~2 min比较适宜;(2)细胞接种密度要适宜,胶质细胞偏好聚集生长,细胞间彼此接触、相互影响,促进成熟和增殖[18],密度过低不利于形成细胞群落,一般11~15条完整的脊髓或者接种密度大于1×108个/L能满足要求;(3)吹打细胞要轻柔,P0代胶质细胞非常敏感,吹打力度尽量轻柔,次数控制在10~15次;另外,吹打时吸管应贴壁置于离心管底部,力度均匀,可减少气泡产生,防止气泡破碎产生的张力影响细胞活性;(4)PLL包被条件要适宜,预先用PLL包被培养瓶可以促进胶质细胞贴壁,加快其生长速度[19];浓度过高会有游离的PLL对细胞产生毒害,浓度过低则起不到帮助贴壁的作用。通过摸索,本研究确定25 mg/L PLL处理T25培养瓶30 min效果最佳。接种15~20 min,即可见90%的细胞贴壁。不管是原代混合胶质细胞,还是分离纯化后的星形胶质细胞与小胶质细胞,生长速度均提高。
综上,本方法可同时获得数量多、纯度高的星形胶质细胞与小胶质细胞,可降低实验成本,显著提高实验效率,非常适合于胶质细胞的相关研究。期望本研究所提供的原代脊髓源星形胶质细胞与小胶质细胞分离纯化方法,能为相关的中枢神经系统疾病研究提供支持。

