不同体位气腹对家兔颅内压及脑水肿的影响*
龚天兰, 肖子文, 薛爱存, 邱芳, 魏洪
(1.贵州医科大学附属医院 妇科, 贵州 贵阳 550004; 2.贵州省骨科医院 妇产科, 贵州 贵阳 550002; 3.贵州省人民医院 妇科, 贵州 贵阳 550002; 4.贵州医科大学 微生物学教研室, 贵州 贵阳 550004)
腹腔镜属于微创技术,是把摄像、光源等技术应用于手术中,在提高手术成功率的同时减少创伤。腹腔镜已经被广泛应用于妇科疾病的治疗,对妇科肿瘤、子宫内膜异位及炎症包块等疾病的治疗取得了较好的效果[1]。但是随着腹腔镜的应用,有学者发现体位对术后患者康复具有重要影响[2]。有研究表明,肥胖患者在进行妇科腹腔镜手术时需要调整体位,保持长时间头低脚高30°进行盆腔淋巴结清扫及对特殊部位病灶的处理[3]。目前,大部分麻醉医师及临床医师均提及不同体位的妇科腹腔镜对心肺功能存在影响,但临床有些症状不能单纯用心肺功能受影响来解释,比如患者术后出现颜面部水肿、球结膜水肿、术后头昏、头疼、视物模糊等症状,产生原因可能与腹腔镜体位改变导致脑血流灌注、脑血氧代谢及脑水肿有关[4]。妇科腹腔镜体位的选择尚无统一的标准,本研究以雌性新西兰兔为研究对象,模拟腹腔镜气腹条件下手术体位改变是否引起颅内压力增加及增加脑水肿的发生,为临床腹腔镜的术中监测、预防脑水肿提供依据。
1 材料与方法
1.1 材料
1.1.1实验动物 普通级雌性新西兰兔36只,购自上海市松江区松联实验动物场[许可证号SCXK(沪)2019-0002)]。
1.1.2主要试剂及仪器 腹腔镜气腹装置EoneLQF220购自中国南京利昂医疗设备制造有限公司,-80 ℃超低温冰箱购自日本三洋公司,L型玻璃脑压管(康之达)购自江苏苏中医疗器械有限公司,苏木素伊红(hematoxylin and eosin staining kit, HE)染色试剂盒购自南京生航生物技术有限公司, OTC包埋胶购自SAKURA,丙泊酚、拜特速眠新购自长沙拜特生物科技研究所有限公司。
1.2 研究方法
1.2.1实验分组 雌性普通新西兰白兔36只,随机分为3组,分别为A组、B组和C组,每组12只,3组家兔均为6月龄,体质量A组(2.5±0.3) kg,B组(2.6±0.3) kg ,C组(2.5±0.3)kg,3组家兔体质量比较差异无统计学意义(P>0.05)。A组取平卧位(对照组),B组取头低位20 °,C组取头低位30 °。再根据每组在形成人工气腹后的不同时间点(2、3 及4 h)检测颅脑压力,检测后麻醉处死动物,取脑组织,称取湿重、干重计算脑组织含水量。采用HE染色观察脑组织病理,电镜观察脑组织水肿情况。
1.2.2家兔CO2气腹模型的建立 家兔平卧位固定后,由经验丰富的麻醉医师进行全身麻醉。麻醉前禁食6 h,建立耳缘静脉给药通道,注射时观察反应,当发现其头部下垂时即停止注射;当家兔尾部自然放松、睫毛反射消失后,将动物固定到自制的动物手术台中,按照4 mL/(kg·h)剂量输入生理盐水,减少非显性失水,在颈部正中间做一小口,暴露气管,插入ID 3.0气管导管,连接动物麻醉机,呼吸参数潮气量10 mL/kg、呼吸频率30~36次/min、呼气末二氧化碳分压35~45 mmHg;6~8 mg/(kg·h)剂量持续微量泵入丙泊酚维持麻醉,稳定生命体征。麻醉成功及脐部备皮后,于脐旁切0.5 cm切开,插入气腹针,进入腹腔有突破感,并行注水实验成功后旋转穿刺针套管使其恢复非穿刺状态,再将气腹针往里送3 cm即可。气腹参数为10 mmHg CO2气腹压力。
1.2.3颅内压力测定 头部前屈曲位,颈背部剃毛,22号静脉穿刺针于背部环椎上缘正中进针,针尖稍向头部倾斜,通过枕骨大孔缓慢刺入小脑延髓池、刺入时有落空感,进针深度约1.5 cm。固定后,针头连接于垂直固定的L型玻璃脑压管上,通过测压管上的刻度,在形成稳定气腹后2 、3 及4 h直接读出脑脊液压力值。
1.2.4脑组织含水量测定 各组家兔测定颅内压后,脑组织含水量、脑组织干湿重观察都要处死动物,2、3、4 h每时间点处死3只。在大脑右半球顶叶取一块20 mm×15 mm×15 mm完整脑组织,滤纸吸去表面液体后,放入称量瓶中湿重,后置于特殊处理的烧杯,取标本全过程在5 min内完成,放入电干燥箱105 ℃烘烤24 h至恒重;按照ELLiot公式计算含水量,含水量=[(湿重-干重)/湿重]×100%。
1.2.5脑组织学改变 对应的各个时点处死家兔后,取脑半球前1/3处最大冠状截面2 mm×2 mm×2 mm脑组织石蜡包埋、厚5 μm切片、脱蜡10 min、95%乙醇水化、碱性苏木精染色15 min、PBS冲洗3次、蒸馏水清洗,再利用伊红染色3 min、脱水等,光镜显微镜观察各组家兔脑组织学改变。
1.3 统计学分析
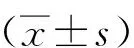
2 结果
2.1 颅内压力
对不同体位的三组家兔在2 、3 及4 h时的颅内压力进行重复测量分析结果显示,3组家兔的颅内压力随3个时点的时间变化呈上升趋势(F=17.947,P=0.001),3组比较,差异有统计学意义(F=39.515,P<0.001);3个不同时点的颅内压力比较,差异有统计学意义(F=595.481,P<0.001)。见图1。两两比较发现,在2 h和3 h时,颅内压C组>B组>A组,差异有统计学意义(P<0.05);在4 h时,B组和C组高于A组,差异有统计学意义。见表1。
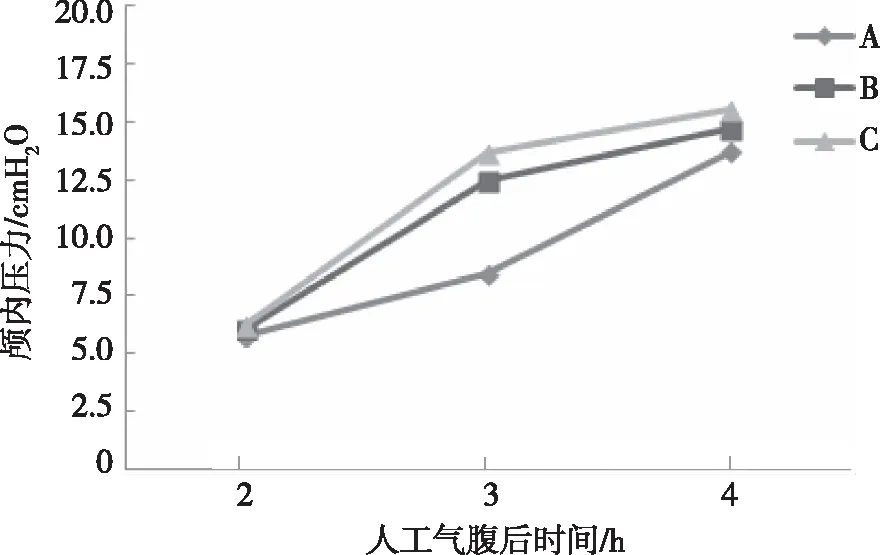
图1 3组家兔人工气腹后不同时间点的颅内压力Fig.1 Graph of intracranial pressure change trend of the three groups at different time points
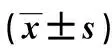
表1 3组家兔人工气腹后不同时间点的颅内压Tab.1 Comparison of intracranial pressure in the three groups at different time
2.2 脑组织含水量
2.2.1脑组织干重 对不同体位的3组家兔在2、3及4 h的脑组织干重进行测量,结果显示,3组家兔脑组织的干重随3个时点的推移变化趋势差异无统计学意义(F=0.735,P=0.580);对3组实验动物脑组织干重比较,差异无统计学意义(F=1.763,P=0.226);3个不同时点(2、3、4 h)的家兔脑组织干重比较,差异有统计学意义(F=21.255,P<0.001),B组和C组在4 h时低于2 h,差异有统计学意义。见图2、表2。

图2 3组家兔人工气腹后不同时点的脑组织干重Fig.2 The change trend of brain tissue dry weight in the three groups at different time points
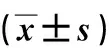
表2 三组实验动物的脑组织干重比较Tab.2 Comparison of dry weight of brain tissues in three
2.2.2脑组织湿重 对不同体位的3组家兔在2、3及4 h的湿重测量,结果显示,3组家兔脑组织的湿重的变化趋势比较差异无统计学意义(F=0.099,P=0.418);3组家兔脑组织湿重进行比较,差异无统计学意义(F=0.166,P=0.849);3个不同时点脑组织湿重进行比较,差异无统计学意义(F=3.883,P=0.053)。见图3、表3。
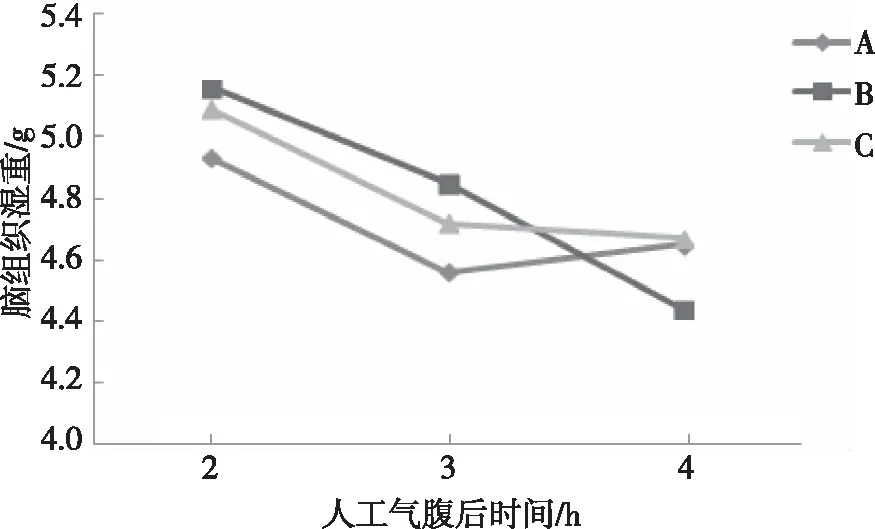
图3 3组家兔不同时点的脑组织湿重变化Fig.3 The change trend of brain tissue wet weight in the three groups at different time points
表3 3组家兔不同时点脑组织湿重比较Tab.3 Comparison of wet weight of brain
2.2.3脑组织含水量 对不同体位的3组家兔在2、3及4 h的脑组织含水量进行测量结果显示,3组家兔脑组织的含水量随时间延长呈上升趋势(F=11.147,P=0.001);3组家兔脑含水量比较,差异有统计学意义(F=135.34,P<0.001);3个不同时点家兔的脑组织含水量进行比较,差异有统计学意义(F=818.066,P<0.001;见图4。两两比较发现,在2、3及4 h时,脑组织含水量C组>B组>A组,差异有统计学意义(P<0.05)。见表4。
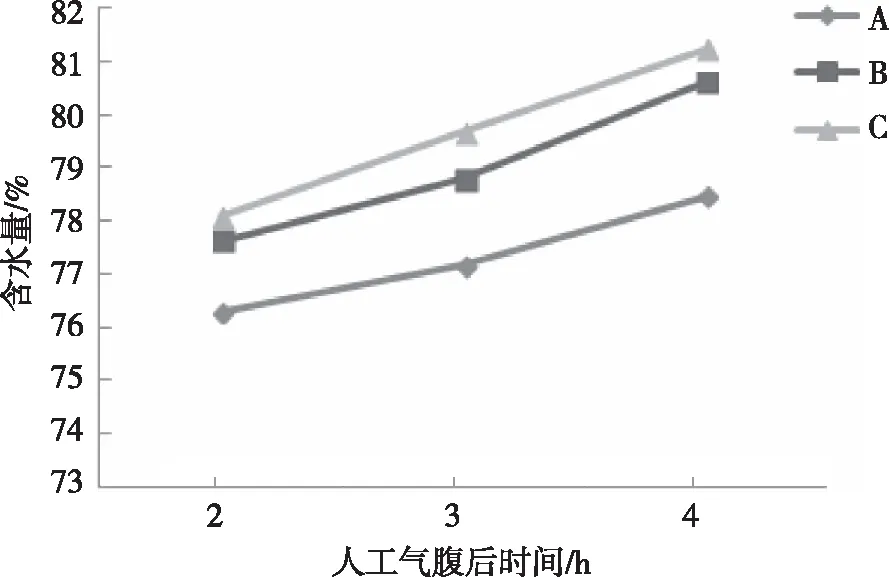
图4 3组家兔不同时点的脑组织含水量变化Fig.4 The variation trend of water content in brain tissues of the three groups at different time points
表4 3组家兔不同时点的脑组织含水量比较Tab.4 Comparison of water content in brain tissues of three groups at different time
2.3 脑组织形态学观察
在形成稳定气腹后不同时间点对3组实验动物即刻处死,取脑组织行HE染色切片检查。结果显示,气腹2 h,3组家兔的脑组织改变不明显,未见明显脑组织结构紊乱;气腹3 h,3组家兔脑组织有轻度的灶性水肿区,表现为细胞周围间隙增大,神经元、胶质细胞周围空隙增宽;气腹4 h,3组家兔脑组织均有灶性水肿区,脑组织结构紊乱,纤维样结构不连续、断裂及空泡化较明显,脑组织细胞出现肿胀,细胞膜和细胞核不清,见图4。相同时间点3 组间比较无明显差异。脑水肿3 h开始出现出现,4 h水肿表现较明显。
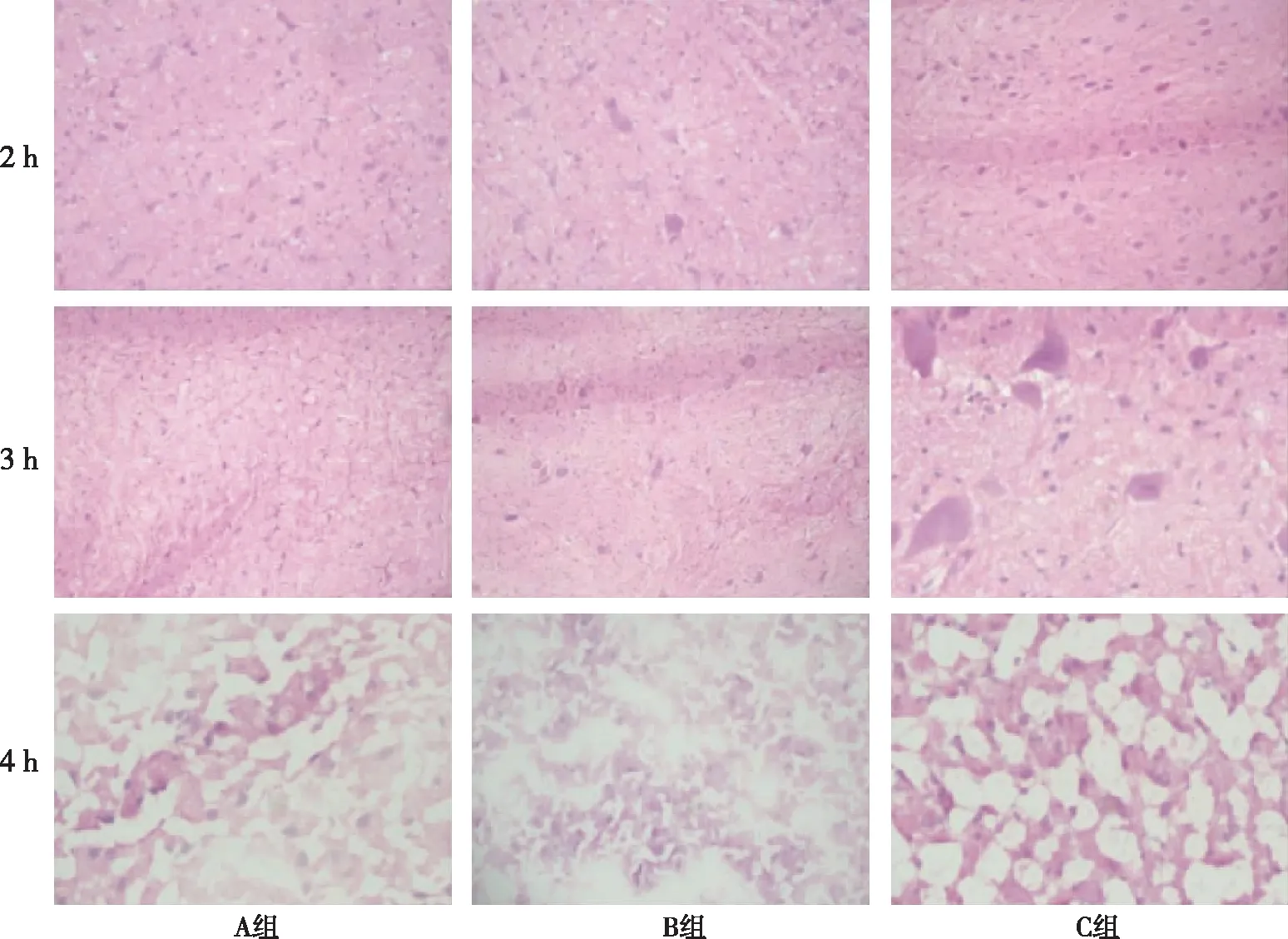
图5 3组家兔人工气腹后2、3、4 h脑组织形态学变化(HE,×200)Fig.5 Changes of brain tissue of experimental animals in the three groups after 2,3, and 4 h pneumoperitoneum(HE,×200)
3 讨论
家兔脑血液循环与人脑供血系统相似,此外家兔还具有易于饲养,便于操作,手术死亡率低,有利于进行本研究指标的观察等优点[5],,所以本研究选择家兔建立气腹模型,设立的指标(气腹压力、气腹时间)参考了姚道兵[6]、高成顺[7]在建立家兔腹腔镜CO2气腹模型中的经验,并结合了前期预实验中得出的结果。T位角度的选择参考了王宇[8]、王舰等[9]的研究结果并结合妇科腹腔镜临床常用的体位。
T位腹腔镜手术由于其不可比拟的优点在临床广为使用,同时本研究也发现在相同的手术时间,头低位倾斜角度越大的患者,出现头晕、视物模糊等症状越严重,有报道称T位引起的并发症不利于患者康复[10]。有研究发现,腹内压升高及T位的改变会导致患者静脉压力增加,引起颅内静脉经颈静脉回流至右心障碍,且头颈部静脉无瓣膜,从而导致颅内压升高[11-12],在本研究中证实了头低位的角度改变对颅内压升高的程度会产生影响。根据Monro-Kellie理论[13],颅腔的容积是固定的,颅腔内固有成分保持着体积平衡,颅内压的增高,必然会导致大脑固有平衡的紊乱,血脑屏障等发生改变,是引起脑水肿的原因。王爱桃等[14]推测腹腔镜手术后颅内压升高导致脑静水压增高与CO2人工气腹的建立及T位有一定相关性。正常情况下,暂时的体位变化对机体颅内压力影响较小,颅内压力增高,在一定范围波动,能够主动调节不会对脑灌注压产生影响或影响程度轻。有研究结果也显示,对妇科腹腔镜患者保持头低脚高位20°~30°,在可控制的时间内,可以使血流动力学改变所致的对颅内压的影响减少[15-16]。在妇科复杂性手术中,手术时间长达3~4 h,这种体位改变的影响尚未有明确的实验依据。本文在家兔实验中得出的颅内压力与人工气腹时间的关系结论与周立旺等[17]的研究相似,3组实验家兔随着3个时间点的推移颅内压呈上升趋势。同时也证实了头低位角度越大,对脑血流动力学的影响越大,颅内压越高。如果手术时间达3 h或以上,则会存在较大的安全隐患,当颅内压严重增高时,患者可出现心动过缓、潮式呼吸、血压下降等表现,称为库欣反应,库欣反应的出现,往往意味着患者己到脑病晚期,采取干预措施己经太迟[18],手术麻醉情况下患者无自觉症状,且医生对相关指标的判断受诸多因素的影响,会导致延误了颅内压增高的最佳干预时机。结合本研究结果,对其进行颅内压监测是有必要的,这对临床干预起到了警示作用。预防脑水肿并发症的发生,可以采取一些基本措施,如调整体位、控制性输液、必要时降颅压等,术中将患者由平卧位转为头高位后,患者的颅内压可显著降低[19]。其次,Oertel等[20]报道,给予患者适当的过度通气,可以降低患者的PaCO2,从而减少脑血流量,降低颅内压。腹腔镜术中患者由于长时间保持头低脚高状态而导致颅内压升高,影响患者脑血液循环而加快脑组织病理改变,因脑组织缺氧缺血而导致细胞内水肿而产生脑水肿[21]。本研究还发现脑组织病理改变的程度与气腹时间有正相关关系,这与王文立等[22]研究结果相似,但在本研究未发现其与倾斜角度相关。本研究仅进行动物实验,未进行临床观察,存在时间及经费的局限性,实验内容及方法存在单一性,今后实验会加强与其他单位合作,增加实验数据及内容,为临床治疗提供数据。
综上所述,妇科腹腔镜手术中合理使用T位,关注人工气腹时间及头低位的倾斜角度对预防颅内压增高及脑水肿有着重要的意义。人工气腹时间越长,颅内压力越高,超过3 h时,脑组织开始有脑水肿的病理改变,控制手术时间的同时,头低位角度也是影响颅内压的重要因素。同等条件下,头低位角度越大,颅内压及脑水肿程度越高,长时间手术以不超过30°为宜。

