NLRP3炎症小体对腹膜透析相关性腹膜纤维化的作用*
刘谊蓉, 黄振兴
(西宁市第一人民医院 肾内科, 青海 西宁 810000)
腹膜透析(peritoneal dialysis,PD)是公认的终末期肾病(end stage renal disease,ESRD)患者的肾脏替代疗法,PD依靠腹膜(peritoneal membrane,PM)作为超滤和扩散的半透屏障[1-2]。目前,全球约有11%的ESRD患者使用PD[3]。长期PD导致PM间质形态和功能的改变,被定义为PM纤维化(peritoneal fibrosis,PF),是PM超滤失败的主要原因[4]。尿毒症、生物不相容的PD溶液及PM炎症是PF的已知诱因,PM炎症是PF发展过程中的关键事件[5-6]。研究报道核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体参与了心血管和肾脏疾病的无菌炎症反应[7]。此外,NLRP3本身也被认为参与了肾小管上皮细胞转化生长因子-β(transforming growth factor-β,TGF-β)的信号转导,并促进了肾纤维化[8]。Hautem等[9]报道NLRP3炎症小体在PD相关细菌性PM炎的运输缺陷和形态改变中起作用。但NLRP3炎性小体在PD相关PF中的作用仍需进一步研究。因此,本研究旨在探讨NLRP3炎性小体在PD相关PF发生中的作用,为研究PD相关PF的发病机制提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1大鼠和细胞来源 选用健康SD大鼠24只,体质量180~200 g,购自成都达硕实验动物有限公司[许可证号SCXK(川)2019-189],饲养于室温(24±2)℃的环境中,维持光-暗12 h循环交替,予以充足的食料和洁净饮水;人PM间皮细胞(human peritoneal mesothelial cells,HPMC)购自武汉普诺赛生命科技有限公司。
1.1.2主要试剂及仪器 1.5%、2.5%、4.25%PD液(PD solution,PDS;美国Baxter医疗),Dulbecco's modified eagle medium(DEME)培养基(美国Gibco),胎牛血清(美国Hyclone),胰酶(上海碧云天生物),苏木素染液、伊红染液(珠海贝索生物),柠檬酸铅染液(北京中镜科仪),四氧化锇(上海摩贝生物),RNA Trizol Reagent(合肥博美生物),TB GreenTMPremix Ex TaqTMⅡ(北京宝日医生物),相关一抗NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、半胱氨酸蛋白酶-1(cysteine aspartate-specific protease-1,Caspase-1)、转化生长因子β1(transforming growth factor- pr,TGF-β1)及白细胞介素-1β(interleukin 1β,IL-1β;美国Cell Signaling Technology),生物素化山羊抗兔IgG(H+L)(英国Abcam);Western细胞裂解液和二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(上海碧云天生物),增强化学发光法(enhanced chemiluminescence,ECL)试剂盒(美国Affinity);JEM-1400PLUS透射电子显微镜(日本JEOL),PIKORed 96实时荧光定量(real-time fluorescence quantification,RT-PCR)仪(美国Thermo Fisher),化学发光凝胶成像仪5200(上海天能科技)。
1.2 研究方法
1.2.1细胞培养 HPMC细胞置于含10%胎牛血清的DMEM培养基,37 ℃的5%CO2培养箱内培养,待细胞长至80%融合时胰酶消化,采用血细胞计数板进行细胞计数,调整细胞密度约 0.5×102个/L接种于6孔板中,37 ℃的5%CO2恒温培养箱中静置培养,待细胞长至80%时待用。
1.2.2细胞鉴定 采用免疫荧光染色对HPMC细胞进行鉴定。在培养板中将已爬好细胞的玻片用磷酸缓冲液(phosphate buffer saline,PBS)浸洗3次,4%多聚甲醛固定15 min,PBS浸洗3次,滴加正常山羊血清,室温封闭30 min,滴加足够量的稀释好的抗波形蛋白抗体(vimentin,Vim),放入湿盒,4 ℃孵育过夜;PBST浸洗爬片3次,滴加稀释好的荧光(Cy3)标记羊抗小鼠IgG,37 ℃孵育1 h,加血清封闭30 min,滴加稀释好的抗细胞角蛋白抗体(pan cytokeratin,PCK),4 ℃孵育过夜;PBST 浸洗爬片3次,滴加稀释好的荧光异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记羊抗兔 IgG,37 ℃孵育1 h;滴加4,6-联脒-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)避光孵育5 min,对标本进行染核;后用含抗荧光淬灭剂的封片液封片,于荧光显微镜下观察采集图像。
1.2.3细胞分组 取对数期生长HPMC细胞分为HPMC组(不予以任何处理)、1.50%PDS组(1.50%PDS1.5 mL)、2.50%PDS组(2.50%PDS1.5 mL)、4.25%PDS组(4.25%PDS1.5 mL)、NC-siRNA组(转染NC-siRNA)、siRNA-NLRP3组(转染siRNA-NLRP3)、siRNA-NLRP3+4.25%PDS组(转染siRNA-NLRP3+4.25%PDS1.5 mL)。1.50%PDS组、2.50%PDS组及4.25%PDS组HPMC细胞分别于1.50%、2.50%及4.25%PDS中培养24 h,NC-siRNA组、siRNA-NLRP3组及siRNA-NLRP3+4.25%PDS组细胞分别采用Lipofectamine®2000按制造商说明用转染NC-siRNA或siRNA-NLRP3或加4.25%PDS,24 h后收集细胞进行后续分析。
1.2.4透射电镜观察 取1.2.3项下各组HPMC细胞经3%戊二醛预固定,1%四氧化锇再固定,丙酮脱水,将脱完水的细胞先后经脱水剂和环氧树脂渗透液,比例分别为3 ∶1、1 ∶1、1 ∶3,30~60 min/步;将渗透好的HPMC细胞块放于适当模具中,包埋液包埋,加温聚合形成固体基质(包埋块);采用超薄切片机制备约50 nm厚的超薄切片,醋酸铀、枸橼酸铅先后染色,室温下染色15~20 min,透射电镜观察细胞形态。
1.2.5大鼠PF模型构建及取样 大鼠适应性饲养1周,随机均分为生理盐水组、1.50%PDS组、2.50%PDS组及4.25%PDS组,每组6只,各组均按100 mL/(kg·d)处理,连续6周;全程给予普通饲料喂养,自由进水;4.25%PDS组大鼠死亡1只,其余组无死亡;各组大鼠末次干预后,采用1%戊巴比妥钠(35 mg/kg)腹腔注射麻醉,采集各组大鼠PM组织,取70%PM组织置于-20 ℃低温保存、30%PM组织采用4%多聚甲醛溶液固定,用于后续实验。
1.2.6苏木精-伊红(hematoxylin-eosin,HE)染色 取1.2.5项下各组大鼠PM组织,石蜡包埋,连续切片,厚度5 μm,HE染色,二甲苯透明,中性树胶封固,镜检观察各组大鼠PM组织的病理学特征。
1.2.7实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)检测 取1.2.5项下各组大鼠PM组织,使用TRIzol试剂盒按照制造商说明从PM组织中提取总RNA,逆转录合成cDNA,定量基因表达水平。引物序列:NLRP3 正向为5′-AAGAAGAGGAGGAAGTTA-3′,反向为5′-GTCAGATAGTTCAACAAT-3′;TGF-β1 正向为5′-TTAAGCAGCAGAGAC
GACCG-3′,反向为5′-TCACCGGGAACTCTATAGGT-3′;IL-1β正向为5′-GAATCTATACCTGTCTTGTG-3′,反向为5′-TTGAGAAGTGCTGATGTA-3′;GADPH正向为5′-ATCCCATCACCATCTTCCCAG-3′,反向为5′-CCATCACGCCAGTTTTCC-3′。以GAPDH内参。qRT-PCR反应条件为95 ℃初始变性10 min,95 ℃变性10 s、60 ℃退火10 s、72 ℃延伸10 s、45个循环;记录Ct值,采用2-ΔΔCt分析NLRP3、TGF-β1、IL-1βmRNA的相对表达水平。
1.2.8免疫印迹法(Western blot)检测 取1.2.3项下各组HPMC细胞及1.2.5项下各组大鼠PM组织,检测HPMC组、1.50%PDS组、2.50%PDS组HPMC细胞及各组大鼠PM组织中NLRP3和TGF-β1蛋白表达,检测NC-siRNA组、4.25%PDS组、siRNA-NLRP3组及siRNA-NLRP3+4.25%PDS组HPMC细胞中NLRP3、ASC、Caspase-1、TGF-β1及IL-1β蛋白表达。采用RIPA裂解缓冲液从各组HPMC细胞和PM组织中提取蛋白质,冰上孵育,12 000 r/min离心5 min,收集上清液,用BCA蛋白检测试剂盒检测蛋白浓度;上清液与十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)样品加载缓冲液混合,转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂牛奶中室温封闭2 h,将膜与抗NLRP3(1 ∶500)、ASC(1 ∶500)、Caspase-1(1 ∶500)、TGF-β1(1 ∶500)、IL-1β(1 ∶500)或β-actin(1 ∶2 500)的一抗一起于4 ℃孵育过夜;与辣根过氧化物酶(horseradish peroxidase,HRP)偶联的二抗(1 ∶3 000)孵育1 h;ECL暗室显色,使用Bio-Rad全功能成像系统采集图像,Image-ProPlus分析光密度,以β-actin为内参,对照组目标蛋白质相对含量为1,计算蛋白质的相对表达量,实验重复3次。
1.3 统计学分析
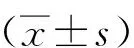
2 结果
2.1 PM组织病理学特征
生理盐水组大鼠PM组织结构较为完整、清晰,未见明显增厚;1.50%PDS组大鼠PM组织轻微增厚,间皮细胞排列紊乱甚至缺失,少量纤维组织增生,PM下肌束结构清晰,肌细胞排列较为整齐,未见明显变性坏死或炎细胞浸润;2.50%PDS组大鼠PM组织增厚,纤维组织增生较为明显,间皮细胞基本消失不见,局部可见少量淋巴细胞或中性粒细胞散在分布,PM下肌束结构清晰,肌细胞排列较为整齐,未见明显变性坏死或炎细胞浸润;4.25%PDS组大鼠PM组织明显增厚,间皮细胞基本消失不见,大量纤维组织增生,增生纤维组织较为致密,增生区域炎细胞浸润,以淋巴细胞和中性粒细胞为主,局部区域可见少量血管增生。见图1。
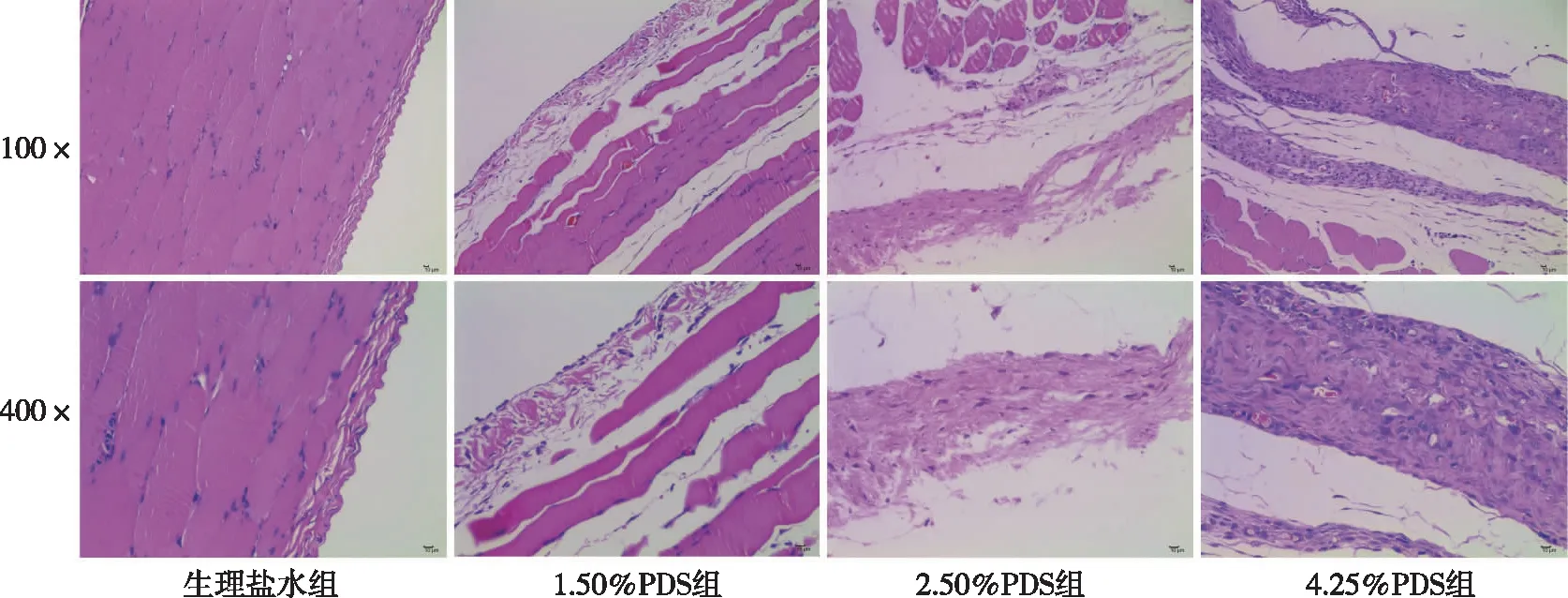
图1 各组大鼠PM组织学特征(HE染色)Fig.1 Histological characteristics of rat PM tissues in each group (HE staining)
2.2 PM组织NLRP3炎症小体的表达
与生理盐水组比较,4.25%PDS组大鼠PM组织NLRP3、TGF-β1及IL-1βmRNA表达增加(P<0.05),2.50%PDS组大鼠PM组织NLRP3和TGF-β1 mRNA表达增加(P<0.05)、但IL-1βmRNA表达差异无统计学意义(P>0.05),1.50%PDS 组大鼠PM组织NLRP3、TGF-β1及IL-1βmRNA表达差异无统计学意义(P>0.05);与生理盐水组比较,4.25%PDS组和2.50%PDS组大鼠PM组织NLRP3、TGF-β1蛋白表达增加(P<0.05),1.50%PDS 组NLRP3、TGF-β1蛋白表达差异无统计学意义(P>0.05)。见图2。
注:A为mRNA表达定量结果,B、C分别为蛋白条带检测结果及其灰度值定量结果;(1)与生理盐水组比较,P<0.05。图2 各组大鼠PM组织NLRP3炎症小体的表达Fig.2 Expression levels of NLRP3 inflammasome in rat PM tissues in each group
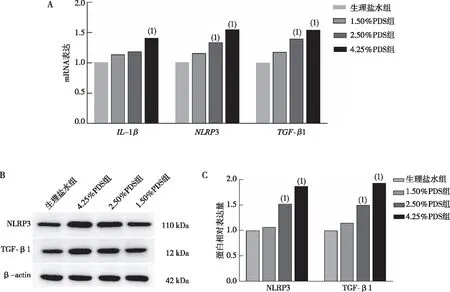
2.3 各组HPMC细胞中NLRP3炎症小体的表达
细胞鉴定结果显示,Vimentin (红色荧光)和PCK(绿色荧光)双阳性率>90%,即细胞纯度>90%;电镜观察结果显示HPMC组HPMC细胞形态结构较正常、细胞核呈不规则多边形、染色质分布均匀、以常染色质为主且核膜完整,1.50%PDS组和2.50%PDS组HPMC细胞核呈不规则多边形、染色质分布均匀、以常染色质为主、胞浆中可见细胞器(线粒体、粗面内质网、高尔基体和核糖体等)且结构完整清晰且可见少量自噬,4.25%PDS组HPMC细胞核膜完整、细胞器结构完整清晰、细胞中积累了与自噬相关的结构和凋亡空泡;Western blot检测结果显示,与HPMC组比较,2.50%PDS组和4.25%PDS组HPMC细胞NLRP3和TGF-β1蛋白表达明显升高(P<0.01)。见图3。
注:A为细胞鉴定结果(红色荧光为Vim阳性,绿色荧光为PCK阳性;DAPI是细胞核染料,Merge为DAPI和免疫荧光染色的融合图;200×),B为电镜观察结果(6 000×),C、D分别为蛋白条带检测结果及其灰度值定量结果;(1)与HPMC组比较,P<0.05。图3 各组HPMC细胞NLRP3炎症小体的表达Fig.3 Expression levels of NLRP3 inflammasome in HPMC cells in each group
2.4 细胞PF和NLRP3炎症小体的表达
电镜观察结果显示,NC-siRNA组、4.25%PDS组、siRNA-NLRP3组及siRNA-NLRP3+4.25%PDS组HPMC细胞细胞器形态结构都较完整,但4.25%PDS组HPMC细胞胞浆中含大量空泡;除NC-siRNA组外,其余3组HPMC细胞均存在不同程度的自噬,siRNA-NLRP3+4.25%PDS组HPMC细胞自噬程度减轻(图4A)。Western blot检测结果显示与NC-siRNA组比较,4.25%PDS组HPMC细胞NLRP3、ASC、Caspase-1、TGF-β1及IL-1β蛋白表达升高(P<0.05);与4.25%PDS组比较,siRNA-NLRP3+4.25%PDS组HPMC细胞中NLRP3、ASC、Caspase-1及TGF-β1蛋白表达降低(P<0.05,图4B和图4C)。
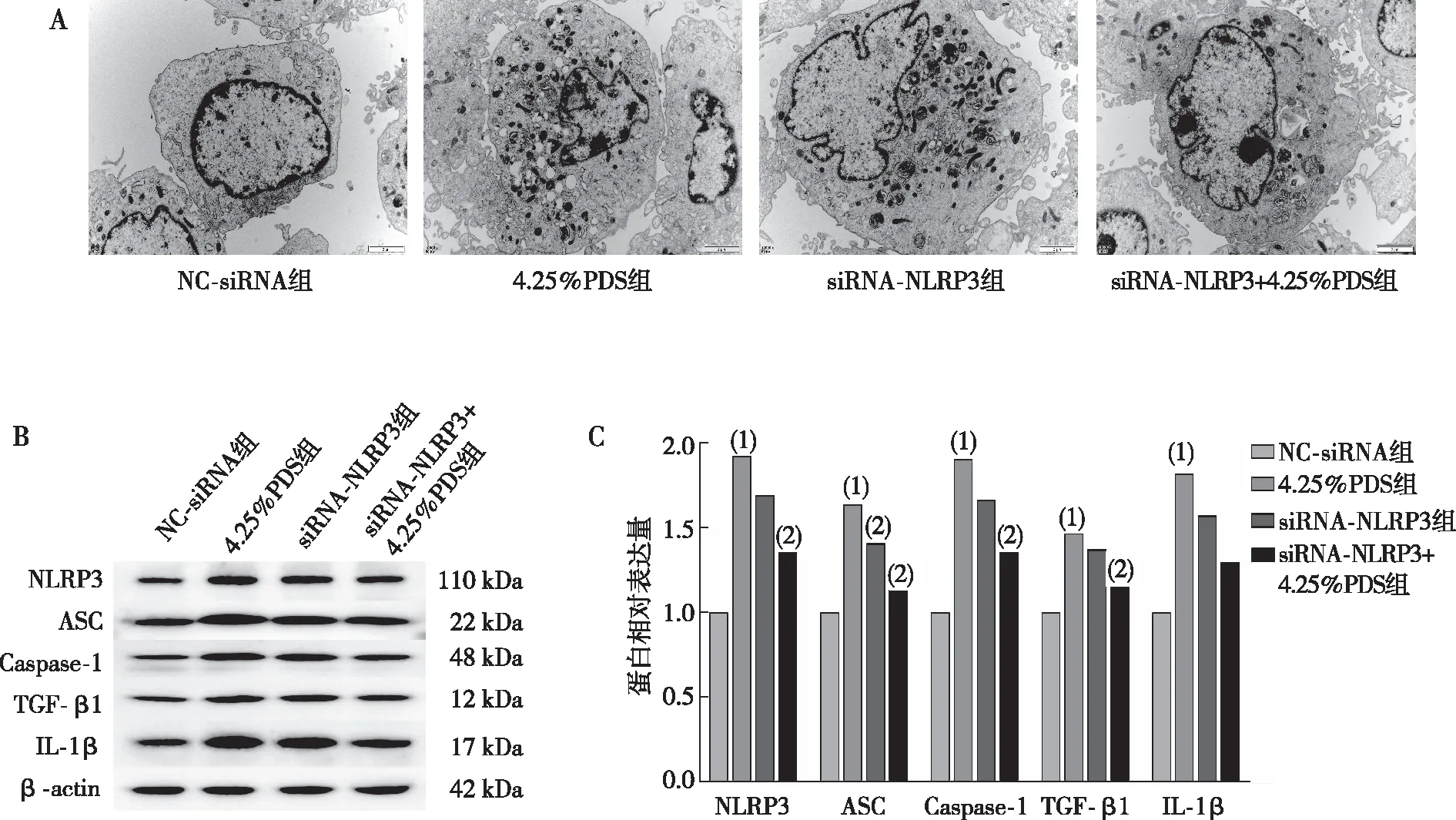
注:A为电镜观察结果(6 000×),B、C分别为蛋白条带检测结果及其灰度值定量结果;(1)与NC-siRNA组比较,P<0.05;(2)与4.25%PDS组比较,P<0.05。图4 NLRP3对细胞PF和NLRP3炎症小体表达的影响Fig.4 Effect of NLRP3 expression on cellular PF and NLRP3 inflammasome expression
3 讨论
在长时间的PD过程中,高糖PDS会加重PF,导致PD效果降低和超滤失败,目前PD相关PF的机制仍有待阐明[10]。有研究显示影响PD治疗的关键因素是PM结构和功能的改变,长期PD患者的PM组织伴随PF的形成,在患者发生严重或反复发生PM炎时更加明显,而反复发生的PM炎是导致人PM间皮细胞(human peritoneal mesothelial cells,HPMCs)发生上皮间充质转化(epithelial mesenchymal transition,EMT)的主要原因,最终导致超滤衰竭使患者透析终止[11]。此外,有研究显示NLRP3炎症小体在介导组织损伤引起的无菌性炎症中起重要作用,NLRP3是核苷酸结合寡聚化结构域样受体家族成员,可募集ASC及Caspase-1组成多蛋白复合体-NLRP3炎症小体,由于Caspase-1是一种IL-1β转换酶,NLRP3炎症小体激活Caspase-1,Caspase-1进而诱导IL-1β前体进入成熟状态,进而导致组织炎症和损伤[12-16]。体外研究发现,IL-1β可呈剂量依赖性地诱导肾小管等发生 EMT,PDS可呈时间和剂量依赖性活化HPMCs的NLRP3,诱导HPMCs发生 EMT,将si-NLRP3转染至HPMCs发现可部分抑制含糖PD液诱导的PF[17]。此外,NLRP3炎症小体的激活也会触发炎症细胞死亡[18]。有研究表明,NLRP3炎症小体是包括痛风、动脉粥样硬化、2型糖尿病及代谢综合征等多种疾病的关键介质,且可参与纤维化因子的表达和组织纤维化的发展[19-22]。PDS诱导PF大鼠模型显示了PD相关性PF的一些组织学特征,所以适合于研究PD相关性PF的发病机制[23]。本研究采用不同浓度PDS诱导大鼠PF,结果显示4.25%PDS可明显导致PM组织损伤,增加NLRP3和TGF-β1蛋白表达。这一结果与Hautem等[9]研究一致。HPMC是PM结构的主要组成部分,因此HPMCs的细胞功能水平对透析充分性起着关键作用[24]。本研究采用不同浓度PDS干预HPMC,发现4.25%PDS处理后细胞中积累了与自噬相关的结构和凋亡空泡,并较HPMC组NLRP3、TGF-β1蛋白表达明显升高,而NLRP3抑制可以减轻细胞自噬程度及明显降低NLRP3、ASC、Caspase-1及TGF-β1蛋白表达,提示NLRP3炎性小体参与了PD相关性PF的过程,抑制NLRP3可减轻HPMC自噬程度。虽然本研究已表明抑制NLRP3可减轻PDS诱导的PF细胞自噬,但其机制仍有待阐明。最近有研究表明,NLRP3炎性小体的激活通过裂解Gasdermin D诱导了一种特殊形式的细胞死亡,称为细胞焦亡[25-26];另一方面ASC还参与了其他类型的细胞死亡,如Caspase-8介导的凋亡或坏死[27]。因此,需要进一步研究NLRP3炎症小体在PD相关PF中的确切机制和作用。
综上所述,本研究表明NLRP3炎症小体在PD相关PF中有着重要作用,提示NLRP3炎症小体是预防和治疗PD相关PF的潜在靶点,但NLRP3炎症小体的确切机制仍需进一步研究。

