DC联合CIK治疗对肝癌模型大鼠免疫功能的影响*
韦运豪, 张帅, 何伟, 赵许亚, 宋杰, 周石
(贵州医科大学 影像学院, 贵州 贵阳 550004)
肝癌是消化系统最常见的实体肿瘤,也是全球常见的恶性肿瘤[1],在中国发病率较高,其总体死亡率仅次于肺癌[2],且肝癌的进展涉及复杂的病理和生理过程[3]。随着生物疗法的发展,已经表明针对肿瘤的靶向治疗具有高效率、低毒副作用[4]。细胞因子诱导的杀伤细胞(cytokine induced killer cells, CIK)具有主要组织相容性复合体不受限制的抗肿瘤活性[5],并且属于细胞毒性淋巴细胞的CD3、CD56子集[6]。CIK细胞在肿瘤治疗中的应用有助于对残留的微小病变或转移性肿瘤的清除,从而抑制了肿瘤的转移或复发,提高了患者的免疫力,成为肿瘤免疫治疗的首选方式[7]。树突状细胞(dendritic cells,DC)是一种特异性的肿瘤杀伤细胞,它有助于调节人体细胞的免疫功能。除了诱导抗原特异性细胞毒性T淋巴细胞的增殖外,DC还可以通过直接或间接的方式促进B细胞的增殖和活化,从而通过调节体液和细胞免疫在机体抗肿瘤中发挥重要作用[8]。前期的研究显示CIK细胞和DC的共培养有利于细胞增殖并增强免疫功能[9],但并未应用于肝癌的治疗研究中,本研究主要探讨DC联合CIK治疗在大鼠肝癌模型中的作用及其对免疫功能的调节,以期为肝癌的治疗提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康雄性Wistar大鼠45只、2月龄、SPF等级、体质量(250±20)g,由学校实验动物中心提供,在室温(21±1)℃、相对湿度50%~70%,光照/黑暗周期为12 h/12 h的环境中饲养,该研究方案通过学校实验动物伦理委员会审核批准。
1.1.2主要试剂和耗材 RH-35肿瘤细胞(ATCC Cell Bank,Manassas,VA,USA),Ficon淋巴细胞分离缓冲液(Haoyang Bio,广东省广州市,中国),戊巴比妥钠和利多卡(昭辉药业,上海,中国),聚偏二氟乙烯(Polyvinylidene difluoride,PVDF)膜(Pall Life Sciences,Port Washington,NY,USA),蛋白质印迹试剂(Beyotime,北京,中国), ECL试剂(Amersham Biosciences;Little Chalfont,UK),兔抗人Bcl-2单克隆抗体,兔抗人单克隆抗体,山羊抗兔辣根过氧化物酶(horseradish peroxidase,HRP)标记的IgG二抗(Cell Signaling Technology,Danvers,MA,USA)。IFN-γ、重组人GM-CSF、IL-4、IL-2、IL-1及抗CD3单克隆抗体(Life Technology,Waltham,MA,USA),用于IFN-γ、IL-4和TNF-α的ELISA试剂盒(B&D,;San Jose, CA, USA),RNA提取试剂盒和逆转录试剂盒(Axygen,Waltham,MA,USA),酶标仪(BD,San Jose,CA,USA)。ABI7500荧光定量PCR(ABI,Waltham,MA,USA),所有细胞株均在添加有10%胎牛血清,100 ug/mL链霉素和100 000 U/L青霉素(pH 7.2~7.4)的DMEM培养基中培养,并在37 ℃、5%CO2的潮湿培养箱中生长。
1.2 实验方法
1.2.1动物的分组和治疗 将大鼠肿瘤细胞RH-35制备为1×1011/L悬浮液,并原位接种在大鼠肝被膜下方0.04 mL[10]。2周后,将45只肝癌模型大鼠随机均分别为对照组、CIK组(接受自体移植CIK回输)和DC+CIK组(接受自体移植CIK和DC回输)。
1.2.2自体CIK细胞和DC细胞的制备及回输 在无菌条件下从鼠尾静脉收集1.5 mL血液样本保存在肝素处理过的试管中,Ficon淋巴细胞分离缓冲液用于分离PBMC。用RMPI-1640洗涤后,将细胞用自体血清重新分类,以2×109/L计数细胞的浓度接种到6孔板中,依次添加IFN-γ 1 000 U、IL-2 300 U、IL-1 100 U和抗CD3单克隆抗体50 μg/L,每2~3 d更换1次培养基,使细胞数计数浓度达到2×1011/L。DC细胞常规采血制备过程同前,随后在37 ℃,5%CO2的潮湿箱中孵育2 h, 弃去上清液以获得附着的细胞;加入含有1 000 000 U/L重组人GM-CSF和500 000 U/L IL-4的新鲜培养基。 每2~3 d更换1次培养基,在第7天收集悬浮细胞作为DC。在CIK组中,通过加入无菌盐水将CIK细胞制成2.5 mL悬浮液,并通过尾静脉回输给大鼠[10];在DC+CIK联合组中,将自体CIK细胞和DC以5 ∶1的比例混合,并制备成2.5 mL细胞悬液,然后通过尾静脉将其回输至大鼠[10]。
1.2.3观察肿瘤生长及样本的收集 肿瘤种植后,分别于治疗后1、4、7、10、13 d观察肿瘤的生长,测量大鼠肿瘤的长径和短径(mm),并通过长径×短径计算肿瘤的面积;通过真空管收集腹主动脉血样,在室温静置30 min后离心(3 600 r/min、4 ℃、10 min),收集上清,用于上机检测谷草转氨酶(aspartate transaminase, AST) 、丙氨酸转移酶(alanine aminotransferase, ALT)、总胆红素(total bilirubin, TBIL)和白蛋白(albumin, ALB)指标;两周后处死大鼠收集肝肿瘤组织并储存在-80 ℃下超低温冰箱。
1.2.4ELISA法检测IFN-γ、IL-4和TNF-α的分泌水平 按照测试试剂盒的说明书,使用ELISA试剂盒测定大鼠血清样品的IFN-γ、IL-4和TNF-α水平。基于标准浓度和相应的OD值计算线性回归函数,利用OD值计算样品浓度。
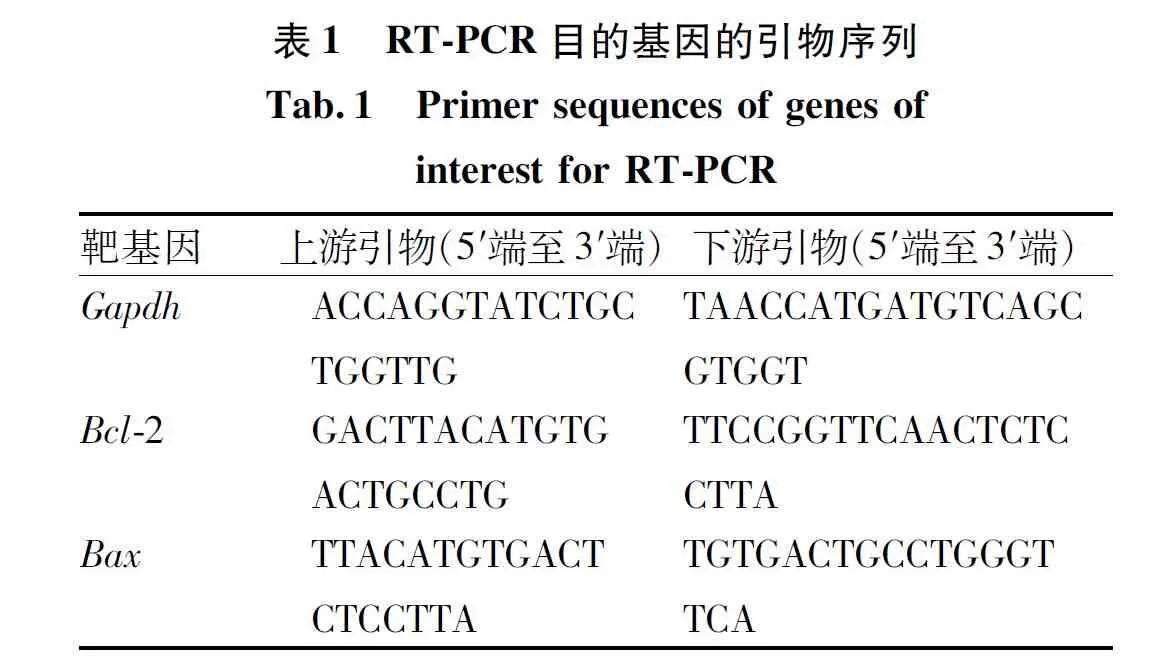
1.2.5实时PCR测量Bcl-2和Bax的mRNA表达 用TRIzol试剂提取肿瘤组织总RNA,根据测试试剂盒说明书,通过反转录合成总DNA。使用Primer 6.0软件根据靶基因序列设计引物,并由Sangon(上海,中国)合成,见表1。在以下条件下对靶基因进行实时PCR:55 ℃ 1 min,35个循环,每个循环包含92 ℃ 30 s、58 ℃ 45 s和72 ℃ 35 s,通过ABI 7500荧光定量PCR循环仪和内置软件收集数据。以Gapdh为参考,进行荧光定量以计算所有样品和标准品的CT值。首先绘制标准曲线,然后使用2-ΔΔCt方法进行半定量分析。
1.2.6蛋白质印迹测量Bcl-2和Bax蛋白表达 从各组中获取的肿瘤组织,添加裂解缓冲液以在冰上使细胞破裂15~30 min,同时进行超声处理(5 s,4次);将混合物在4 ℃下以10 000 g离心15 min;将上清液转移到新的试管中进行蛋白质定量,并在-20 ℃下保存。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,然后通过半干法将其转移到聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉去除非特异性结合位点2 h;加入兔抗人Bcl-2(1 ∶1 000)或抗人Bax单克隆抗体(1 ∶1 500),在4 ℃下过夜孵育;磷酸盐缓冲盐水和Tween 20(PBST)洗涤后,添加山羊抗兔二抗(1 ∶2 000)在室温下孵育30 min;加入ECL试剂使膜显影,然后进行X射线曝光。通过蛋白质成像系统和Quantity One软件(Hercules,CA,USA)获得用于测量条带密度的结果,每个实验重复4次。
1.3 统计学分析
2 结果
2.1 肝癌肿瘤生长
肝癌肿瘤生长情况见图1,比较3组肿瘤大小,结果显示于治疗后的第10和第13天时CIK治疗组和DC+CIK联合治疗组肿瘤面积均低于对照组,差异有统计学意义(P<0.05),且DC+CIK联合疗法组的肿瘤面积低于单纯CIK治疗组,差异有统计学意义(P<0.05)。
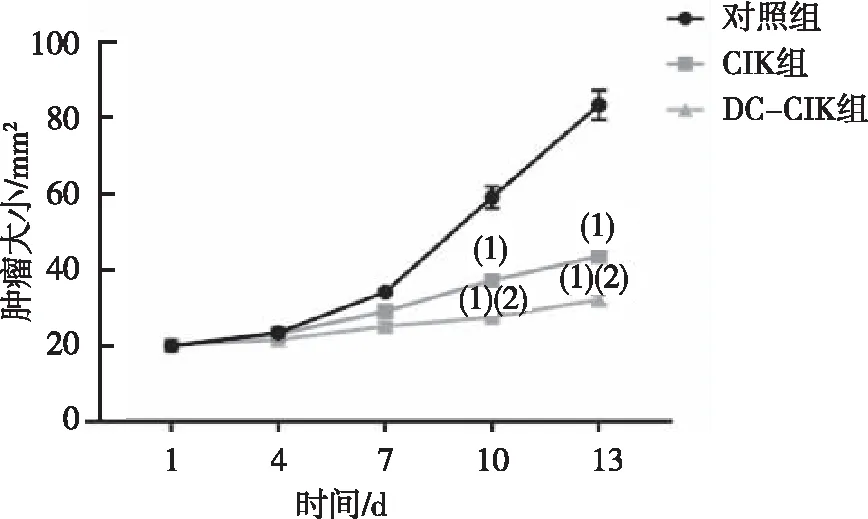
注:(1)与对照组比较,P<0.05;(2) 与CIK组比较,P<0.05。图1 DC+CIK联合治疗对肿瘤生长的影响Fig.1 Effect of DC+CIK combined treatment on tumor growth
2.2 血清ALT、AST、TBIL和ALB水平
治疗2周后,与对照组比较,CIK组和DC+CIK组大鼠血清肝功能检查发现,CIK治疗组和DC+CIK联合治疗组AST、 ALT、TBIL及 ALB水平降低(均P<0.05);且DC+CIK组比CIK组对肝功能的恢复更好(P<0.05),见表2。结果表明DC+CIK联合疗法促进了癌症模型大鼠肝功能的恢复。
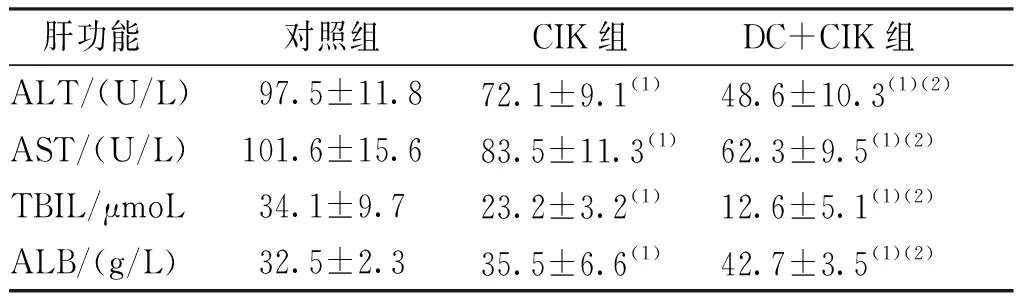
表2 治疗2周后各组大鼠肝功能指标ALT、AST、TBIL和ALBTab.2 ALT, AST, TBIL, and ALB in liver function indexes of rats at 2 weeks after the treatment
2.3 血清IFN-γ、IL-4和TNF-α水平
治疗2周后,CIK组和DC+CIK组与对照组比较,血清IFN-γ、IL-4和TNF-α的水平均升高(P<0.05);而与CIK组比较,DC+CIK组上述指标升高则更明显(P<0.05)。见图2。 提示CIK+DC联合疗法可促进细胞和体液免疫反应,并发挥抗肿瘤作用。
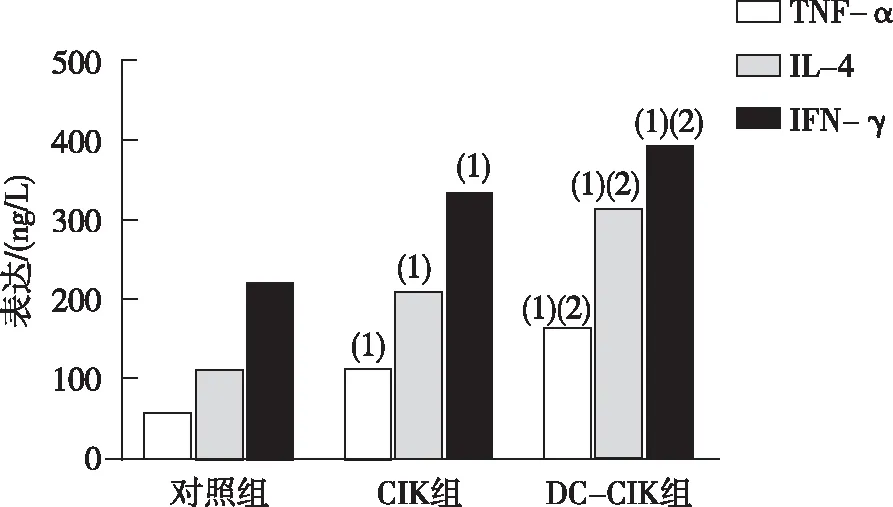
注:(1)与对照组比较,P<0.05;(2)与CIK组比较,P<0.05。图2 各组大鼠血清IFN-γ、IL-4和TNF-α水平Fig.2 The levels of serum IFN-γ, IL-4,and TNF-α of rats in each group
2.4 肝癌组织Bcl-2、Bax表达
治疗2周后,实时荧光定量PCR和Western blot检测各组大鼠肝癌组织中Bcl-2、Bax的表达发现,CIK组和DC+CIK组较对照组显著抑制肿瘤组织中Bcl-2的水平,并增强Bax的表达(P<0.05)。与CIK组比较,DC+CIK联合治疗对Bcl-2水平的抑制作用和对Bax表达的增强作用更明显(P<0.05)。见图3、图4。
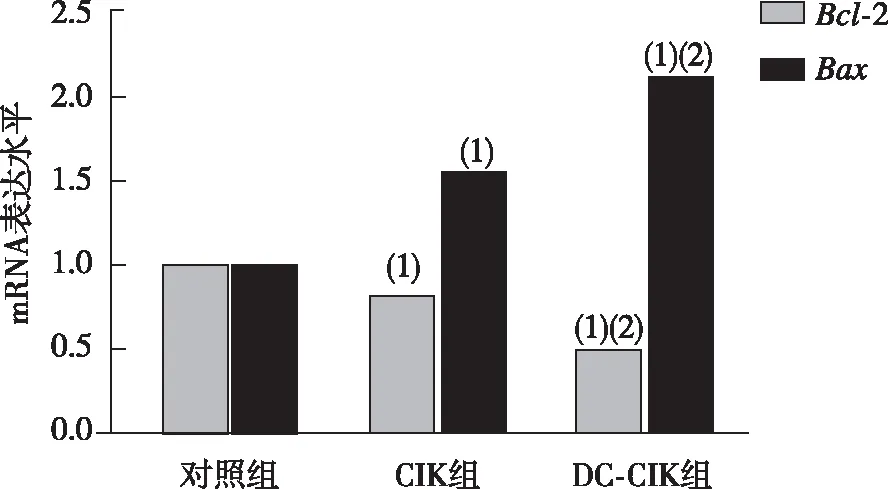
注:(1)与对照组比较,P<0.05;(2)与CIK组比较,P<0.05。图3 各组大鼠肝癌组织中Bcl-2和Bax mRNA表达Fig.3 Expression of Bcl-2 and Bax mRNA in liver cancer tissues of rats in each group
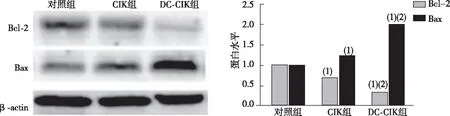
注:(1)与对照组比较,P<0.05;(2)与CIK组比较,P<0.05。图4 各组大鼠肝癌组织中Bcl-2和Bax蛋白表达Fig.4 Expression of Bcl-2 and Bax protein in liver cancer tissues of rats in each group
3 讨论
目前肝癌的治疗手段包括外科手术、放化疗和介入疗法[11]。然而,所有这些疗法的疗效均令人不甚满意,例如高频率的复发和转移频率导致其预后较差,因此,抗肝癌试剂的研发对于提高治疗效果至关重要[12]。免疫疗法是一种新兴的肿瘤治疗方法,IL-2、IFN-γ和CD3单克隆抗体诱导的CIK细胞,除了其主要组织相容性复合体不受限制的溶瘤作用外,它还具有集中在肿瘤部位发挥特异性抗肿瘤的作用[13]。目前的研究表明,与其他免疫治疗细胞(例如LAK或CD3AK)相比,CIK细胞在体内能有效增殖,以及能够大量分泌具有肿瘤杀伤作用特性的细胞因子,而这与外源性IL-2细胞因子的刺激和抑制无关,且没有毒性作用[14]。单独使用CIK细胞疗法或与化学疗法联合使用时,CIK细胞疗法在乳腺癌、肺癌或结肠癌中已显示出令人满意的疗效[15]。故本研究以CIK治疗为切入点,探讨其在大鼠肝癌模型中的作用。
DC是最有效的抗原呈递细胞(antigen-presenting cells, APC),并且是激活初级T细胞的唯一APC亚型,它可以通过直接或间接途径诱导细胞毒性T细胞和B细胞的增殖和分化。研究人员发现,DC可以显著增强CIK细胞的增殖并加速其成熟[16]。因此,DC与CIK细胞的结合可进行有效的细胞毒性作用,并对抑制肿瘤生长发挥协同作用[17]。然而,DC+CIK治疗在大鼠肝癌模型中的功能和免疫调节作用尚未阐明。因此,本研究首先通过体内肿瘤细胞移植,建立了大鼠肝癌模型,然后回输自体DC、CIK细胞。本研究的数据显示,DC+CIK联合疗法可显著缩小肿瘤大小并改善肝功能指标,这表明自体CIK和DC联合疗法除了能协同发挥抗肿瘤的作用,而且还可以让肝功能得到一定程度的恢复。
本研究进一步发现,DC+CIK联合疗法可提高肝癌大鼠血清中的IFN-γ、IL-4和TNF-α的表达水平。作为细胞免疫反应的重要调控因子,IFN-γ可以促进Th0细胞分化为Th1细胞,而IL-4可以诱导Th0细胞分化为Th2细胞。 Th1和Th2细胞分别参与细胞和体液免疫反应[18]。因此,本研究的结果表明,DC+CIK联合疗法可在肿瘤抑制过程中上调细胞和体液免疫反应。Bcl-2的过表达和Bax的抑制与肝癌细胞的抗凋亡/凋亡失衡密切相关,因为这种平衡的破坏会导致细胞活性异常[19]。本实验在mRNA和蛋白质水平上的研究表明,DC+CIK联合疗法在肝癌组织中降低了Bcl-2的表达的同时,也增强了Bax的表达,表明通过促凋亡功能产生的抗肿瘤作用,这与先前一些学者的报道一致[20]。
综上所述,DC+CIK联合疗法可通过调节细胞凋亡和抗凋亡的平衡,同时能够改善人体免疫功能并发挥抗肿瘤的作用,这比单独使用CIK具有更好的疗效,其可能为将来肝癌提供一种新型生物疗法的治疗策略。

