基于网络药理学与分子对接探讨土茯苓治疗银屑病的作用机制
肖战说 邹建华 林建国 崔炳南







摘要 目的:采用网络药理学方法,探索中药土茯苓治疗寻常型银屑病的“成分-靶点-通路”的调控网络,探讨其作用机制。方法:采用中药系统药理学数据库与分析平台(TCMSP)结合文献报道,筛选土茯苓的活性成分及作用靶点。通过GeneCards数据库、在线人类孟德尔遗传数据库(OMIM)数据库、治疗靶点数据库(TTD)数据库、PharmGkb数据库及DrugBank数据库筛选出寻常型银屑病的相關疾病靶点。运用R语言将药物成分匹配疾病靶点,通过复杂可视化网络平台Cytoscape 3.7.2软件构建“药物-成分-关键靶点-疾病”网络。采用蛋白质-蛋白质相互作用(PPI)网络数据库(STRING)构建靶蛋白PPI网络,找出关键基因,对成分-疾病的交集基因进行基因本体(GO)及京都基因和基因组百科全书(KEGG)通路富集分析。结果:网络分析显示,15个活性成分共涉及有效靶点325个,86条作用通路,预测出12个活性成分、114个靶点蛋白和20条关键通路与寻常银屑病相关。分子对接结果显示核心成分与核心靶点具有较好的结合能。结论:土茯苓可能通过作用于IL-17信号通路及肿瘤坏死因子(TNF)信号通路等相关靶点起到治疗寻常型银屑病的功效,本研究初步揭示了土茯苓治疗寻常银屑病的潜在活性化合物与可能作用机制。
关键词 土茯苓;银屑病;网络药理学;分子对接;克银方
Pharmacological Mechanism of Rhizoma Smilacis Glabrae in Treating Psoriasis Vulgaris Based on Network Pharmacology and Molecular Docking
XIAO Zhanshuo1,ZOU Jianhua2,LIN Jianguo1,CUI Bingnan1
( Guang′anmen Hospital of China Academy of Chinese Medical Sciences,Beijing 100053,China; 2 Xiyuan Hospital of China Academy of Chinese Medical Sciences,Beijing 100091,China)
Abstract Objective:To explore the component-target-pathway regulatory network of Chinese herbal medicine Rhizoma Smilacis Glabrae in the treatment of psoriasis vulgaris by network pharmacology and with the help of R language.Methods:The active components and targets of Rhizoma Smilacis Glabrae were filtered by Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP) combined with literature research.The targets of psoriasis vulgaris were screened by GeneCards,Online Mendelian Inheritance in Man(OMIM),Therapeutic Target Database(TTD),PharmGkb and DrugBank.The drug component and disease targets were matched using the R language and the drug-component-key target-pathway network was established by Cytoscape 3.7.2.STRING was used to construct the protein-protein interaction(PPI) network,and the key genes were identified by the R language to draw the histogram.Gene Ontology(GO) and Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis were conducted on the component-disease intersection targets.Results:There were 15 active components involving 325 valid targets and 86 pathways,among which 12 active components,114 target proteins and 20 key pathways were predicted to be associated with psoriasis vulgaris.Molecular docking displayed that the core components could well bind to the core targets.Conclusion:Rhizoma Smilacis Glabrae may play a role in the treatment of psoriasis vulgaris by acting on tumor necrosis factor(TNF) and IL-17 signaling pathways.This paper preliminarily revealed the potential active components and possible mechanism of Rhizoma Smilacis Glabrae in the treatment of psoriasis vulgaris,and provided theoretical basis for further experimental studies on the basis of pharmacological mechanism.
Keywords Rhizoma Smilacis Glabrae; Psoriasis vulgaris; Network pharmacology; Molecular docking; Keyin prescription
中图分类号:R285.6文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.05.011
银屑病是皮肤科临床常见的慢性炎症性皮肤病,是世界性重点防治的皮肤病之一,该病发病占世界人口的0.1%~0.3%,我国患病率约为0.5%[1],严重危害患者身心健康。银屑病的病因现尚未完全清楚,但涉及遗传、免疫等多方面因素,发病机制是以T淋巴细胞介导为主,多种免疫细胞共同参与的免疫反应,导致角质形成细胞过度增殖及异常分化,炎症发生及血管生成[2]。
中医治疗银屑病历史悠久,通过清热利湿、凉血解毒、活血祛瘀、薄肤去屑等功效的中药治疗,能达到较好疗效且不良反应少[3-5]。中国中医科学院广安门医院于20世纪70年代开始,在中医皮外科专家朱仁康教授的指导下,开展了中医药治疗银屑病的临床及基础研究,并研制出了疗效显著的克银系列方[6-7],其中克银三方作为科技转化成果制成克银丸,成为首个治疗银屑病的中成药。
克银系列方剂中的君药为土茯苓。土茯苓是百合科藤本植物光叶菝葜的干燥块茎,初以“禹余粮”之名载于《神农本草经》,《滇南本草》首载“土茯苓”之名,李时珍在《本草纲目》强调其治疗“恶疮痈肿”之功效。现代中药学将土茯苓归为清热解毒药,其具有解毒除湿、通利关节的功效,多用于杨梅毒疮、肢体拘挛、淋浊带下,湿疹瘙痒、痈肿疮毒等疾病[8]。朱仁康教授较早地将土茯苓运用在银屑病的治疗中,取得了较好的疗效,现土茯苓已经成为了治疗银屑病的专病药。
网络药理学采用“多化合物,多靶点,多途径”方法,整合医学、生物信息学、计算机科学等多学科理论,用以阐释疾病发生机制、药物主要活性成分以及药物作用靶点,构建“成分-靶点-通路-疾病”网络,用于研究中药的系统作用[9]。本研究将运用网络药理学方法为土茯苓治疗银屑病的微观作用机制及物质基础提供全面认识,也为后续实验研究探明方向。
资料与方法
1. 土茯苓活性化合物与相关靶蛋白的收集及筛选
本研究采用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)[10],检索土茯苓的潜在活性成分及作用靶点。根据成分的药物动力学参数进行初步筛选,其中药物口服生物利用度(Oral Bioavailability,OB)≥30%且类药性(Drug Likeness,DL)≥0.18,获得土茯苓的活性化合物及相关靶蛋白。
1.2 银屑病相关靶点的收集及筛选
通过4个数据库:GeneCards(https://www.genecards.org)、治疗靶点数据库(Therapeutic Target Database,TTD,http://bidd.nus.edu.sg/group/cjttd)、PharmGkb(https://www.pharmgkb.org/)、在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,http://www.omim.org),以“Psoriasis”为关键词检索,初步获得银屑病的潜在靶点,再通过数据库DrugBank(https://www.drugbank.ca)收集治疗银屑病的一线用药的作用靶点,用以补充前4个数据库所收集的靶点[11]。合并上述5个疾病数据库中所收集的靶点,删除重复部分即得到寻常型银屑病的相关靶点。再利用R语言匹配映射药物活性成分相关的靶点和疾病靶点,绘制韦恩图(Venn)获得药物土茯苓活性化合物潜在作用靶点。
1.3 土茯苓-成分-银屑病关键靶点网络的构建
将土茯苓的活性化合物对应的靶点基因匹配银屑病相关靶点基因,交集基因即是土茯苓治疗银屑病的关键靶点。运用Cytoscape软件(Version 3.7.2)构建“药物-成分-关键靶点”关系网络。通过构建这一网络对土茯苓治疗银屑病作用机制进行可视化,初步展示藥物-成分-疾病靶点之间的联系。
1.4 土茯苓成分-银屑病靶点蛋白质-蛋白质相互作用网络的构建
运用STRING数据库(https://string-db.org/Version 10.5)预测蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)关系。将交集靶点提交至STRING数据库,研究物种选择人类(Homo sapiens),最小互相作用阈值设定为“highest confidence>0.9”,其余默认设置,将获得的PPI关系结果用TSV格式导出,再用Cytoscape软件可视化分析,得到土茯苓成分-银屑病靶点PPI网络。
1.5 基因本体分析及京都基因和基因组百科全书通路分析
利用Bioconductor平台(http://bioconductor.org/biocLite.R)和R语言ggplot2包对获得的基因进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,并绘制出柱状图和气泡图。
1.6 核心成分与核心靶点的分子对接
选取核心成分与核心靶点进行分子对接。核心成分化合物结构通过PubChem数据库获取,Chem3D软件对化合物结构进行3D化处理。核心靶点通过蛋白质结构数据库(Protein Data Bank,PDB)获取,利用Pymol软件对蛋白质进行去除水分子、分离蛋白和小分子处理。再通过Autodock Vina软件进行分子对接,得出相关能量的计算结果。最后利用Pymol软件对结果进行可视化处理。
2 结果
2. 土茯苓潜在活性化合物收集及筛选
在TCMSP数据库中共检索到74个土茯苓化学成分,筛选设定为OB≥30%,DL≥0.18,获得15个活性化合物。见表1。
2.2 土茯苓有效成分治疗银屑病的潜在作用靶点预测
从GeneCards数据库共获得3 730个银屑病靶点,结合TTD数据库、PharmGkb数据库、OMIM数据库以及DrugBank数据库补充相关靶点,删除重复部分共获得3 791个银屑病相关靶点。通过TCMSP数据库筛选有效成分对应的作用靶点,去除无效和重复靶点后,得到土茯苓有效成分作用靶点325个。利用UniProt平台进行基因ID与基因Symbol的转换,对有效成分对应的基因名称进行标准化。将筛选的土茯苓有效成分靶点与银屑病靶点取交集,绘制韦恩图,得到土茯苓成分-银屑病共同靶点114个。见图1。
2.3 土茯苓-成分-银屑病关键靶点网络的构建分析
土茯苓与银屑病相关的潜在有效成分12个分别为:Beta-Sitosterol、Naringenin、Stigmasterol、4,7-Dihydroxy-5-Methoxyl-6-Methyl-8-Formyl-Flavan、(-)-Taxifolin、(2R,3R)-2-(3,5-Dihydroxyphenyl)-3,5,7-Trihydroxychroman-4-One、Isoengelitin、Astilbin、Taxifolin、Diosgenin、Cis-Dihydroquercetin、Quercetin。通过Cytoscape软件可视化分析土茯苓潜在活性化合物以及114个关键靶基因,构建了“药物-潜在活性成分-关键作用靶点网络图”。见图2。图中粉红色代表土茯苓成分化合物,绿色代表疾病靶点,蓝色代表药物,红色代表疾病。结果显示,连接度前5的关键靶点基因为PTGS2、PTGS1、RELA、RXRA、BCL2。连接度前5的药物有效成分为:槲皮素(Quercetin)、柚皮素(Naringenin)、薯蓣皂苷元(Diosgenin)、Β-谷甾醇(Beta-Sitosterol)、紫杉醇(Taxifolin)。
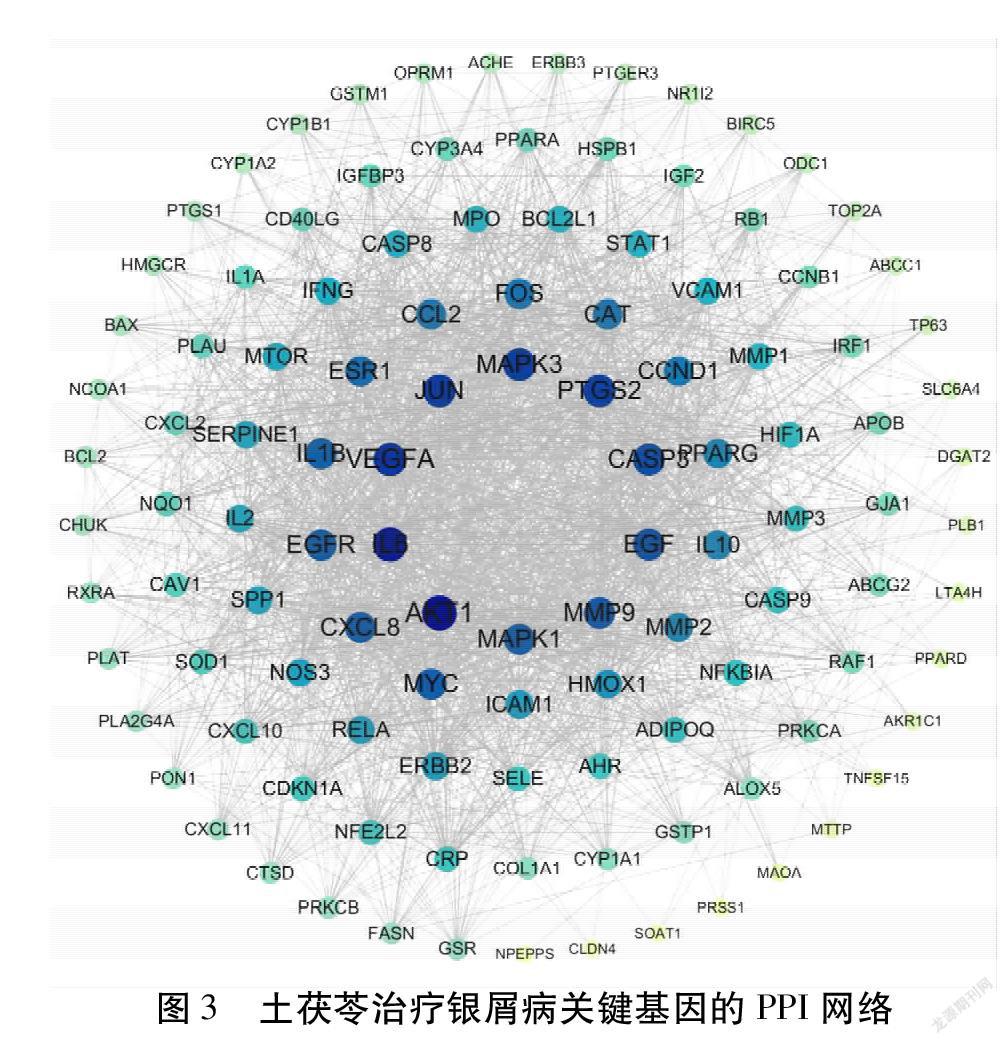
2.4 关键靶点基因PPI网络分析
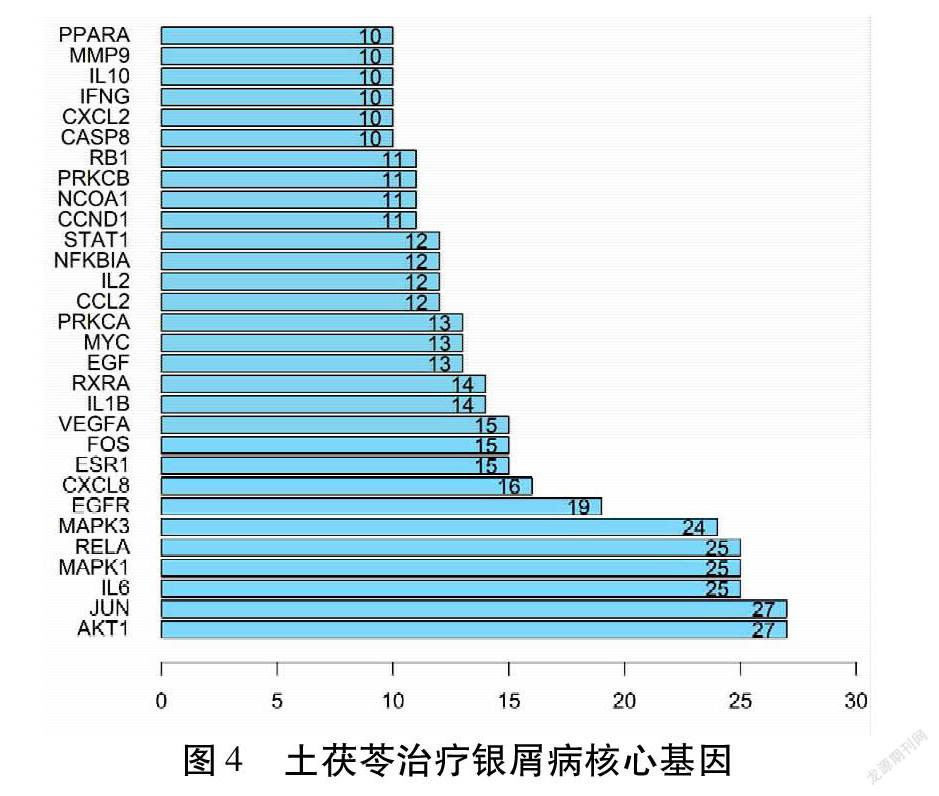
在STRING数据库平台中导入土茯苓治疗银屑病的114个潜在靶点基因,物种选择人类,获得表达蛋白之间相互作用的关系网络。结果表明,PPI网络包括114个节点,257条边。见图3。绘制前30位核心基因的柱状图。得出AKT1、JUN的邻接节点均为27个靶蛋白基因,IL6、MAPK1、RELA的邻接节点均为25个靶蛋白基因,MAPK3的邻接节点为24个靶蛋白基因,EGFR的邻接节点为19个靶蛋白基因,证明以上几个基因在整个PPI网络中位于调控网络的核心,可能在药物活性成分参与治疗银屑病过程中发挥关键作用。见图4。
2.5 土茯苓中关键靶点基因生物功能分析
GO注释结果显示,土茯苓作用的关键基因富集后排名靠前的生物学功能主要为细胞因子活性、细胞因子受体结合、受体配体活性,其余依次为血红素结合、核受体活性、转录因子活性、直接配体调节的序列特异性DNA结合、磷酸酶结合、四吡咯结合、抗氧化活性、激酶调节活性、泛素样蛋白连接酶结合、RNA聚合酶Ⅱ转录因子结合等。圆点越大,富集越多,P值越小,表明该生物功能的富集显著性越可靠,颜色越红。见图5。表明土茯苓可以通过调控多种生物过程发挥治疗银屑病的作用。
2.6 土茯苓关键靶点基因富集通路分析
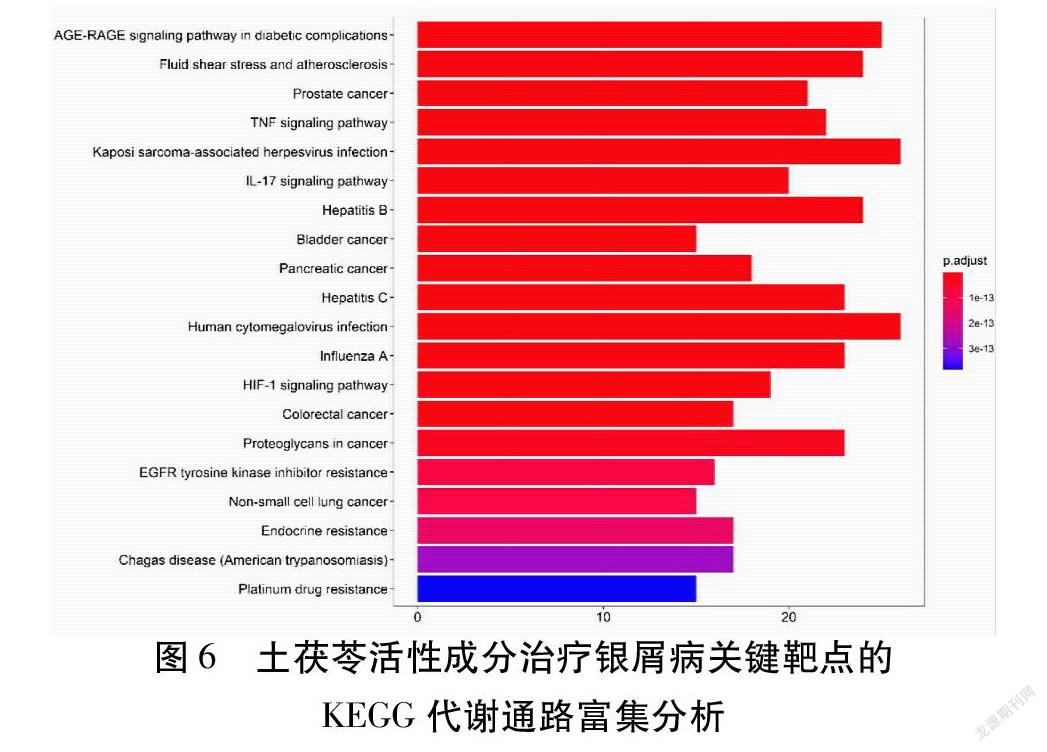
通过注解及分析共得到159条作用通路,根据P值分析,其中与疾病相关的有20条。主要富集通路为肿瘤坏死因子(TNF)信号通路、IL-17信号通路、糖尿病并发症的AGE-RAGE信号通路、流体剪切应力与动脉粥样硬化、前列腺癌、卡波西肉瘤相关疱疹病毒感染,同时还涉及乙肝、膀胱癌、胰腺癌、丙肝、人巨细胞病毒感染、甲型流感、信号通路等通路,表明土茯苓潜在活性成分靶点基因可以作用于不同的通路,可以拓展治疗不同疾病通路。P值越小,表明该差异表达基因在此条通路中富集显著性越可靠,颜色越红。见图6。此处根据P值列出了与银屑病相关度较可靠的2条关键通路。见表2。
2.7 分子对接
选取核心化合物中排名靠前的槲皮素(Quercetin)、柚皮素(Naringenin)、薯蓣皂苷元(Diosgenin)、Β-谷甾醇(Beta-Sitosterol)、紫杉醇(Taxifolin)依次与核心治疗靶点AKT1、PTGS2、IL-6、MAPK1、EGFR对接,配体与受体的结合能均≤-6.0 kcal/mol( kcal=4 186 J),表明结合稳定。对接活性最好的为Beta-Sitosterol与AKT1的结合,其次是Diosgenin与EGFR的结合。见表3,图,7。
3 讨论
网络药理学结合了生物信息学知识,是基于疾病、蛋白质靶点和药物相互作用网络的系统分析方法,廣泛运用于预测中医药治疗相关疾病的机制,有效推动了中药复方及单体的研究[12-13]。本研究通过生物网络分析方法,探索土茯苓治疗银屑病的核心机制。
本研究较为直观地展现土茯苓中12个化合物成分、114个靶蛋白、20条作用通路和银屑病间的关联。土茯苓作用于银屑病靶基因的主要活性成分为槲皮素(Quercetin)、柚皮素(Naringenin)、薯蓣皂苷元(Diosgenin)、Β-谷甾醇(Beta-Sitosterol)、紫杉醇(Taxifolin)。槲皮素是部分天然植物的类黄酮成分,具有抗炎,抗氧化,抗癌,心脏保护,肝脏保护等多种作用,有研究表明,槲皮素可能通过抗氧化、抗炎、抗增殖活性[14]、抑制核因子κB信号转导的激活[15]、调节肠道菌群[16]等途径而起到治疗银屑病的作用。柚皮素为柑橘类黄酮成分,能够抑制IL-6过表达、缓解鳞屑和表皮增生、修复皮肤屏障功能[17]、抑制TNF-α激活的炎症途径[18],若运用甲氨蝶呤治疗银屑病时,柚皮素还能抑制此药诱导的肝毒性[19]。薯蓣皂苷能抑制核因子κB及HaCaT细胞的生长,并通过调节胱天蛋白酶-3,Bax和Bcl-2蛋白的表达诱导细胞凋亡,同时还能减少角质形成细胞中VEGF-α的表达而部分抑制血管形成[20]。β-谷甾醇属于植物甾醇中重要组成,可以具有类似激素样的抗炎作用,但无激素类药物不良反应[21]。紫杉醇具有多种药理活性,可以抑制HaCat细胞异常增殖,同时抑制Notch1和Jak2/Stat3途径来调节辅助性T细胞的分化,从而治疗银屑病[22]。其中Jak(哺乳动物Janus激酶)是治疗银屑病的自身免疫性炎性疾病的靶标,信号转导及转录激活因子3(STAT3)参与调节细胞增殖分化、恶性转化、成活和凋亡等基本细胞生物学过程[23]。综合上述研究结果,说明本研究中筛选出的活性成分具有抗炎、抗增殖、抑制血管生成、修复皮肤屏障功能,从而达到治疗银屑病的作用。提示在后续土茯苓等治疗银屑病的现代化制剂研发中,应该最大限度地保留有效活性成分。
土茯苓的活性成分作用靶点与114个主要蛋白有很强的相互作用,其中AKT1、JUN、IL-6、MAPK1、RELA、MAPK3与EGFR为关键靶蛋白,且与其他多个蛋白发生相互作用。其中蛋白激酶B(AKT)是角质形成细胞增殖的关键上游分子,抑制AKT可有效改善银屑病的治疗效果[24]。JUN蛋白是角质形成细胞增殖分化和细胞因子产生的重要调节剂,当JUN蛋白缺失时会导致S100A8和S100A9的高表达,从而使角质形成细胞过度增殖和异常分化,在JUN蛋白缺乏的同时也会使表皮生长因子受体(EGFR)表达降低[25]。促分裂原活化的蛋白激酶(MAPK)在接受细胞因子、生长因子、应激信号以及致癌刺激后被激活,增强JUN活性,从而调节细胞增殖、分化及凋亡[26]。RELA在胚胎发生过程中控制表皮发育,能通过抑制先天性免疫介导的炎症而调节表皮稳态[27],还能保护表皮角质形成细胞免于凋亡[28]。白细胞介素-6(IL-6)是由T细胞、B细胞、髓样细胞和角质形成细胞产生的多功能炎症介质,在某些条件下可以刺激角质形成细胞的增殖,而IL-6的高表达能直接导致银屑病表皮增殖,并影响真皮中部分免疫细胞的功能[29-30]。由此土茯苓潜在活性成分治疗银屑病的关键作用可能是上调JUN、RELA表达及下调EGFR、IL-6、MAPK的表达,抑制角质形成细胞增殖、血管生成及抑制炎症。
通过对土茯苓治疗银屑病的114个疾病靶点进行GO生物过程富集,显示土茯苓可以通过细胞因子活性、细胞因子受体结合、受体配体活性,以及血红素结合、核受体活性、转录因子活性、直接配体调节的序列特异性DNA结合、磷酸酶结合、四吡咯结合、抗氧化活性、激酶调节活性、泛素样蛋白连接酶结合、RNA聚合酶Ⅱ转录因子结合等等发挥治疗作用。KEGG分析提示,影响上述生物过程最主要可能是IL-17信号通路及TNF信号通路。IL-17分子主要由辅助性T17细胞(Th17)产生,IL-17是银屑病发病的重要因素,能激活角质形成细胞产生细胞凋亡,IL-17A刺激树突状细胞和成纤维细胞产生IL-6,IL-17F也能诱导角质形成细胞产生IL-6[31]。同时IL-17也能通过刺激成纤维细胞产生血管来促进内皮细胞的增殖和血管生成[32]。研究表明通過抑制IL-17信号通路,能达到较好的治疗银屑病效果,如苏金单抗、依克珠单抗、布罗达单抗等生物制剂均是以此信号通路为靶向[33-34]。TNF-α可帮助炎症细胞穿透血管壁,激活血管内皮细胞和中性粒细胞,并调节免疫反应和炎症,同样被认为是IL-6的有效诱导剂[35-36]。由此,推测土茯苓治疗银屑病可能通过抑制IL-17信号通路及TNF信号通路,从而恢复角质形成细胞功能,而达到银屑病的治疗效果。
综上所述,本研究初步揭示了土茯苓治疗银屑病功效的潜在活性成分及其可能的作用机制,不仅为临床运用土茯苓治疗银屑病提供了科学依据,也为发掘土茯苓的潜在作用机制提供了新的方向。本研究运用网络药理学的方法对土茯苓主要药效成分治疗银屑病的作用机制提供了预测理论基础,但是其进一步的机制还须在此基础上通过生物学的技术进行验证,如动物或细胞实验,进而能更确切地深入研究土茯苓治疗银屑病的主要调控靶点。
参考文献
[1]刘宇,赵京霞,王燕,等.养血解毒方对银屑病角质形成细胞紧密连接的调节作用[J].中国实验方剂学杂志,2020,26(3):62-70.
[2]中华医学会皮肤性病学分会银屑病专业委员会.中国银屑病诊疗指南(2018简版)[J].中华皮肤科杂志,2019,52(4):223-230.
[3]曹爽,周妍妍,杨素清,等.中医药干预银屑病Th17/Treg平衡的研究进展[J].中国实验方剂学杂志,2021,27(19):225-232.
[4]张益生,程静,李元文,等.斑块型银屑病中医药治疗研究进展[J].现代中医临床,2019,26(6):62-66,71.
[5]马秉智,李栋,王海洋,等.基于网络药理学和分子对接技术探讨黄芩-黄柏药对治疗银屑病的有效成分及作用机制[J].中国中药杂志,2021,46(20):5330-5340.
[6]朱仁康,邹铭西,李博鉴,等.“克银方”治疗银屑病的临床研究进展——附236例疗效观察[J].中医杂志,1983,24(9):31-33.
[7]朱仁康,邹铭西,李博鉴,等.“克银方”治疗银屑病(牛皮癣)的临床研究——附108例疗效观察[J].中医杂志,1981,22(4):22-24.
[8]高学敏.中药学[M].2版.北京:中国中医药出版社,2017:120.
[9]Huang XF,Cheng WB,Jiang Y,et al.A network pharmacology-based strategy for predicting anti-inflammatory targets of ephedra in treating asthma[J].Int Immunopharmacol,2020,83:106423.
[10]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[11]Wishart DS,Feunang YD,Marcu A,et al.HMDB 4.0:the human metabolome database for 2018[J].Nucleic Acids Res,2018,46(D1):D608-608D617.
[12]Cheng Y,Liu Y,Tan J,et al.Integrated serum metabolomics and network pharmacology approach to reveal the potential mechanisms of withanolides from the leaves of Datura metel L.on psoriasis[J].J Pharm Biomed Anal,2020,186:113277.
[13]世界中醫药学会联合会.网络药理学评价方法指南[J].世界中医药,2021,16(4):527-532.
[14]冯亚莉,李浩,刘娟,等.槲皮素研究进展[J].中国中药杂志,2021,46(20):5185-5193.
[15]Chen H,Lu C,Liu H,et al.Quercetin ameliorates imiquimod-induced psoriasis-like skin inflammation in mice via the NF-κB pathway[J].Int Immunopharmacol,2017,48:110-117.
[16]Ely PH.Is psoriasis a bowel disease? Successful treatment with bile acids and bioflavonoids suggests it is[J].Clin Dermatol,2018,36(3):376-389.
[17]Malayeri A,Badparva R,Mombeini MA,et al.Naringenin:a potential natural remedy against methotrexate-induced hepatotoxicity in rats[J].Drug Chem Toxicol,2022,45(2): 491-498.
[18]Gupta SC,Tyagi AK,Deshmukh-Taskar P,et al.Downregulation of tumor necrosis factor and other proinflammatory biomarkers by polyphenols[J].Arch Biochem Biophys,2014,559:91-99.
[19]Malayeri A,Badparva R,Mombeini MA,et al.Naringenin:a potential natural remedy against methotrexate-induced hepatotoxicity in rats[J].Drug Chem Toxicol,2022,45(2):491-498.
[20]Wu S,Zhao M,Sun Y,et al.The potential of Diosgenin in treating psoriasis:Studies from HaCaT keratinocytes and imiquimod-induced murine model[J].Life Sci,2020,241:117115.
[21]Liz R,Zanatta L,dos Reis GO,et al.Acute effect of β-sitosterol on calcium uptake mediates anti-inflammatory effect in murine activated neutrophils[J].J Pharm Pharmacol,2013,65(1):115-122.
[22]Abdou AG,Maraee AH,Sharaf A,et al.Up-regulation of Notch- in psoriasis:an immunohistochemical study[J].Ann Diagn Pathol,2012,16(3):177-184.
[23]Andrés RM,Hald A,Johansen C,et al.Studies of Jak/STAT3 expression and signalling in psoriasis identifies STAT3-Ser727 phosphorylation as a modulator of transcriptional activity[J].Exp Dermatol,2013,22(5):323-328.
[24]Zhang M,Zhang X.The role of PI3K/AKT/FOXO signaling in psoriasis[J].Arch Dermatol Res,2019,311(2):83-91.
[25]Zenz R,Eferl R,Kenner L,et al.Psoriasis-like skin disease and arthritis caused by inducible epidermal deletion of Jun proteins[J].Nature,2005,437(7057):369-375.
[26]Polepalli S,George SM,Valli Sri Vidya R,et al.Corrigendum to “Role of UHRF in malignancy and its function as a therapeutic target for molecular docking towards the SRA domain”[J].Int J Biochem Cell Biol,2019,114:105577.
[27]Gugasyan R,Voss A,Varigos G,et al.The transcription factors c-rel and RelA control epidermal development and homeostasis in embryonic and adult skin via distinct mechanisms[J].Mol Cell Biol,2004,24(13):5733-5745.
[28]Kumari S,Herzberg B,Pofahl R,et al.Epidermal RelA specifically restricts contact allergen-induced inflammation and apoptosis in skin[J].J Invest Dermatol,2014,134(10):2541-2550.
[29]Fujishima S,Watanabe H,Kawaguchi M,et al.Involvement of IL-17F via the induction of IL-6 in psoriasis[J].Arch Dermatol Res,2010,302(7):499-505.
[30]Baran W,Szepietowski JC,Mazur G,et al.IL-6 and IL-10 promoter gene polymorphisms in psoriasis vulgaris[J].Acta Derm Venereol,2008,88(2):113-116.
[31]Wu Y,Liu L,Bian C,et al.MicroRNA let-7b inhibits keratinocyte differentiation by targeting IL-6 mediated ERK signaling in psoriasis[J].Cell Commun Signal,2018,16(1):58.
[32]AbuHilal M,Walsh S,Shear N.The Role of IL-17 in the Pathogenesis of Psoriasis and Update on IL-17 Inhibitors for the Treatment of Plaque Psoriasis[J].JCutan Med Surg,2016,20(6):509-516.
[33]Tausend W,Downing C,Tyring S.Systematic review of interleukin-12,interleukin-17,and interleukin-23 pathway inhibitors for the treatment of moderate-to-severe chronic plaque psoriasis:ustekinumab,briakinumab,tildrakizumab,guselkumab,secukinumab,ixekizumab,and brodalumab[J].J Cutan Med Surg,2014,18(3):156-169.
[34]張鑫,王孟清,罗银河,等.五虎汤对RSV诱导的哮喘小鼠模型树突细胞自噬和炎性因子IL-17A和IL-17F水平的影响[J].中草药,2021,52(3):718-726.
[35]吕芹,韩立,丁生晨,等.温阳化浊通络方对系统性硬化病患者Th17细胞增殖的影响[J].中成药,2020,42(12):3293-3297.
[36]Campanati A,Paolinelli M,Diotallevi F,et al.Pharmacodynamics OF TNF α inhibitors for the treatment of psoriasis[J].Expert Opin Drug Metab Toxicol,2019,15(11):913-925.
(2021-02-22收稿 本文编辑:魏庆双)

