“心脑同调”法电针对焦虑大鼠行为学及血清相关因子的影响
许璐凡 王军 李诗梦 李鸣 惠志远 杨磊
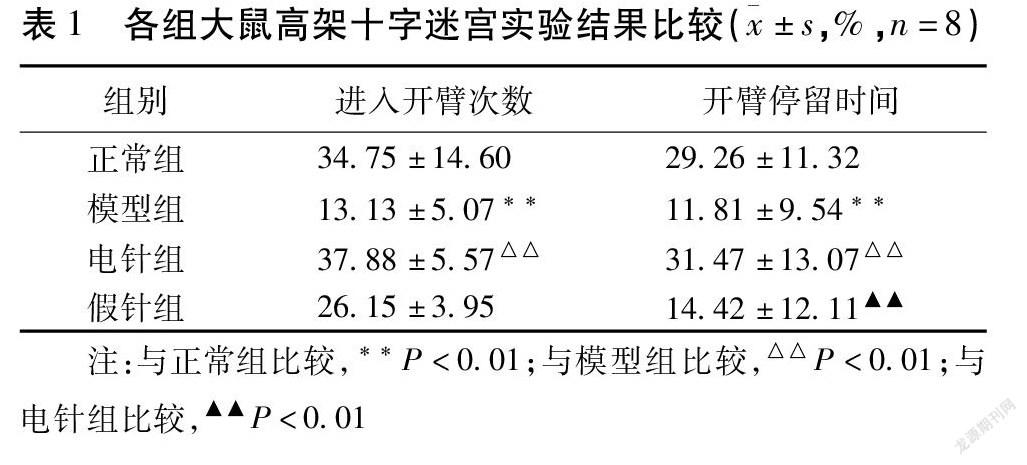
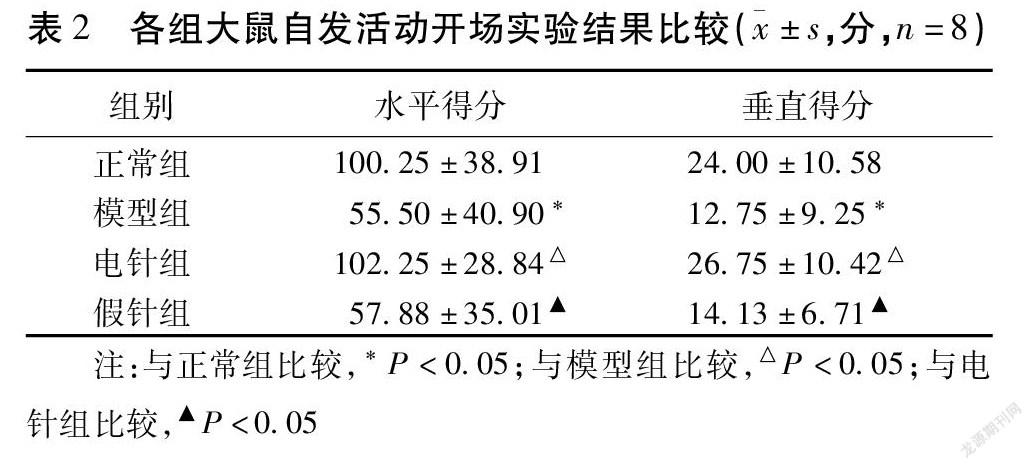
摘要 目的:觀察“心脑同调”法电针对焦虑模型大鼠行为学及血清心房利钠肽(ANP)、促肾上腺皮质激素释放激素(CRH)、皮质酮(CORT)含量的影响,探讨针刺治疗焦虑障碍的效应及部分作用机制。方法:32只SD大鼠随机分为正常组、模型组、电针组和假针组,每组8只,制备焦虑大鼠模型。15 d后,采用高架十字迷宫实验与自发活动开场实验测试大鼠行为学变化,酶联免疫吸附试验法检测血清ANP、CRH、CORT的含量。结果:与正常组比较,模型组大鼠进入开臂次数百分比(OE%)、开臂停留时间百分比(OT%)明显降低(均P<0.01),水平得分、垂直得分明显下降(均P<0.05),血清ANP、CRH、CORT含量显著升高(均P<0.01);与模型组比较,电针组OE%、OT%值明显升高(均P<0.01),水平得分、垂直得分明显升高(均P<0.05),血清ANP、CRH、CORT含量显著降低(均P<0.01)。结论:焦虑模型大鼠血清中ANP、CRH、CORT含量异常可能是导致其发病的机制之一;“心脑同调”法电针可能通过调节三者之间的紊乱状态而达到对焦虑障碍的治疗作用。
关键词 心脑同调;电针;焦虑模型大鼠;行为学;心房利钠肽;促肾上腺皮质激素释放激素;皮质酮
Effect of Electro-acupuncture for Simultaneous Regulation of the Brain and Heart on Behaviors and Serum-related Factors in Anxiety Model Rats
XU Lufan1,WANG Jun1,LI Shimeng2,LI Ming1,HUI Zhiyuan1,YANG Lei1
( Department of Acupuncture,Dongzhimen Hospital,Beijing University of Chinese Medicine,Beijing 100700,China; 2 Department of Ophthalmology,Dongfang Hospital,Beijing University of Chinese Medicine,Beijing 100078,China)
Abstract Objective:To observe the effect of electro-acupuncture for simultaneous regulation of the brain and heart on the behaviors and serum content of atrial natriuretic peptide(ANP),coticotropin-releasing hormone(CRH),and corticosterone(CORT) of anxiety model rats and explore the anti-anxiety mechanism.Methods:Thirty-two healthy male SD rats were randomized into normal,model,electro-acupuncture,and sham acupuncture group,with 8 in each group,and chronic unpredictable stress was used to induce anxiety in rats.After 15 days,the elevated plus maze test and open field test were carried out to observe the behavioral changes of rats with anxiety,and the serum levels of ANP,CRH,and CORT were detected by enzyme-linked immunosorbent assay(ELISA).Results:The percentage of times of entering the open arms(OE%) and percentage of time on open arms(OT%) in the elevated plus maze test were decreased(P<0.01),and the number of squares crossed and the number of rearings in the open field test were reduced(P<0.05) in the model group as compared with those in the normal group.Moreover,the serum levels of ANP,CRH,and CORT in the model group were higher than those in the normal group(P<0.01).OE% and OT% were raised(P<0.01) and the number of squares crossed and the number of rearings were increased(P<0.05) in electro-acupuncture group compared with those in the model group.The serum levels of ANP,CRH,and CORT in the electro-acupuncture group were lower than those in model group(P<0.01).Conclusion:Abnormal levels of ANP,CRH,and CORT in serum may be the cause of anxiety in rats.The electro-acupuncture for simultaneous regulation of the brain and heart might exert the therapeutic effect on anxiety by modulating the levels of the three.63C49FE8-8837-41A6-9F96-3E0F71BC7209
Keywords Simultaneous regulation of the brain and heart; Electro-acupuncture; Anxiety model rats; Ethology; ANP; CRH; CORT
中图分类号:R245;R277.7文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.05.018
焦虑障碍(Anxiety Disorder,AD)是一种以焦虑情绪为主要表现的神经症,常表现为无明显原因和固定内容的担心,同时伴有自主神经功能障碍[1-2]。焦虑障碍的全球发病率为7.3%[3]。2017年的调查显示,我国焦虑障碍的发病率高达4.98%,且有上升趋势[4]。目前临床治疗中,口服西药虽然一直作为治疗该病的主要手段,但其引发的不良反应影响了药物的使用。鉴于西药治疗的短板,针刺治疗焦虑障碍疗效确切,安全性高,且具有整体调节的优势[5]。本课题组前期研究表明,基于“心脑同调”理论针刺治疗焦虑障碍有显著疗效,但针刺治疗焦虑障碍的起效机制目前尚不明确[6-7]。临床研究表明[8],焦虑障碍患者存在神经内分泌功能紊乱,主要表现为下丘脑-垂体-肾上腺(Hypothalamic-Pituitary-Adrenal,HPA)轴功能亢进,促肾上腺皮质激素释放激素(Corticotropin-releasing Hormone,CRH)与皮质醇(Cortisol,CORT)作为HPA轴首末端重要激素在慢性应激过程中起重要作用。有学者研究表明,心房利钠肽(Atrial Natriuretic Polypeptide,ANP)与焦虑障碍的发病密切相关[9]。本研究从“心脑同调”角度取穴,观察电针对焦虑模型大鼠行为学及血清ANP、CRH、CORT水平的影响,探讨针刺治疗焦虑障碍的效应及可能机制,为临床治疗提供依据。
材料与方法
1. 材料
1.1. 动物 选用8周龄健康清洁级雄性SD大鼠32只,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,许可證编号:SCXK(京)2019-0010。实验室和动物房由北京中医药大学提供,室温(24±1)℃,湿度(50±1)%,12 h明暗交替环境,标准饲料喂养。所有实验程序遵循中华人民共和国科技部颁布的《关于善待实验动物的指导性意见》,均经北京中医药大学动物使用和管理委员会批准(伦理审批号:BUCM-4-2019110601-4088)。
1.1.2 试剂与仪器 华佗牌电子针疗仪(苏州医疗用品厂有限公司,型号:SDZ-IIB),毫针(北京中研太和医疗器械有限公司,规格:0.25 mm×13 mm);高架十字迷宫(上海欣软信息科技有限公司,型号:XR-XG201),自发活动开场实验箱(上海欣软信息科技有限公司,型号:XR-XZ301),酶联免疫分析仪(无锡华卫朗德仪器有限公司,型号:DR-200BS)。CRH ELISA试剂盒(批号:20191112)、CORT ELISA试剂盒(批号:20191112)、ANP ELISA试剂盒(批号:20191112)购自北京华英生物技术研究所,水合氯醛(上海源叶生物科技有限公司,批号:Z25A10Y86923)。
1.2 方法
1.2. 分组与模型制备 采用随机数字表法将32只大鼠随机分为正常组、模型组、电针组、假针组,每组8只。各组大鼠在实验前适应性饲养7 d,在此期间实验者每日抚摸大鼠2 min。参照文献,采用慢性不可预见性应激刺激法建立焦虑大鼠模型[10]。应激刺激方法包括6种:24 h禁食禁水、24 h高密度居住、30 min束缚、10 min夹尾、暖泳(3 ℃,15 min)和冷泳(18 ℃,10 min)、足底电击15 min。每日随机给予一种刺激,相同刺激不连续出现,持续15 d。正常组每日抓取,不造模,其余各组大鼠均接受应激刺激。
1.2.2 干预方法 电针组于应激刺激前 h进行电针干预。根据《实验针灸学》[11]大鼠标准穴位图谱,将大鼠用鼠套固定后,选取“百会”“风府”“神门”“内关”进行针刺。“百会”向后平刺2 mm,“风府”向后下方斜刺 mm,“神门”“内关”直刺 mm。“百会”“风府”为一组,“神门”“内关”为一组,分别连接电针治疗仪。电针参数:疏密波,强度为0.15 mA,频率为20 Hz,留针20 min。于造模当天开始治疗,隔日1次,“神门”“内关”每次取单侧穴,左右交替,持续15 d。假针组参照电针组选穴,于相应穴位旁 mm非经非穴处浅刺,不连接电针治疗仪,治疗时间与留针时间同电针组。模型组大鼠于相同时间以鼠套固定20 min,此外不做任何治疗。正常组不予以任何治疗。
1.2.3 检测指标与方法
1.2.3. 高架十字迷宫实验 各组大鼠于实验第15天,通过高架十字迷宫实验测试其焦虑水平。将大鼠置于高架十字迷宫的中央区且面向开放臂,运用Supermaze软件记录5 min内大鼠的活动情况,包括进入开臂次数(OE)、开臂停留时间(OT)、进入闭臂次数(CE)及闭臂停留时间(CT),根据上述指标计算进入开臂次数百分比(OE%):OE%=OE/(OE+CE)×100%,开臂停留时间百分比(OT%):OT%=OT/(OT+CT)×100%。每只大鼠测试前均用20%乙醇清除高架十字迷宫的残留气味。
1.2.3.2 自发活动开场实验 各组大鼠于实验第15天进行自发活动开场实验。自发活动开场实验箱为立方形敞箱,80 cm×80 cm×40 cm,将旷场箱底部划分为面积相等的25个方格。将大鼠放置于箱底部中央方格内,运用Supermaze软件记录5 min内大鼠的探究行为与运动情况。以动物穿越底面的格数(四爪均进入的方格方可记数)记录为水平运动次数,以双前肢离开箱底的直立次数(两前爪腾空或攀附箱壁)记录为垂直运动次数。每只大鼠测试前均用20%乙醇清除自发活动开场实验箱的残留气味。63C49FE8-8837-41A6-9F96-3E0F71BC7209
1.2.3.3 酶联免疫吸附试验法(ELISA)检测血清ANP、CRH、CORT含量 实验第15天造模与治疗结束后,以10%水合氯醛按350 mL/kg剂量腹腔注射麻醉各组大鼠,经腹主动脉采血,血液静置后离心(4 ℃,3 000 r/min,离心半径10 cm,离心15 min),取上清置于-80 ℃保存。采用ELISA法检测各组大鼠血清ANP、CRH和CORT含量,严格按照试剂盒说明书进行检测分析。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,计量资料数据用均数±标准差(±s)表示,对所有数据进行正态性检验及组间方差齐性检验。若均符合要求,则采用单因素方差分析,组间两两比较采用LSD、SNK法;若数据不符合正态分布或方差不齐性,则采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2. 宏观表征 正常组大鼠精神良好,毛顺有光泽,行动敏捷,饮食正常,多洗脸、梳头等修饰行为;模型组大鼠饮水迫切,大便色黑干燥,排便粒数减少,有相互撕咬行为;电针组大鼠精神渐佳,毛色光泽,饮食渐增,行动灵敏,修饰行为增多;假针组大鼠饮水增加、摄食下降、大便干燥。
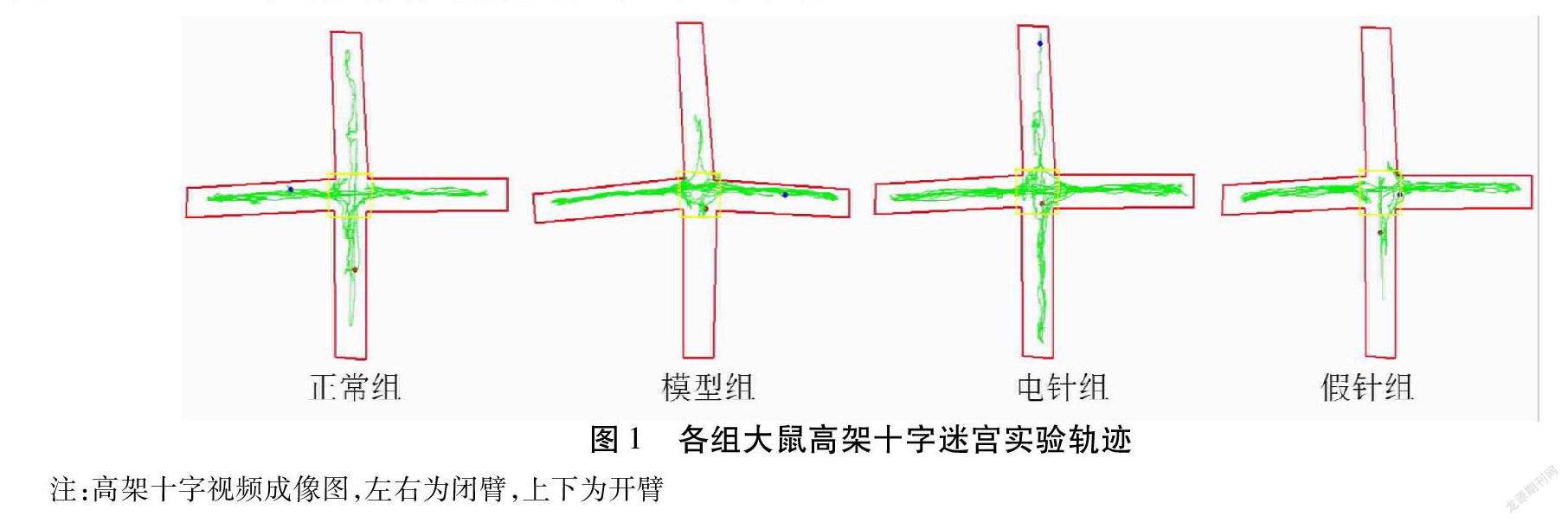
2.2 大鼠高架十字迷宫实验结果 与正常组比较,模型组大鼠进入开臂次数百分比(OE%)、开臂停留时间百分比(OT%)明显降低,差异均有统计学意义(均P<0.01);与模型组比较,电针组OE%、OT%值明显升高,差异均有统计学意义(均P<0.01),假针组OE%、OT%值有升高趋势,差异均无统计学意义(均P>0.05);与电针组比较,假针组OT%值明显降低,差异有统计学意义(P<0.01),OE%值有降低趋势,差异无统计学意义(P>0.05)。见表1,图1。
2.3 大鼠自发活动开场实验结果 与正常组比较,模型组水平得分、垂直得分明显下降,差异均有统计学意义(均P<0.05);与模型组比较,电针组水平得分、垂直得分明显升高,差异均有统计学意义(均P<0.05),假针组水平得分、垂直得分差异均无统计学意义(均P>0.05);与电针组比较,假针组水平得分、垂直得分显著降低,差异均有统计学意义(均P<0.05)。见表2,图2。
2.4 各组大鼠血清ANP、CRH、CORT含量 与正常组比较,模型组大鼠血清ANP、CRH、CORT含量显著升高,差异均有统计学意义(均P<0.01);与模型组比较,电针组大鼠血清ANP、CRH、CORT含量均显著降低,差异均有统计学意义(均P<0.01),假针组大鼠血清ANP、CRH、CORT含量差异均无统计学意义(均P>0.05);与电针组比较,假针组大鼠血清ANP、CRH、CORT含量明显升高,差异均有统计学意义(均P<0.01)。见表3。
3 讨论
中医学认为“焦虑障碍”属于“郁症”“不寐”“虚烦”等疾病范畴,多由于素体虚弱,七情内伤,或肝失疏泄,气机郁滞,或思虑过度,耗伤心神[12-13]。其病机为神机被扰,病位多涉及心、脑、肝、脾,其中又与心、脑关系尤为密切。心藏神,脑为元神之府,人的精神、情志活动由心神与脑神共同支配,若心神被扰、元神失用则会出现精神、情志方面的异常。焦虑障碍存在心脑共患的特点,“心脑同调”为本病治疗的关键[14]。本实验基于前期临床研究[6-7],选取百会、风府治“脑”,神门、内关调“心”。《灵枢·卫气》曰:“头气有街……气在头者,止之于脑。”《灵枢·海论》曰:“脑为髓之海,其输上在于其盖(百会穴),下在风府。”故治“脑”取百会、风府符合气街、四海理论。根据经络理论,风府为督脉“入脑”之穴,百会为督脉“出脑”之穴,二穴共同调节脑髓,奉养脑神。神门为手少阴心经的原穴,是心原气经过和留止之处,《灵枢·九针十二原》云:“五脏有疾也,当取之十二原。”内关为手厥阴心包经络穴,《百证赋》中提及内关有“扫尽胸中之苦闷”之效,提示心包经腧穴有治疗神志疾病的功效。二穴与心关系密切,具有宁心安神、宽胸解郁之效。
AD的发病机制目前尚不明确,受遗传和环境因素的共同影响。同时研究发现,神经内分泌功能紊乱是焦虑障碍的重要发病机制,HPA轴是经典的神经内分泌闭合环路,HPA轴的异常改变是焦虑障碍发病的关键机制之一[15]。本实验主要观察ANP、CRH、CORT在焦虑障碍发病及治疗中的可能作用。ANP及其相关受体是利钠肽系统中最为重要的组成成员。ANP在中枢神经系统中分布较为广泛,具有调节应激反应和焦虑等情绪状态的作用[9]。研究显示,焦虑障碍患者血浆ANP出现异常,认为是将心脏和焦虑行为联系起来的重要物质基础[16]。应激状态时下丘脑室旁核产生CRH,经垂体门脉系统进入垂体前叶,刺激促肾上腺皮质激素(Adrenocorticotrophic Hormone,ACTH)的释放,ACTH作用于肾上腺皮质,促进CORT的分泌,形成HPA轴而发挥生物学作用[17]。CORT作用广泛,其中之一就有发挥免疫抑制作用。研究表明,应激过程中,CORT分泌增多是应激性免疫抑制的主要原因。目前研究发现,血清ANP升高可能通过促进肾上腺髓质的肾上腺细胞释放儿茶酚胺,使CORT的释放增多,导致HPA轴功能亢进,引起焦虑的发生[18]。
慢性应激可引起大鼠行为学变化,高架十字迷宫实验和自发活动开场实验是动物焦虑行为学研究中较为经典的测试。高架十字迷宫实验用于焦虑程度的评估,大鼠穿梭开放臂的频次及时间的所占百分比表达了大鼠的焦虑状态存在与否及其水平高低,大鼠穿梭开放臂以及闭合臂的总频次则表达出鼠科动物在运动方面具备的能力高低。结果表明,模型组大鼠OE%和OT%值显著降低,表现出明显的焦虑行为,而“心脑同调”法电针显著提高焦虑大鼠的OE%和OT%值,明显改善大鼠的焦虑行为,且优于假针组。自发活动开场实验用于评估啮齿类动物的自发活动与探究行为,结果表明,焦虑模型大鼠水平得分与垂直得分显著降低,自发活动与探究行为明显受到抑制。“心脑同调”法电针显著增加大鼠的自发活动与探究行为,且效果明显优于假针组。通过以上行为学评价结果证实本实验造模成功,“心脑同调”法电针对焦虑大鼠行为学有较好的干预调节效應。63C49FE8-8837-41A6-9F96-3E0F71BC7209
在應激条件下,机体通过改变HPA轴各个层面激素的表达,维持机体内稳态。下丘脑室旁核分泌CRH,刺激垂体前叶释放ACTH,ACTH通过体循环到达肾上腺,刺激肾上腺皮质合成并释放CORT,从而形成一个完整的HPA轴系统[17]。在正常情况下,CORT对HPA轴有负反馈调节作用[19]。在慢性应激条件下,CRH分泌过多,导致ACTH、CORT过量释放,过量的CORT不能有效抑制HPA轴的活性,HPA轴负反馈调节失常,CRH、ACTH、CORT持续升高,表现为HPA轴功能持续亢进,最终导致焦虑的发生[20]。临床研究发现,广泛性焦虑障碍患者的血浆CORT水平显著升高,且CORT水平与焦虑严重程度正相关[21];创伤后应激障碍焦虑患者血浆CRH水平明显升高[22]。各种应激诱导的焦虑动物模型也表现出明显的HPA轴功能紊乱。研究显示,慢性不可预见性应激条件下,大鼠表现出明显焦虑行为,血浆CRH、CORT水平显著提高,HPA轴功能亢进[23]。近年来,有学者发现,ANP可通过调节HPA轴的活动影响焦虑行为[24]。Raha等[25]通过实验发现,ANP可促进肾上腺髓质儿茶酚胺的释放,从而提高CORT水平。有实验发现,焦虑大鼠血浆ANP、CORT水平异常升高,而肾上腺皮质利钠肽受体A的表达无异常改变,提示ANP并非直接作用于肾上腺皮质刺激CORT的释放[18],进一步验证了Raha等[25]的实验结果。因此,过高的血清ANP可能通过促进肾上腺髓质的肾上腺细胞释放儿茶酚胺,使CORT的释放增多,导致HPA轴功能亢进,引起焦虑的发生。
本实验研究结果提示,焦虑模型大鼠血清ANP、CRH、CORT呈高水平表达,这与相关报道一致[18,21-23,25]。而“心脑同调”法电针可调节这一紊乱状态,且电针组调节效果明显优于假针组。其作用机制可能是通过纠正血清ANP紊乱,继而影响CORT与CRH的释放,抑制HPA轴亢进,从而发挥抗焦虑效应。
综上所述,焦虑模型大鼠血清中ANP、CRH、CORT水平异常可能是导致焦虑模型大鼠发病的机制之一,“心脑同调”法电针可能通过调节三者之间的紊乱状态而达到对焦虑障碍的治疗作用。本研究为基于“心脑同调”理论针刺抗焦虑的机制研究提供了依据,但本研究结论仍须进一步的临床及实验研究加以验证。
参考文献
[1]Faludi G,Gonda X,Dme P.An update on the conceptual and classification issues of anxiety,its neuroanatomy and problems of anxiolytic drug discovery[J].Neuropsychopharmacol Hung,2015,17(2):69-80.
[2]Alladin A.The wounded self:new approach to understanding and treating anxiety disorders[J].Am J Clin Hypn,2014,56(4):368-388.
[3]Malan-Müller S,Hemmings SM,Seedat S.Big effects of small RNAs:a review of microRNAs in anxiety[J].Mol Neurobiol,2013,47(2):726-739.
[4]李婧婷.针刺对慢性束缚应激焦虑模型小鼠海马及mPFC中炎性因子表达的影响[D].北京:北京中医药大学,2019.
[5]黄文琴,周奇志,刘旭光,等.针刺对焦虑大鼠血浆及胸腺T细胞亚群的影响[J].针刺研究,2015,40(4):265-269.
[6]刘鑫.基于“心脑同治”理论针刺治疗广泛性焦虑障碍的临床疗效观察[D].北京:北京中医药大学,2019.
[7]刘然.电针从“心、脑”论治中风后焦虑障碍的临床研究[D].北京:北京中医药大学,2018.
[8]Vreeburg SA,Zitman FG,van Pelt J,et al.Salivary cortisol levels in persons with and without different anxiety disorders[J].Psychosom Med,2010,72(4):340-347.
[9]田华,余曙光,蔡定均,等.焦虑障碍与利钠肽-HPA轴的关系[J].四川生理科学杂志,2013,35(3):123-126.
[10]Bondi CO,Rodriguez G,Gould GG,et al.Chronic unpredictable stress induces a cognitive deficit and anxiety-like behavior in rats that is prevented by chronic antidepressant drug treatment[J].Neuropsychopharmacology,2008,33(2):320-331.
[11]张露芬.实验针灸学[M].北京:化学工业出版社,2010:219.
[12]张镭潇,周思远,郑倩华等.针刺治疗失眠伴焦虑情绪的临床随机对照研究[J].世界中医药,2018,13(7):1570-1574.
[13]赵子珺,赵瑞珍,张媛等.颐脑解郁方对缺血性脑卒中及卒中后抑郁、焦虑、痴呆大鼠宏观表征变化的干预作用[J].世界中医药,2018,13(12):3085-3094.
[14]赵振海,陈晟,常静玲,等.辨“心、脑”治疗卒中后焦虑障碍针灸取穴思路探讨[J].中国针灸,2017,37(8):883-885.63C49FE8-8837-41A6-9F96-3E0F71BC7209
[15]魏京金,张承舜,周奇志,等.焦虑障碍的催产素-HPA轴异常及针刺干预机理探析[J].成都中医药大学学报,2015,38(4):102-105.
[16]姚弘,魏大能,蔡定均,等.针刺对慢性情绪应激焦虑大鼠肾上腺ANP、CNP及血浆CORT水平的影响[J].中国针灸,2016,36(2):169-174.
[17]Pariante CM,Lightman SL.The HPA axis in major depression:classical theories and new developments[J].Trends Neurosci,2008,31(9):464-468.
[18]魏大能,張承舜,吕鹏,等.针刺对慢性情绪应激焦虑大鼠血浆ANP、CORT和肾上腺ANP受体的影响[J].辽宁中医杂志,2017,44(5):1074-1077,后插5.
[19]Thiagarajah AS,Eades LE,Thomas PR,et al.GILZ:Glitzing up our understanding of the glucocorticoid receptor in psychopathology[J].Brain Res,2014,1574:60-69.
[20]贾宝辉,李志刚,时宇静,等.电针对慢性应激模型大鼠行为学及HPA轴相关激素的影响[J].针刺研究,2004,29(4):252-256.
[21]周田田,陆晓姿,牛娟,等.广泛性焦虑障碍病人心理健康水平与血浆皮质醇关系[J].齐鲁医学杂志,2015,30(1):62-63,66.
[22]de Kloet CS,Vermetten E,Geuze E,et al.Elevated plasma corticotrophin-releasing hormone levels in veterans with posttraumatic stress disorder[J].Prog Brain Res,2008,167:287-291.
[23]杨建飞,王红,郑祖艳.头皮丛刺对焦虑模型大鼠HPA轴CRH、ACTH作用及分子机制研究[J].针灸临床杂志,2018,34(10):55-58.
[24]Wiedemann K,Jahn H,Yassouridis A,et al.Anxiolyticlike effects of atrial natriuretic peptide on cholecystokinin tetrapeptide-induced panic attacks:preliminary findings[J].Arch Gen Psychiatry,2001,58(4):371-377.
[25]Raha D,Tortorella C,Neri G,et al.Atrial natriuretic peptide enhances cortisol secretion from guinea-pig adrenal gland:evidence for an indirect paracrine mechanism probably involving the local release of medullary catecholamines[J].Int J Mol Med,2006,17(4):633-636.
(2020-06-11收稿 本文编辑:王明)63C49FE8-8837-41A6-9F96-3E0F71BC7209

