直接抗病毒药物治疗丙型肝炎失败的影响因素分析
杨宇晴, 尚 佳, 卢诚震, 杨 松, 陈宏宇, 潘家莉, 韩一凡, 席宏丽, 亢 倩, 谭 宁, 徐小元
北京大学第一医院 感染疾病科, 北京 100034
HCV感染是慢性肝病最常见的病因之一,可能导致肝衰竭、肝硬化和肝癌,是重大的全球公共卫生问题。据世界卫生组织估计,2015年全球有7100万人有慢性HCV感染,39.9万人死于HCV感染引起的肝硬化或肝细胞癌。以往的标准治疗是聚乙二醇干扰素(PEG-IFN)联合利巴韦林(RBV)(PR方案),随着直接作用抗病毒药物(direct antiviral agents, DAA)的上市,传统的PR方案逐渐被DAA取代。目前, DAA是治疗HCV感染的推荐药物,其在已知主要基因型和主要基因亚型的 HCV 感染者中都能达到 90% 以上的持续病毒学应答(sustained virological response, SVR)[1]。然而,还有少量HCV感染者出现DAA治疗失败,包括病毒学突破和复发。本研究选取的DAA治疗失败患者主要是治疗结束时血液中检测不到 HCV RNA,但在治疗结束后HCV RNA复阳患者,从基线临床资料和基因测序寻找耐药相关替代突变(resistance-associated substitution, RAS)两个方面与治疗成功的HCV感染者进行比较,旨在分析DAA治疗丙型肝炎失败的影响因素。
1 资料与方法
1.1 研究对象 选取2019年11月—2021年10月来自多个中心的慢性丙型肝炎(CHC)DAA初治失败的患者13例为治疗失败组,所有患者均为经过12周完整疗程DAA治疗,治疗结束时HCV RNA阴性,但治疗结束后HCV RNA转为阳性的患者。患者开始治疗时间从2017年11月到2021年7月不等,血清HCV RNA复阳时间从2018年3月到2022年1月不等。选取2017年12月—2020年5月在北京大学第一医院感染疾病科门诊就诊的 51例DAA治疗成功的CHC患者作为对照组,均为初治患者[2]。所有患者的CHC诊断均符合我国《丙型肝炎防治指南(2019年版)》[1]。排除标准:(1)临床资料大量缺失的患者;(2)未收集治疗后HCV RNA阳性血清样本,或血清样本出现明显溶血或污染的患者;(3)合并其他病毒感染者,如HBV、HIV等。
1.2 观察指标 收集患者全部的临床资料,包括患者性别、年龄、治疗前的基因分型(采用PCR测序法)、治疗失败使用的药物及疗程、治疗失败时的采血日期、血清HCV RNA定量、一些常见血液及生化指标等,将治疗失败和治疗成功的患者基线资料进行对比和统计学分析。收集治疗失败患者HCV RNA复阳血清样本和治疗成功患者基线血清样本进行HCV RNA提取、逆转录、PCR扩增NS3/NS5A/NS5B三个片段,然后进行Sanger测序,获得峰图。
1.3 实验设计 根据QIAamp Viral RNA Mini Kit(德国,Qiagen公司)试剂盒的说明书进行患者血清病毒RNA的提取。使用RevertAid First Strand cDNA Synthesis Kit(美国,ThermoFisher公司)进行RNA的逆转录PCR,所有操作均使用一次性耗材,并在冰上进行。参照既往文献设计引物,引物由北京六合华大基因科技有限公司合成,将逆转录后得到的cDNA进行巢式PCR扩增,扩增产物用1%琼脂糖凝胶进行电泳鉴定。阳性扩增产物送至北京六合华大基因科技有限公司进行Sanger测序,以AJ238799.1作为参考序列,用Vector NTI Suite 9.0软件对序列信息进行比对分析,并提交HCV耐药数据库(http://hcv.bioinf.mpi-inf.mpg.de/index.php)进行分析。
1.4 统计学方法 采用 SPSS 21.0 软件进行统计分析。非正态分布的计量资料以M(P25~P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验,进行单因素和多因素logistic回归分析计算比值比(OR)并分析治疗失败的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 治疗失败组一般资料 DAA治疗失败组共纳入13例患者,13例患者中仅1例患者合并慢性肾脏病(CKD)3期,其他患者均无合并疾病。13例患者中有12例有完整疗程资料,全部于用药结束后1年内复发,其中3例于1个月内复发,2例于2个月内复发,2例于3个月内复发,2例于6个月内3个月后复发,3例于12个月内6个月后复发。5例男性患者中有4例于3个月内复发,1例于3个月后复发,7例女性患者中有3例于3个月内复发,4例于3个月后复发, HCV RNA是否在3个月内复阳与患者性别无关(P=0.198)。收集到基因型数据的患者共12例,其中5例为1b型,3例为2a型,4例为3b型。3b型患者均为丙通沙(索磷布韦维帕他韦片,SOF/VEL)治疗失败,2a型患者中1例为丙通沙治疗失败,2例为丙通沙合并利巴韦林(RBV)治疗失败。1b型患者中,丙通沙、择必达(艾尔巴韦格拉瑞韦片,EBR/GZR)、仿制药(化学名称未知)治疗失败均为1例,2例为百立泽/速维普方案[盐酸达拉他韦(DAC)片联合阿舒瑞韦(ASV)软胶囊]。3b或2a型患者治疗失败可能与应用丙通沙密切相关,而1b型治疗失败患者则存在多种用药方案可能。此外,经过统计分析,男性治疗失败患者的基线TBil、DBil、Cr普遍高于女性(P值均<0.05)(表1)。

表1 治疗失败患者性别与部分生化指标的关系
2.2 两组患者间的临床资料对比 将治疗失败组和对照组丙型肝炎患者基线临床资料进行对比(表2),两组之间年龄、基因型差异均有统计学意义(P值均<0.05)。将它们纳入logistic回归模型(表3)显示,年龄55岁及以下、基因型为3b型患者DAA初治失败的风险增加(P值均<0.05)。

表2 治疗失败组与对照组患者基线特征对比
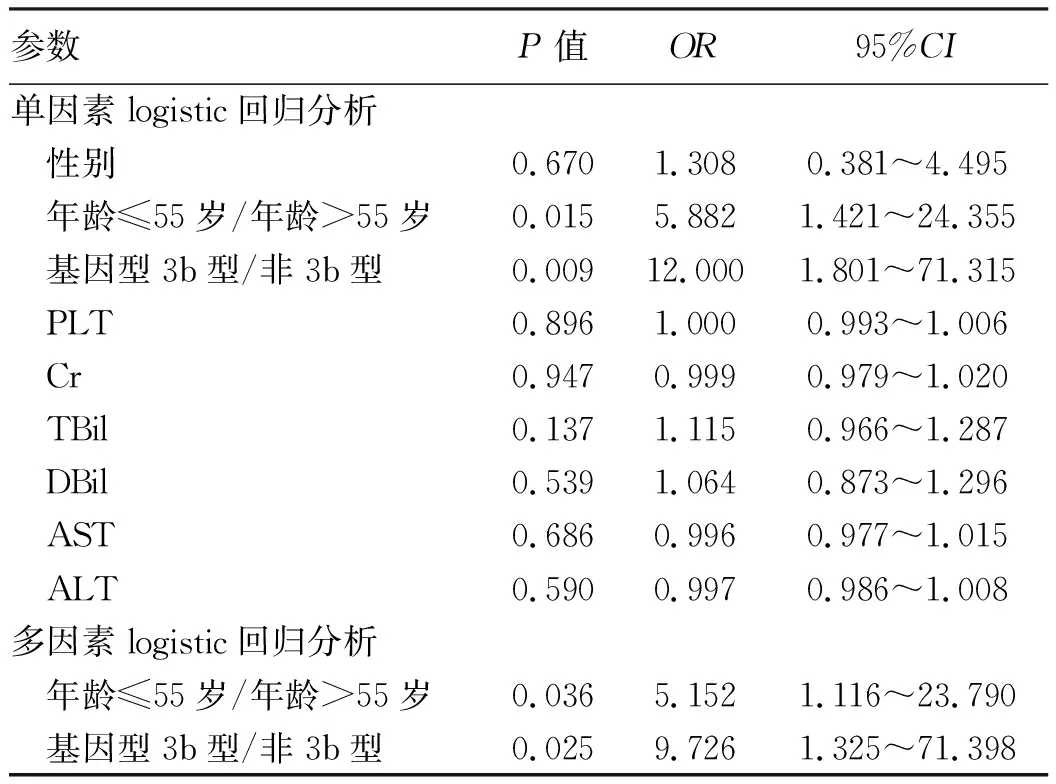
表3 基线logistic回归分析DAA初治失败的独立影响因素
2.3 治疗失败患者的基因测序结果及对比 分别获得NS3、NS5A及NS5B区基因序列各3、5、5例,各RAS分布情况见表4。5例扩增得到目的基因片段的患者中4例为1b型,可能是由于设计引物的参考序列AJ238799.1为基因1b型HCV全长基因组序列[3]。3例NS3基因片段共有的RAS是A66G和F147S,5例NS5A基因片段共有的RAS是Q24/K26/L34V,5例NS5B基因片段共有的RAS是Q47L/R98K/Q127L/A218S,均不是3种基因片段上的常见RAS。

表4 治疗失败组RAS分布情况
2.4 两组患者耐药情况对比 根据既往研究[4],NS3基因片段上的RAS主要为Y56F、Q80K、S122G、V170I;NS5A基因片段上的RAS主要为R30Q、P32A、P58S、Y93H;NS5B基因片段上的RAS主要为C316N、C451H及I585C。51例治疗成功患者共获取NS3、NS5A、NS5B区基因序列各39、38、38例。其主要的RAS发生率与5例治疗失败患者的对比见图1。由图可知,治疗成功患者NS3区最常见的RAS是S122G,发生率为71.79%,其次是V170I,发生率为38.46%;NS5A区最常见的RAS是Y93H,发生率为21.05%,其次是R30Q,发生率为10.53%;NS5B区的RAS主要是C316N,发生率为71.05%。3例治疗失败患者NS3基因片段中1例检测到S122G,2例检测到V170I,而Q80K和Y56F均未检测到,3例共有的A66G和F147S在51例治疗成功患者中未出现;5例治疗失败患者NS5A基因片段中4例检测到Y93H,3例检测到R30Q,而P32A和P58S均未检测到,5例共有的Q24/K26/L34V在51例治疗成功患者中未出现;5例治疗失败患者NS5B基因片段中C316N、C451H和I585C均未检测到,5例共有的Q47L/R98K/Q127L/A218S在51例治疗成功患者中未出现。
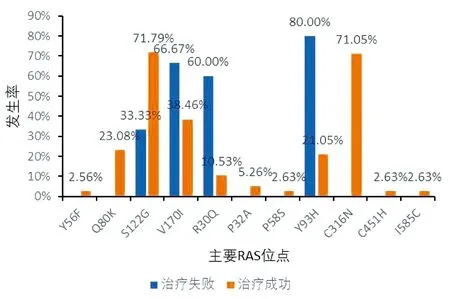
图1 RAS的发生率对比
3 讨论
根据既往文献资料[5],与DAA治疗失败相关的因素包括用药方案和疗程的选择、耐药情况(主要是NS5A RAS)、基因型、疾病进展(如肝纤维化)等。本研究结果显示,DAA治疗失败导致的HCV RNA复阳一般出现在治疗结束后1年之内,男性患者的基线TBil、DBil、Cr普遍高于女性,可能提示肝脏疾病进展情况,包括肝纤维化、肝硬化或肝脏肿瘤可能加速DAA治疗失败的发生。4例3b型患者均为丙通沙治疗失败。丙通沙是我国最为常用的泛基因型DAA,参考2019年版《丙型肝炎防治指南》[1],以我国人群为主的亚洲临床试验结果显示,丙通沙治疗 12 周,在基因 1a 型、1b 型、2 型、3a型、3b 型和 6型的 SVR12 率分别为 100%、100%、100%、95%、76%和99%,即丙通沙针对3b型患者的SVR12率明显下降。基因1b型患者由于可应用的治疗方案较多,不同方案均可能导致治疗失败,HCV RNA复阳。
将治疗失败与治疗成功两类人群进行对比, 进一步说明年龄和基因型与DAA的治疗成功率密切相关,3b型患者由于治疗方案选择不当、自身疾病进展等多种原因更易出现治疗失败的情况。丙通沙在以我国人群为主的亚洲临床试验结果显示,丙通沙对于基因3b型患者的SVR12率为76%,而肝硬化患者的SVR12率仅为50%,远低于整体的SVR率[6]。本研究还发现患者年龄也可能是DAA治疗失败相关的危险因素,年龄在55岁以下的人群治疗失败的风险更高,此结论需扩大样本量后进一步得到验证。
既往研究[7]表明,RAS 的发生和类型取决于病毒的基因型和药物。与其他基因型相比,RAS在基因型1a和3型中更常见[8]。它可能因暴露于DAA治疗而出现,也可能存在于未接受DAA治疗的患者中。本研究中治疗失败与成功的RAS有明显的区别,可能是不同的DAA与病毒核酸之间的相互作用,使RAS发生了变化。
择必达的有效成分包括艾尔巴韦和格拉瑞韦。艾尔巴韦治疗失败最常见的RAS是GT1b中的Y93H和L31F/M/V,其中L31M+Y93H可显著降低艾尔巴韦对于GT1b患者的疗效(降低5000倍)。与格拉瑞韦治疗失败有关的常见NS3 RAS是V36L/M、Y56F/H、Q80K/L、R155I/K/L/S、A156G/M/T/V、V158A和D168A/C/E/G/K/N/V/Y,主要存在于GT1a型中,也可存在于GT1b型中[9]。丙通沙的有效成分是索磷布韦和维帕他韦。RAS S282T与索磷布韦治疗失败有关,但在含索磷布韦方案治疗失败患者中很少发现(<4%),可能是因为它的适应性较低,可检测到的时间段较短。有研究[10]表明L159F(+C316N/L320F)可能影响GT1和GT3型患者索磷布韦治疗失败,其中L159F+C316N主要在GT1b型患者中检测到,而L159F+V321A仅在GT1a和GT3型患者中检测到。与维帕他韦治疗失败相关的NS5A RAS涉及位置24、28、30、31、32、58、92和93,最常检测到的RAS是Q30E/H/K/L/R、M28T/V, GT1b中的Y93C/H/N/S/T和L31M/V,GT2中的L31I/M/V和Y93H,GT3中的A30K/V、E92K、Y93H/N/R和L31M/P/V,天然NS5A RAS可导致GT3患者SVR12率降低,其中基线时有Y93H的患者SVR率更低[11]。与达拉他韦治疗失败有关的RAS包括GT1b中的Y93C/H/I/R和L31F/M/V,GT3中的L31I、Y93H和A30K。Y93H也是达拉他韦治疗失败的常见RAS,且在各种基因型中都可以检测到[12]。
本研究中择必达治疗失败患者存在L31F+Y93H降低艾尔巴韦疗效,但也检测到其他RAS如NS3的V48I/151A/170I、A66G/150V、F147S等。丙通沙联合利巴韦林治疗失败患者未检测出影响索磷布韦的常见RAS,检测到影响维帕他韦的常见RAS包括Q24和R30Q,但也检测到其他RAS如L34V/37F/199V、V138L/153L/164P/174T/196T等。2例达拉他韦联合阿舒瑞韦治疗失败患者分别检测出影响达拉他韦的L31V+Y93H和L31M+Y93H,但也检测到其他RAS如Q24、K26、L34V、T83M、H85C/S、V164A/174T、K166R等。目前已知的针对不同DAA的RAS中,本研究检测出了部分,如针对维帕他韦和艾尔巴韦的31M/93H,针对达拉他韦的30Q/31M/93H等[10,13-15],而其他检测出的RAS对于DAA有哪些影响,需要后续进一步深入探索。
综上,DAA治疗失败一般出现在治疗结束后1年之内,男性患者可能伴随更严重的肝脏疾病进展。年龄在55岁以下和基因3b型患者治疗失败风险更高。由于药物可能改变突变位点,突变位点也可能影响药物疗效,治疗成功人群的治疗前常见RAS和治疗失败后人群的有明显区别,对后续治疗方案的制定提供了思路。本研究存在一定的局限性,纳入的总样本数量较少,治疗失败的患者相对有限,仅有5例治疗失败患者测定出RAS,且没有3b型治疗失败患者的血清成功检测出RAS,使3b型患者治疗失败原因的讨论无法在基因水平展开。上述统计学推论是否正确,以及RAS与DAA的相互作用对于临床决策的帮助,还等待进一步的探索发现。
伦理学声明:本研究方案于2017年9月13日经由北京大学第一医院生物医学研究伦理委员会审批,批号: (2017)科研第(02)号。血清样本的采集和临床资料的收集均获得患者知情同意。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:杨宇晴负责课题设计,样本收集,资料分析,撰写论文;尚佳、卢诚震、杨松参与样本收集;陈宏宇参与资料分析;潘家莉、韩一凡、席宏丽参与样本处理;亢倩、谭宁参与论文修改;徐小元负责拟定写作思路,指导撰写文章并最后定稿。

