慢性乙型肝炎患者骨量减少/骨质疏松的危险因素及CT值的诊断价值
张静怡, 唐映梅, 李嘉琦, 王 倩, 张宸瑞
昆明医科大学第二附属医院 a.消化内科, b.放射科, 昆明 650000
全世界慢性HBV感染者约2.75亿人[1],慢性乙型肝炎(CHB)患者的老龄化日益突出,骨质疏松成为该类患者中常见的并发症。有研究[2]报道,慢性肝病患者骨质疏松的患病率为12%~55%,病毒性肝炎患者患病率为20%~55%。CHB患者合并的骨量减少、骨质疏松可发生在肝炎、肝硬化、肝癌等疾病进展的整个病程中,常因严重的骨痛、骨折等影响患者的预后和生活质量。
目前诊断骨质疏松的金标准为双能X线骨密度测定(dual-energy X-ray bone densitometry,DXA)[3],但CHB患者常需完善腹部CT检查观察肝脏形态,了解有无肝硬化、及时发现占位性病变[4],因此对这类患者进行额外DXA检查筛查骨量减少、骨质疏松难以实施,不仅增加了患者的经济负担,并且在一定程度上增加了患者射线暴露风险。利用患者定期复查腹部CT的腰椎CT值粗略筛查骨量减少/骨质疏松的发生,具有更好的实用性。有研究[5]显示慢性肝病患者肌少症发病率增加,患者肌少症和骨质疏松发病之间联系紧密。因此,利用腹部CT图像,可同时进一步评估患者的肌肉情况,对肌少症可较直接的判断。对CHB患者是否合并骨量减少/骨质疏松、肌肉减少做到早发现、早诊断、早治疗,提高CHB患者的生活质量。
1 资料与方法
1.1 研究对象 回顾性纳入2019年1月—2020年12月在本院就诊的CHB患者112例。纳入标准:(1)诊断符合2019年慢性乙型肝炎防治指南[4];(2)本次住院期间完善了腹部CT检查,并且部分患者同时完善了DXA骨密度检查;(3)患者年龄≥50岁。排除标准:(1)排除合并其他(甲、丙、丁、戊型)肝炎病毒感染;(2)排除合并代谢相关性肝病、自身免疫性肝病、布加综合征等其他肝病的患者;(3)排除合并肾病、甲状腺疾病等影响骨代谢疾病的患者;(4)排除长期应用糖皮质激素,近期使用过影响骨代谢药物的患者。
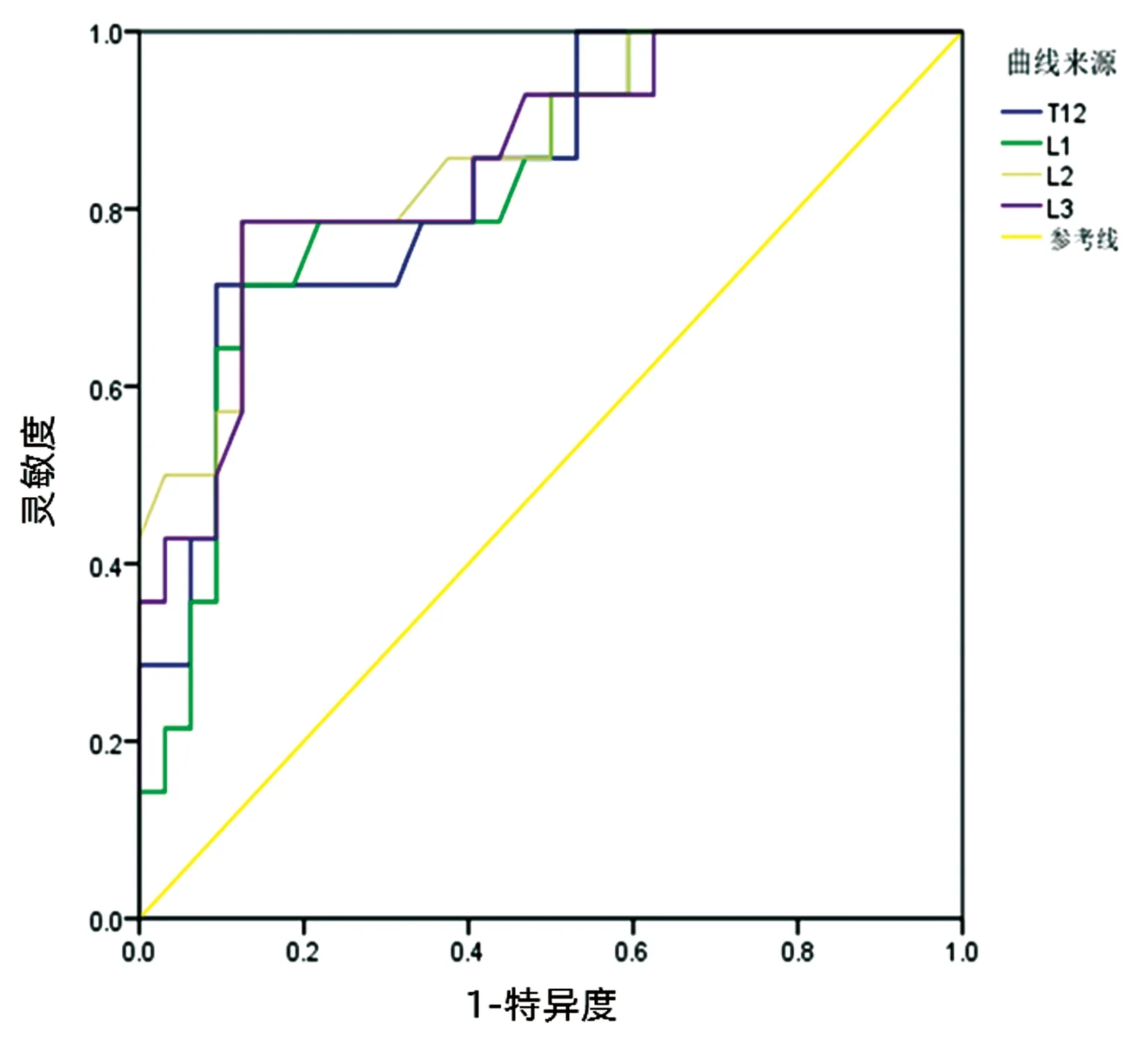
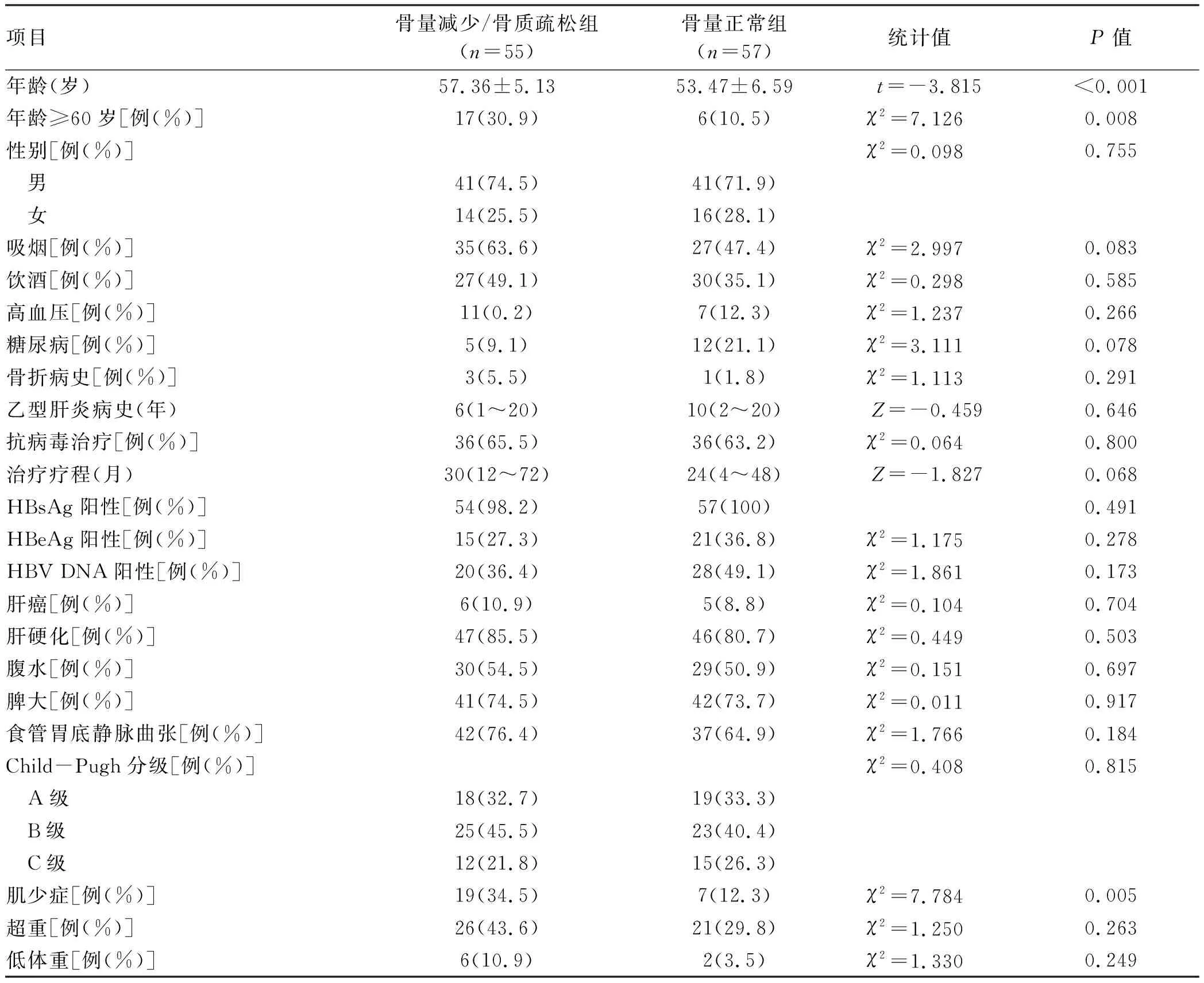
1.2 DXA骨密度测定 应用美国GE LUNAR公司生产的GE Health care13.31型号的双能X线骨密度仪,由专业医师测量CHB患者L1~L4椎体骨密度值,计算T-score评分。DXA诊断骨质疏松采用世界卫生组织推荐标准(2004版)[3]:L1~L4椎体T-score≥1.0 SD为正常;-2.5 SD 1.3 多层螺旋CT扫描患者椎体CT值测定 西门子256排螺旋CT机对CHB患者进行腹部CT扫描检查后(管电压120 kV,管电流250 mA,矩阵512×512,层厚1.5 mm,层间距1.5 mm),使用阅片软件系统测定患者T12~L3椎体CT值。测量椎体CT值采用3区法[6],即在同一椎体中选择椎体的三层轴位,分别是上终板的下一层、椎体中间层、下终板的上一层,避开皮质骨、局部骨质增生区、退变结构以及后方的静脉丛,分别得出3个层面尽可能大的椭圆形ROI的HU值,进而得出每个椎体的平均HU值(图1、2)。 注:a,椎体上终板的下一层;b,椎体中间层;c,下终板的上一层。 注:a,椎体上终板的下一层;b,椎体中间层;c,下终板的上一层。 1.4 多层螺旋CT扫描患者L3层面骨骼肌面积测定 西门子256排螺旋CT机对CHB患者进行腹部CT扫描检查后,使用SliceOmatic(V5.0 Rev-9)图像处理软件,在L3层面测量CT值介于-29 HU至+150 HU的骨骼肌组织面积(包含腰大肌、竖脊肌、腰方肌、腹内斜肌、腹外斜肌、腹横肌),即为L3骨骼肌面积(L3-SMA)(图3)。根据L3-SMA计算L3骨骼肌指数(L3-SMI),L3-SMI(cm2/m2)=L3-SMA(cm2)/身高2(m2)。日本肝病协会推荐的肌少症诊断标准为:男性<42 cm2/m2,女性<38 cm2/m2[7]。 图3 在L3层面测量骨骼肌组织面积 1.5 营养情况监测及分组 收集患者入院时测得的身高、体质量信息,计算患者的BMI。参照《中国肥胖和控制蓝皮书》[8]标准,低体重:BMI<18.5 kg/m2,超重:BMI≥24 kg/m2。 1.6 临床资料收集 通过查阅本院电子病历系统收集纳入本研究患者住院期间相关临床资料,包括人口学指标(年龄、性别、身高、体质量)、病毒学指标(HBsAg、HBeAg、HBcAg、HBV DNA)、实验室生化指标(ALT、AST、ALP、GGT、白蛋白、前白蛋白、TBil、TC、TG、PT、APTT、INR、PLT、肌酐)、影像学结果(DXA、腹部CT、腹水B超)、既往史(病史、是否抗病毒治疗、抗病毒治疗疗程、吸烟史、饮酒史、既往骨折病史)等。 2.1 腹部CT和DXA检查的CHB患者T12~L3椎体CT值与L1~L4椎体T-score值相关性分析 46例CHB患者在同次住院中完善了胸部CT和DXA骨密度测定,其中男33例,女13例,平均年龄(55.57±6.79)岁。T12~L1椎体的CT值与L1~L4椎体T-score值均存在显著正相关(rT12=0.694,rL1=0.661,rL2=0.781,rL3=0.685,P值均<0.001)。 2.2 T12~L3椎体CT值诊断CHB患者骨量减少/骨质疏松的ROC曲线分析 以DXA检查椎体T-score值诊断骨量减少/骨质疏松结果为金标准,利用ROC曲线分析T12~L3椎体CT值诊断患者骨量减少/骨质疏松的ROC曲线下面积(AUC),最大约登指数所对应的灵敏度、特异度及诊断临界值(表1,图4)。其中L2椎体AUC最大(0.781),最大约登指数(0.661)所对应的灵敏度为78.6%,特异度为87.5%,阳性预测值为73.3%,阴性预测值为90.3%,诊断界值为137 HU。经Kappa一致性检验,DXA、L2椎体CT值在诊断患者骨量减少/骨质疏松时一致性好(K=0.648,P<0.001)。 表1 患者T12~L3椎体CT值(cut-off值)诊断患者骨量减少/骨质疏松的ROC曲线分析 图4 患者T12~L3椎体CT值诊断患者骨量减少/骨质疏松的ROC曲线 2.3 以L2椎体CT值诊断患者骨量减少/骨质疏松与骨量正常 以患者腹部CT图像中L2椎体CT值137 HU为诊断界值,CT值<137 HU诊断为骨量减少/骨质疏松组,CT值≥137 HU为骨量正常组。对比两组患者的临床特征,包括人口学特征(年龄、性别、BMI),既往史(吸烟史、饮酒史、高血压病史、糖尿病病史、骨折病史、乙型肝炎病史、抗病毒治疗史)、病毒学指标(HBsAg阳性率、HBeAg阳性率、HBV DNA阳性率),影像学结果(肝癌、肝硬化、腹水、脾大、食管胃底静脉曲张、肌少症发生率),Child-Pugh分级,生化指标(ALT、AST、ALP、GGT、TBil、白蛋白、前白蛋白、eGFR、TC、TG、PT、APTT、INR、血小板)。结果显示,112例CHB患者中,骨量正常的患者有57例,骨量减少/骨质疏松的患者55例。骨量减少/骨质疏松组患者年龄高于骨量正常组患者,差异有统计学意义(P<0.001)。骨量减少/骨质疏松组患者肌少症发生率在欧美诊断标准和日本诊断标准下,均明显高于骨质疏松组患者(P<0.05)。其他指标方面,差异均无统计学意义(P值均>0.05)(表2、3)。 表2 骨量减少/骨质疏松组、骨量正常组CHB患者临床特征比较 表3 骨量减少/骨质疏松组、骨量正常组CHB患者生化指标比较 2.4 相关因素与CHB合并骨量减少/骨质疏松患者的多因素二元logistic回归分析 以CHB患者是否合并骨量减少/骨质疏松为因变量,将上述单因素分析有统计学意义的(P<0.05)的变量(年龄、合并肌少症)为自变量纳入方程,进行二元logistic回归分析。结果显示,年龄增加、合并肌少症均是CHB患者发生骨量减少/骨质疏松的独立危险因素,年龄每增长1岁,CHB患者发生骨量减少/骨质疏松的风险增加1.108倍[比值比(OR)=1.108,95%CI:1.026~1.196,P=0.009];合并肌少症较不合并的CHB患者发生骨量减少/骨质疏松的风险增加2.788倍(OR=2.788,95%CI:1.009~7.707,P=0.048)。 骨量减少、骨质疏松可见于CHB患者的肝脏炎症、肝硬化、肝癌、肝衰竭的各个时期。CHB患者发生骨量减少/骨质疏松是骨形成和骨转化的失衡,其主要机制有:(1)HBV引起的免疫和炎性反应[9],成骨细胞的抑制和破骨细胞的异常激活[10];(2)肝硬化患者下丘脑-垂体-性腺轴功能下降[11];(3)肝硬化肠道微生态的改变对骨代谢的影响[12];(4)核苷(酸)类似物等抗病毒药物的使用[13]。 慢性HBV感染者常需完善腹部CT检查辅助评估疾病进展情况。研究[14]显示,美国每年胸腹部CT检查超过5000万人次。腹部CT中腰椎椎体骨松质CT值与DXA检查的测量值之间具有较好的相关性,能较好的识别骨量减少和骨质疏松。目前我国指南多推荐采用DXA检查结果作为诊断骨质疏松的金标准,但DXA是利用平面投影技术,测量时包括了椎体皮质骨、松质骨以及椎体前后方结构等所有X线投射过程中所遇到的矿物质成分,因此,对于存在腰椎退行性变的患者会使DXA的测量值假性升高,导致骨质疏松的漏诊率较高。利用肝病患者定期复查的CT进行腰椎椎体骨松质CT值的测定,避开了骨皮脂区、局部骨质增生区和退变结构,在一定程度上可避免高估患者的骨密度[15]。此外,利用患者病情需要定期复查的腹部CT扫描图像,在评估患者肝脏疾病的同时,可一并评估患者脊椎骨质情况,腹部肌肉、脂肪情况,有助于对肝病患者骨质疏松、营养状况及肌少症的评估。Lee等[16]的研究提示腹部CT中,L1~L4椎体CT值与DXA检查的T值具有较好相关性(rL1=0.637,rL2=0.794,rL3=0.766,rL4=0.731,P<0.001)。本研究结果显示CHB患者的T12~L3椎体CT值与L1~L4椎体T-score值具有显著相关性(rT12=0.694,rL1=0.661,rL2=0.781,rL3=0.685,P值均<0.001),L2椎体AUC最大,为0.863,当以137 HU为诊断骨量减少/骨质疏松的界值时,最大约登指数为0.661,诊断的灵敏度为78.6%,特异度为87.5%,与DXA的诊断结果具有较好的一致性(K=0.648,P<0.001)。与上述其他研究结果相似。 肌少症是一种与年龄相关的全身肌量减少或肌强度下降或肌肉生理功能减退导致的身体活动性下降的一种退行性疾病[17-18]。原发性肌少症与年龄增长有关,继发性肌少症多见于肝病、肝硬化患者中,常见于低营养和高代谢状态引起。肝硬化患者继发性肌少症的发生率为22%~70%,常导致患者活动能力、生活质量下降,严重影响患者预后[19]。肌肉质量的评估方法包含人体测量法、DXA、CT、MRI、超声、生物电阻抗测量分析法。CT横断面扫描后,利用不同组织CT值进行定量分析肌肉成分,被认为是测定肌肉质量的金标准。多项研究[20-21]显示,利用CT测量得到的骨骼肌指数是评估肌少症的最佳影像学方法。 本研究结果显示,CHB患者中,除年龄(OR=1.108,95%CI:1.026~1.196)因素外,合并肌少症(OR=2.788,95%CI:1.009~7.707)亦是发生骨质疏松的独立危险因素。这与肌肉-骨骼系统之间可以通过机械、化学、遗传、内分泌等因素相互影响,两者存在共同的发病机制有关。CHB患者炎症因子释放引发的炎症反应、肝功能受损、低营养状态、活动量减少等都可以通过以上途径促使“肌少-骨质疏松症”的发生[22]。 既往研究[23]认为,乙型肝炎肝硬化患者较易发生骨质疏松,但近来越来越多的研究显示,在CHB非肝硬化的患者中,骨质疏松发生率也明显增加[24],可能与长期使用核苷(酸)类似物抗病毒治疗的肾损害,以及HBV复制活跃引起的免疫反应、炎症等因素介导有关。在本研究中,肝硬化与非肝硬化患者骨质疏松发生率差别不大,但本研究中纳入的非肝硬化患者样本量过少,可能存在一定的选择偏倚,未来需要纳入更大的样本进行验证。 综上所述,高龄、合并肌少症是CHB患者发生骨质疏松的独立危险因素。利用患者为评估肝脏疾病进展定期随访的腹部CT图像,可以广泛筛查骨量减少/骨质疏松的高危人群,同时准确评估患者是否合并肌少症,为患者制订更佳合理的治疗方案,避免了额外检查的射线辐射与费用,值得临床医师在临床中推广。 伦理学声明:本研究方案于2020年7月15日经由昆明医科大学第二附属医院伦理委员会批准,批号:审-PJ-2020-56。所有研究对象均知情同意。 利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。 作者贡献声明:张静怡负责课题设计,资料分析,拟定写作思路,撰写论文;李嘉琦、王倩、张宸瑞参与收集及分析数据;唐映梅负责指导撰写文章,修改论文并最后定稿。



2 结果


3 讨论

