中晚期肝细胞癌靶向联合免疫治疗进展
刘秀峰, 张 珏, 姚 琳, 杨朝旭
东部战区总医院秦淮医疗区 肝胆肿瘤内科, 南京 210002
根据GLOBOCAN最新公布的数据,2020年全球肝细胞癌(HCC)的年新发病例数达到90.6万,位居恶性肿瘤发病率第6位,死亡83.0万,位居恶性肿瘤死亡率第3位。我国人口仅占全球的18.4%,但HCC年新发病例却达到41.0万,死亡39.1万,分别占全球的45.3%和47.1%[1]。我国HCC患者临床确诊时大部分已届病程的中晚期,5年总生存率仅12.1%。少部分获得外科根治的病例,其术后5年复发率亦高达70%左右[2-3]。针对中晚期HCC,近年来系统治疗取得了长足进步,靶向联合免疫治疗的体系逐步建立,国内外指南和共识都已作为优先推荐[4-6],系列优化组合方案以及方案前移的临床研究正在开展[7]。但是必须强调的是,机遇与挑战并存,临床上尚有许多未被满足的需求,特别是针对我国HCC患者,规范化、标准化、精准化、个体化诊疗之路仍然漫长。本文针对靶向联合免疫治疗在中晚期HCC中的应用相关热点问题进行梳理,以期为临床研究和实践提供参考。
1 靶免治疗之优化组合
1.1 目前获批组合的评价 目前已获批准中晚期HCC系统治疗适应证的靶向药物包括:索拉非尼[8-9]、仑伐替尼[10]、多纳非尼[11]、瑞戈非尼[12]、阿帕替尼[13]、卡博替尼(我国未获批)[14]以及抗血管生成的单克隆抗体贝伐珠单抗[15]和雷莫芦单抗(我国未获批)[16],获批的免疫检查点抑制剂(immune checkpoint inhibitors, ICI)包括阿替利珠单抗[15]、纳武利尤单抗(我国未获批)[17]、帕博利珠单抗[18]、卡瑞利珠单抗[19]、信迪利单抗[20]、替雷利珠单抗[21]和伊匹木单抗(我国未获批)[22]。指南和共识一致优先推荐的方案为程序性死亡受体1(programmed death receptor 1,PD-1)/程序性死亡受体-配体1(programmed death receptor-ligand,PD-L1)单抗联合抗血管生成药物,包括“T+A”组合、“双达”组合、“双艾”组合、“可乐”组合等。
“T+A”组合来源于IMbrave 150研究[15],这是一项随机对照、开放标签的国际多中心Ⅲ期临床研究,共纳入501例既往未接受过系统性治疗的不可切除的HCC患者,按照2∶1随机接受阿替利珠单抗和贝伐珠单抗联合治疗或索拉非尼单药治疗。最终的生存数据[23]显示,阿替利珠单抗联合贝伐珠单抗相对索拉非尼显著延长了总生存期(overall survival,OS)(19.2个月 vs 13.4个月,HR=0.66,95%CI:0.52~0.85,P=0.0009)和无进展生存期(progress free survival,PFS)(6.9个月 vs 4.3个月,HR=0.65,95%CI:0.53~0.81,P=0.0001),按mRECIST标准确认的客观缓解率(objective response rate,ORR)为33%;在我国人群中(194例),联合治疗组对OS的延长更为明显(24.0个月 vs 11.4个月,HR=0.53)。2020年10月28日,“T+A”组合在我国获批用于既往未接受过全身治疗、不可切除的HCC患者的一线治疗。
“双达”组合源自ORIENT-32 研究[20],这是一项开放标签、随机对照的Ⅲ期临床研究,共纳入571例未经系统治疗的不可切除的中国HCC患者,按照 2∶1随机接受信迪利单抗(达伯舒)联合贝伐珠单抗生物类似物(达攸同)或索拉非尼单药治疗。入组人群中94.5%是HBV相关HCC,65%以上曾经接受过经肝动脉化疗栓塞术治疗。结果联合组的OS显著优于索拉非尼组,OS在联合组未达到,索拉非尼组为10.4个月(HR=0.57,95%CI:0.43~0.75,P<0.000 1);联合组的PFS也显著优于索拉非尼,分别为4.5个月和2.8个月(HR=0.56,95%CI:0.46~0.70,P<0.000 1);按照RECIST v1.1 标准评估,“双达”组合的ORR为21%。2021年6月25日,该联合方案在我国获批用于不可切除或转移性HCC的一线治疗。
获批的两项Ⅲ期临床研究均为PD-1/PD-L1单抗联合贝伐珠单抗(或其类似物),尤其ORIENT-32 研究入组人群一般状况评分更差,HBV感染、肝外转移以及AFP≥400 ng/mL的比例明显更高,提示病毒性肝炎相关HCC是免疫联合治疗的优势人群(IMbrave150研究非乙非丙HCC亚组靶免组合无效)。在随后的随访期间,部分联合组的患者甚至接受了转化治疗,部分索拉非尼组的患者接受了后续PD-1/PD-L1的治疗,进一步印证了靶免联合的持续效应。
1.2 正在进行组合的预测 IMbrave150和ORIENT-32研究的成功为靶免联合治疗在HCC中的应用开启了希望之门,诸多相关Ⅲ期临床研究正在紧锣密鼓地进行之中,这其中包括帕博利珠单抗联合仑伐替尼—LEAP 002研究、阿替利珠单抗联合卡博替尼—COSMIC 312研究、卡瑞利珠单抗联合阿帕替尼研究、派安普利单抗联合安罗替尼研究等(“免免”联合不在本文讨论之列)。与获批适应证的前述研究不同的是,正在进行的靶免联合研究组合的是小分子酪氨酸激酶抑制剂(TKI)。这些小分子TKI在晚期HCC中的免疫联合治疗中是否可以等效于抗血管生成的单克隆抗体不得而知。从各自的Ⅰb/Ⅱ期临床研究数据分析,ORR范围为24%~46%,预设着Ⅲ期临床研究的阳性结果。
LEAP-002研究缘起KEYNOTE-524[24](帕博利珠单抗联合仑伐替尼的Ⅰb期研究), 在可评估的100例患者中,按照mRECIST标准评价,ORR达到了46.0%,中位缓解时间为1.9个月,中位PFS为9.3个月,中位OS高达22.0个月。仑伐替尼+帕博利珠单抗对比仑伐替尼+安慰剂作为晚期HCC患者一线治疗的安全性和疗效的Ⅲ期临床研究——LEAP-002(NCT03713593)已经完成患者入组,即将公布结果。本研究特点是一项双盲、安慰剂对照、1∶1随机的Ⅲ期研究,同时排除了门静脉主干癌栓,设定了双主要终点(PFS和OS),启动于2018年12月31日,历时3年时间,索拉非尼第一次消失在HCC一线治疗临床研究的舞台,试图证明“可乐”组合优效于仑伐替尼。值得关注的是,2021年年底的ESMO ASIA会议上公布了COSMIC-312研究[25]的结果,阿替利珠单抗联合卡博替尼对比索拉非尼PFS显著改善(6.8个月 vs 4.2个月,HR=0.63,P=0.0012),OS未达到统计学意义的改善(15.4个月 vs 15.5个月,HR=0.90,P=0.438)。从COSMIC-312的结果分析,一路“高奏凯歌”的靶免联合治疗如何从II期研究的“惊艳数据”转化为III期注册研究的阳性结果值得业界推敲,如何设计临床研究终点、如何纳入靶免联合治疗的优势人群、如何平衡后续治疗对结局的影响同样值得业界广泛关注。LEAP-002、卡瑞利珠单抗联合阿帕替尼(入组结束)、派安普利单抗联合安罗替尼的研究结果不得而知,但靶免联合治疗在中晚期HCC中应用的临床实践毋庸置疑,东西方肝癌免疫微环境的差异也毋庸置疑,实现真正意义上的差异化临床研究设计势在必行[26]。
2 靶免治疗之评估体系建立
2.1 影像组学评估体系 众所周知,指南推荐HCC可以有临床诊断标准[3],即:既往有肝病背景,AFP≥400 ng/mL,且影像学显示肝脏占位在动脉期快速不均质血管强化,而静脉期或延迟期快速洗脱,则可以临床诊断为原发性肝癌,无需进一步获取病理组织学标本。随着靶免治疗在HCC临床研究和临床实践中的广泛应用,影像学不仅仅作为一种诊断标准,在疗效评估和随访体系中也发挥着重要作用,目前的诸多临床研究采用了RECIST v1.1和mRECIST标准[27]。作为客观疗效的评价标准,靶病灶单径的变化显然不能涵盖靶免治疗的真实场景,mRECIST标准捕获了5%左右被RECIST v1.1标准误判为临床不获益的病例。mRECIST标准诞生于2010年代,影像学参数是否可以在免疫联合治疗之前预测获益人群,值得业界探索。
图1中病例1为45岁男性,MRI显示S6段33 mm×28 mm占位,轻-中度T2高信号(b),T1WI对比剂前呈低信号(a),动脉晚期强化(c),门静脉期廓清(d),肝胆期显示肿瘤边缘不规则、瘤周低信号区域(e);图1中病例2为35岁男性,MRI显示S5/6段一个106 mm×73 mm占位,T2项低密度和坏死(b),T1WI对比剂前呈低信号(a),动脉晚期强化(c),门静脉期廓清(d),肝胆期显示肿瘤边缘不规则、瘤周低信号区域明显(e)。两例患者均经手术根治性切除,病理提示低分化HCC,PD-L1表达阳性,但CD8+T淋巴细胞浸润方面存在差异(病例1为阴性,病例2为阳性)。肝胆对比剂影像学检查初衷是鉴别诊断,但是相应的参数似乎有免疫微环境特征的提示意义[28]。针对上述病例,如何选择免疫辅助治疗方案目前没有定论,如果仅凭传统的大体病理提供的高危因素似乎不够完善。目前ICI已经在辅助治疗阶段布局(CheckMate 9Dx、KEYNOTE-937、IMbrave 050、EMERALD 2等[7]),但尚未见报道免疫辅助治疗的优势人群,是否可以从术前的功能影像学参数中得到提示值得关注。2021年美国临床肿瘤学会年会上,Kudo教授团队[29]初步报告了NIVOLVE研究(一项HCC切除或消融术后纳武利尤单抗辅助治疗的Ⅱ期前瞻性多中心单臂临床研究)的数据,结果显示WNT/β-catenin相关基因的突变或活化、Foxp3+T淋巴细胞的存在和CD8+肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)数量下降提示辅助治疗的无复发生存负相关。辅助治疗阶段初步数据对中晚期HCC的靶免治疗以及转化治疗具有重要参考价值,应用功能影像组学探索中晚期HCC靶免联合治疗的优势人群以及随访靶免联合治疗过程中免疫微环境的变化将是未来临床研究的重要补充,目前国内已有相关回顾性研究[30-31]报道,值得密切关注,从而不断提高功能影像组学评价体系在靶免治疗HCC领域的循证医学证据等级。
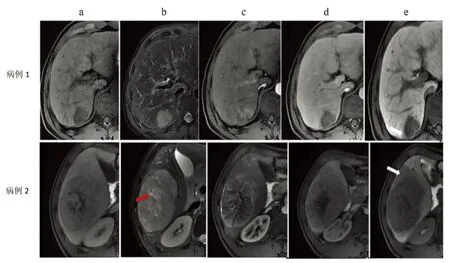
图1 典型HCC的肝胆对比剂增强MRI特征影像学表现
2.2 病理学评估体系 靶免治疗的病理学评估是转化治疗考量的重要参数,病理学完全缓解或部分缓解目前参照的标准仍然是2003年的Miller-Payne分级系统[32]。Miller-Payne分级系统分为G1(浸润癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少);G2(浸润癌细胞轻度减少,但总数量仍高,癌细胞减少不超过30%);G3(浸润癌细胞减少介于30%~90%);G4(浸润癌细胞显着减少超过90%,仅残存散在的小簇状癌细胞或单个癌细胞)和G5(原肿瘤瘤床部位已无浸润癌细胞,但可存在导管原位癌)共5个级别。而基于免疫治疗的病理学分级标准需要涵盖免疫治疗的特征,这显然有别于传统细胞毒药物为主的化疗。
靶免治疗获益人群组织的修复、免疫活化状态以及肿瘤细胞的清除显示出的病理学特征包括:TIL浸润、新生血管和纤维组织增生、三级淋巴样结构、浆细胞浸润、巨噬细胞泡沫化、胆固醇裂隙和TIL浸润等。剩余活性肿瘤的计算方法如图2[33],左图是传统化疗的算法,右图是免疫治疗的算法。主要区别是免疫治疗后瘤床的退缩,如果未见退缩,两种算法一致;反之,化疗不能转化为免疫治疗。国外学者针对免疫治疗提出了免疫相关病理学疗效评价标准(immune-related pathologic response criteria,irPRC)[34],并且已经有相关共识发布[35],未来需要前瞻性研究修正irPRC,考察病理学特征与预后的相关性。2021年美国癌症研究协会会议上,美国学者[36]对免疫新辅助治疗HCC的研究报道值得借鉴,该团队对免疫治疗的疗效进行了三个维度的探索,包括:影像学肿瘤大小、肿瘤坏死程度以及TIL积分的动态变化,如此布局对术后的辅助治疗决策以及复发转移的预测均有积极的预测价值,期待我国学者在HCC靶免治疗的各阶段进行积极尝试。
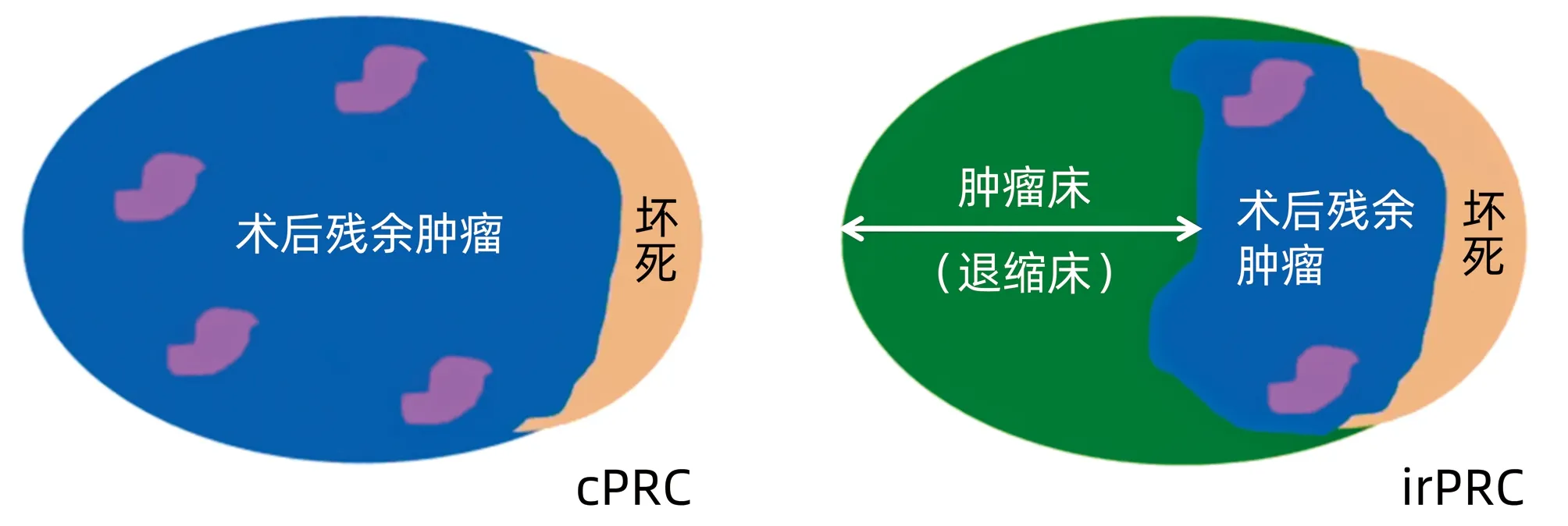
图2 化疗和免疫治疗病理学评估示意图
3 靶免治疗之发展方向
3.1 靶免治疗未来临床研究设计 中晚期HCC免疫治疗的2.0版(靶免联合)时代已经到来,多种组合方案应运而生。在疾病的不同阶段以及靶免治疗疗效评价的不同时间点,有可能介入不同的局部治疗手段,即3.0版也已经在我国HCC患者临床实践中不同程度地应用,小样本报道[37]取得了可喜的结果。目前获批的“T+A”组合和“双达”组合已经成为标准治疗(standard of care,SOC),相信不久的将来,“双艾”组合和“可乐”组合也会成为SOC。不可否认,现有的组合方案在注册临床试验设计之初对照的是索拉非尼或仑伐替尼,而当新的SOC到来之际,如何进一步开发HCC系统治疗的格局成为当下无法回避的科学问题。网络荟萃分析似乎可以评价不同SOC之间的差异[38],但不是直面问题的最佳选择。
2020年欧洲肿瘤内科学会年会上,Galle教授[39]报道了帕博利珠单抗联合瑞戈非尼一线治疗晚期肝癌1b期研究的结果更新,研究者在固定帕博利珠单抗剂量(200 mg, 1次/3周)条件下,探索瑞戈非尼的协同增效剂量,同时引用了既往早期临床研究未曾出现过的概念——最大实施剂量(maximum administrated dose, MAD)。MAD有别于传统早期临床研究中使用的最大耐受剂量(maximum tolerated dose)的概念,更注重小分子TKI如何助力免疫微环境的改善,从分子机制上协同免疫治疗的起效。近年来,业界已经普遍关注到抗血管生成治疗如何与免疫治疗产生最佳的协同作用,目前获批的小分子TKI需要在较低剂量水平才能达到逆转免疫抑制微环境的目标[40],也许这个剂量水平就是MAD。如此,如何定位不同TKI抗血管生成作用的IC50(half maximal inhibitory concentration)和EC50(concentration for 50% of maximal effect)指标成为了临床研究和实践需要特殊关注的热点。
3.2 靶免治疗时代MDT的内涵建设 按RECIST v1.1版标准的评估体系,靶免治疗后疗效评估会出现CR、PR、SD和PD 4种结局(图3),对于PR的病例需要区分持续缓解(肿瘤最大径较基线缩小>65%)和深度缓解(起效维持时间超过6个月)[41];对于PD的病例需要区分快速进展和缓慢进展、广泛进展和寡进展[42];对于SD范畴的病例,需要平衡获益和风险,区别对待缩小的SD和增大的SD。并参照免疫相关RECIST标准(irRECIST和iRECIST)[43]。当下,在HCC多学科综合诊疗(multi disciplinary team,MDT)共识的框架下[44],靶免治疗赋予了HCC系统治疗新的内涵,仅仅按照现有指南或规范推荐的诊疗路线图可能远不能满足临床需求,而中晚期HCC在靶免治疗的整个过程中,肿瘤免疫微环境的动态变化催生了MDT的动态实施,从而达到真正意义上的规范化、标准化、精准化、个体化。
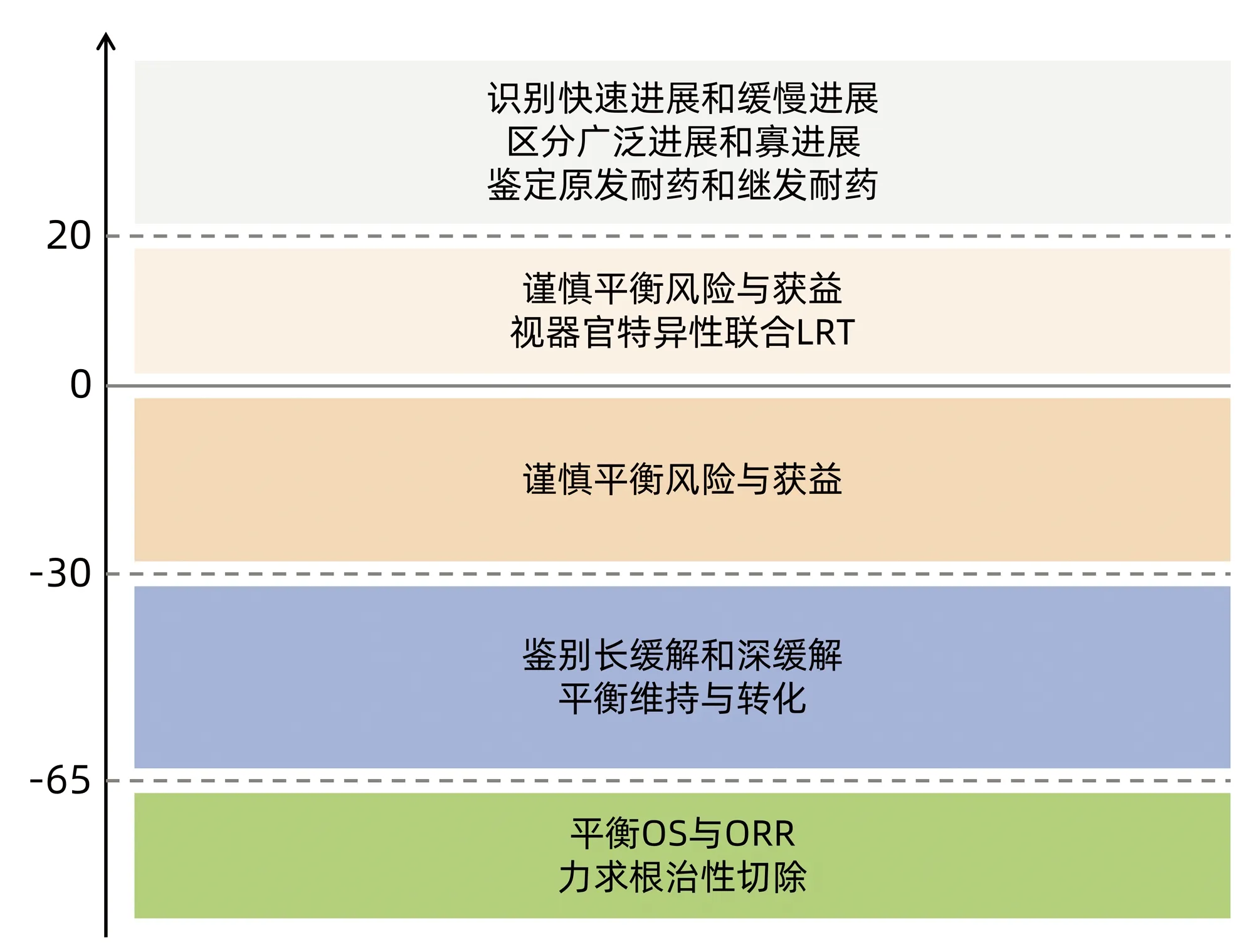
图3 靶免治疗中晚期HCC的MDT内涵建设示意图
4 小结与展望
中晚期HCC的靶免治疗具有广阔的前景,相关研究层出不穷地开展为HCC患者带来了明显的生存获益。随着我国民族企业的崛起,相关ICI的研发进入了“快车道”,加上国家医保政策的支持,靶免联合治疗的药效经济学问题迎刃而解。但是,靶免治疗尚有诸多临床未满足的需求,尤其针对我国HCC患者,如何在MDT框架下布局最优的实施方案,如何平衡疗效、耐药和毒性,如何实施从基础到临床的转化以及临床结局的转化,仍需我国学者志同道合,砥砺前行。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:刘秀峰对研究的思路有关键贡献,参与了研究数据的获取分析,并起草和修改文章关键内容;张珏、姚琳参与起草和修改文章关键内容;杨朝旭对研究的思路和设计有关键贡献。

