舒芬太尼对心肌缺血再灌注损伤大鼠心肌细胞凋亡的抑制作用及其作用机制
赵智慧, 白香花, 何金玲, 段伟琴, 刘 敏, 张生茂
(内蒙古自治区人民医院麻醉科,内蒙古 呼和浩特 010017)
随着心脏介入等各种手术治疗技术的广泛应用,使得心血管疾病治疗得到改善,但同时也造成心肌缺血再灌注损伤 (myocardial ischemiareperfusion injury,MIRI)。MIRI 是指缺血的心肌在恢复供血后,不仅心肌功能不能得到恢复,反而会造成心肌损伤加重,出现心律失常、心肌梗死和心脏舒缩功能障碍等现象[1]。MIRI 发生机制十分复杂,研究[2]表明:细胞凋亡是介导MIRI 的重要因素,通过调节相关基因的表达来减轻心肌细胞凋亡,可减轻MIRI,起到保护心肌的目的。舒芬太尼是一种阿片受体激动剂,对心肌细胞具有保护作用,可改善MIRI 造成的心肌损伤[3-4]。长链非编码RNA (long non-coding RNA, LncRNA) 在调控细胞分子功能方面的作用越来越受到关注,其在心血管疾病、肿瘤及代谢性疾病中具有关键的调控作用,并已经成为MIRI 治疗的新靶点[5]。LncRNA-肺腺癌转移相关转录因子(metastasis-associated lung adnecarcinoma transcript 1,MALAT1) 广 泛地表达于哺乳动物的正常组织和器官,对心肌损伤性疾病在内的多种疾病具有调控作用。本课题组前期研究[6]显示:舒芬太尼预处理可通过抑制LncRNA-MALAT1 延缓大鼠MIRI 进展,但其具体作用机制未进行深入探讨。细胞外信号调节蛋白激 酶(extracellular signal-modulating kinase 1/2,ERK1/2) 信号通路在MIRI 后心肌细胞凋亡过程中发挥重要作用。研究[7-8]表明:ERK1/2 信号通路的激活与MIRI 后处理及预处理的心肌保护效应有密切的关联,具有抑制心肌细胞凋亡的作用,并且LncRNA-MALAT1 可直接靶向调控ERK1/2 信号通路的活性。但舒芬太尼是否能够通过调控LncRNA-MALAT1 影响ERK1/2 信号通路活性来抑制大鼠MIRI 心肌细胞凋亡,尚未见相关报道。因此,本研究利用MIRI 体内外模型,从LncRNAMALAT1 与ERK1/2 信号通路角度探讨舒芬太尼对大鼠MIRI 心肌细胞凋亡的影响,并阐明其作用机制,为临床防治MIRI 提供新思路。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器SPF 级雄性SD 大鼠30 只,体质量(200±10)g,购于辽宁长生生物有限公司,动物生产许可证号:SCXK(辽)2019-0001。H9C2 细胞购自美国ATCC 公司。舒芬太尼购于宜昌人福药业有限责任公司,原位杂交试剂盒和寡核苷酸探针购于武汉博士德生物科技有限公司,TUNEL 试剂盒购于南京凯基生物科技有限公司,兔抗GAPDH 抗体购于美国Cell Signaling Technology(CST)公司,兔抗半胱氨酸蛋白酶-3(cysteine protease protein-3, caspase-3)、活化半胱氨酸蛋白酶-3(cleaved cysteine protease protein-3,cleaved-caspase-3)、 B 细 胞 淋 巴 瘤 2 (B cell lymphoma-2, Bcl-2)、 Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein, Bax)、 ERK1/2 和 磷 酸 化ERK1/2(phosphorylated ERK1/2,p-ERK1/2)抗体购于英国Abcam 公司,辣根过氧化物酶(HRP)标记羊抗兔二抗购于北京博奥森生物科技有限公司,MALAT1 腺相关病毒(cDNA-MALAT1)及MALAT1 过表达载体(pcDNA-MALAT1) 购于上海吉玛生物科技有限公司,全蛋白提取试剂盒和BCA 蛋白定量试剂盒购于北京碧云天生物有限公司,RNA 逆转录试剂盒购于加拿大Fermentas 公司,TransStart Top Green qPCR SuperMix 购于北京全式金生物技术有限公司,Lipofectamine 2000试剂盒购于美国Life Technologies 公司,其他试剂均为国产分析纯。Ⅸ-51 型倒置荧光显微镜(日本奥林帕斯公司),RM2135 型石蜡切片机(德国徕卡公司),MR96A 型酶标仪(深圳迈瑞公司),CHEFMapperXA 型水平核酸电泳仪和半干式蛋白转膜仪(美国Bio-Rad 公司),Midi40 型恒温培养箱(美国Thermo Scientific 公司),7500 型实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪(美国ABI 公司)。
1.2 实验动物分组和大鼠MIRI 模型制备30 只雄性SD 大鼠随机分为假手术组、模型组和舒芬太尼组,每组10 只。参照文献[6]的方法建立大鼠MIRI 模型,大鼠腹腔注射4%水合氯醛麻醉,随后四肢插入电极针记录Ⅱ导联心电图,气管切开后接呼吸机,潮气量2.5 mL,呼吸频率70~80 min。开胸后用手术线在距离左冠状动脉前降支(left anterior descending coronary artery, LAD) 根 部4 mm 处结扎,持续30 min,解开手术线,再灌注维持120 min,以心电图ST 段弓背向上抬高,结扎线远端心肌颜色苍白作为心肌缺血的标志,释放后最初苍白区域的充血反应为再灌注成功的标志。假手术组大鼠只开胸不结扎,舒芬太尼组大鼠于再灌注前10 min 于尾静脉注射舒芬太尼1 μg·kg-1,假手术组和模型组大鼠注射等体积生理盐水。所有大鼠在完成再灌注2 h 后处死。
1.3 RT-qPCR 法检测各组大鼠心肌组织中LncRNA-MALAT1 mRNA 表达水平利用Trizol法提取大鼠心肌组织总RNA,并按照试剂盒说明书合成cDNA,反应总体积为20 μL;逆转录条件:25 ℃、30 min,42 ℃、30 min,85 ℃、5 min。取2 μL cDNA 模 板,按 照RT-qPCR 扩 增 说 明 书 进 行体外扩增,反应总体积为20 μL。扩增条件:95 ℃预变性5 min;94 ℃、30 s,55 ℃、30 s,72 ℃、60 s,30 个循环;72 ℃、1 min。以U6 作为内参,LncRNA-MALAT1 上 游 引 物 序 列: 5′-GAGCGAGTGCAATTTGGTGATG-3′,下游引物序列:5′-ATCCTCTACGCACAACGCC-3′;U6 上 游 引物 序 列: 5′-TGCTGTCCCTGTATGCCTCT-3′,下 游 引 物 序 列: 5′-TTTGATGTCACGCACGATTT-3′, 采 用2-△△Ct法 计 算 目 的LncRNAMALAT1 mRNA 表达水平。
1.4 荧光探针原位杂交(fluorescencein situby hybridization,FISH)法检测各组大鼠心肌组织中LncRNA-MALAT1 表达水平心肌组织取出洗净后立即放入固定液中固定12 h 以上。组织固定完成后经梯度酒精脱水后浸蜡、包埋。石蜡经切片机切片,摊片机捞片,60 ℃烤箱烤片2 h。依次将切片放入二甲苯Ⅰ15 min→二甲苯Ⅱ15 min→无水乙醇Ⅰ5 min→无水乙醇Ⅱ5 min 进行脱水,DEPC 水浸泡。根据组织固定时间长短,切片于修复液中煮沸10 min,自然冷却。根据不同组织不同指标特性,滴加蛋白酶K(20 mg·L-1)37 ℃消化20 min,纯水冲洗后PBS 缓冲液洗5 min×3 次,滴加预杂交液,37 ℃孵育1 h;倾去预杂交液,滴加含探针MYLK-AS1 probe 杂交液,浓度8 μg·L-1,恒温箱37 ℃杂交过夜;切片滴加DAPI 染液,避光孵育8 min,冲洗后滴加抗荧光淬灭封片剂封片,切片于波长荧光显微镜(激发波长460~550 nm,发射波长590 nm)下观察并采集图像并拍照。采用Image-Pro Plus 6.0 图像分析软件进行分析,以积分光密度(integral optical density,IOD)值表示大鼠心肌组织中LncRNA-MALAT1 表达水平。
1.5 原位末端标记(TdT-mediated dUTP nick and labeling,TUNEL)法检测各组大鼠心肌细胞凋亡率石蜡切片常规脱蜡、水化后根据TUNEL 试剂盒说明书进行TUNEL 染色,显微镜观察并拍照,利用Image J 软件对照片中阳性细胞进行计数,计算细胞凋亡率。细胞凋亡率=TUNEL 阳性细胞数/DAPI 阳性细胞数×100%。
1.6 H9C2 细胞缺氧复氧损伤模型制备将H9C2细胞按照每毫升1×106个的密度接种于6 孔细胞培养板中,分为对照组、模型组、舒芬太尼组、pcDNA-MALAT1 组(MALAT1 组) 和 舒 芬 太尼+pcDNA-MALAT1 组(舒芬太尼+MALAT1组)。H9C2 细胞融合度大于80%时,将培养液更换为无菌PBS 缓冲液,在缺氧复氧培养箱(95%N2+5% CO2) 中孵育10 h,随后复氧(95% O2-5% CO2),将无菌PBS 缓冲液重新更换为完全培养液继续培养。 舒芬太尼组、 舒芬太尼+MALAT1 组 先 用10 μmol·L-1舒 芬 太 尼 孵 育2 h,随后制备缺氧复氧损伤模型。MALAT1 组、舒芬太尼+MALAT1 组首先转染pcDNA-MALAT1,24 h 后进行舒芬太尼预处理,再制备缺氧复氧损伤模型。
1.7 Western blotting 法检测各组大鼠心肌组织和H9C2 细胞中caspase-3、cleaved-caspase-3、Bax、Bcl-2、ERK1/2 及p-ERK1/2 蛋白表达水平提取心肌组织和H9C2 细胞全蛋白,使用BCA 蛋白定量试剂盒进行定量分析,加上样缓冲液,100 ℃加热10 min,变性蛋白,随后进行SDS-聚丙烯酰胺凝胶电泳(PAGE)、转膜、封闭。caspase-3、cleaved-caspase-3、 Bax、 Bcl-2、 ERK1/2、p-ERK1/2 和GAPDH 抗 体(1∶1000) 进 行 孵育,放入湿盒中,4 ℃过夜;次日,TBST 洗膜,室 温 孵 育HRP 标 记 二 抗(1∶1000) 1.5 h,TBST 洗膜,ECL 显色液显色,凝胶成像分析系统扫描,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.8 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组大鼠心肌组织和H9C2 细胞中LncRNA-MALAT1 表达水平,心肌细胞凋亡率,心肌组织和H9C2 细胞中caspase-3、 cleavedcaspase-3、Bax/Bcl-2、ERK1/2 和p-ERK1/2 蛋 白表达水平经正态性检验均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠心肌组织中LncRNA-MALAT1 mRNA 表达水平与假手术组(0.311±0.09)比较,模型组大鼠心肌组织中LncRNA-MALAT1 mRNA 表达水平(0.789±0.124)明显升高(P<0.05);与模型组比较,舒芬太尼组大鼠心肌组织中LncRNA-MALAT1 mRNA 表达水平(0.473±0.109)明显降低(P<0.05)。
2.2 各组大鼠心肌组织中LncRNA-MALAT1 表达率与假手术组(0.32%±0.04%)比较,模型组大鼠心肌组织中LncRNA-MALAT1 表达率(0.78%±0.11%)明显升高(P<0.05);与模型组比较,舒芬太尼组大鼠心肌组织中LncRNAMALAT1 表 达 率(0.51%±0.10%) 明 显 降 低(P<0.05)。见图1。
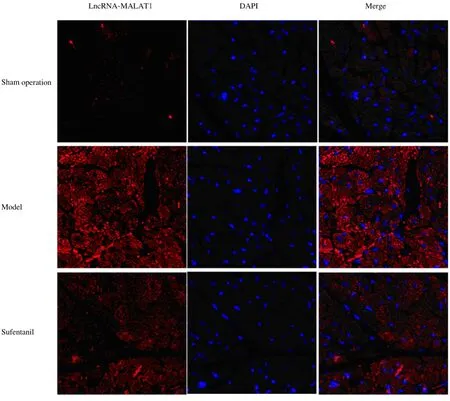
图1 FISH 法检测各组大鼠心肌组织中LncRNA-MALAT1 表达情况(×400)Fig.1 Expressions of LncRNA-MALAT1 in myocardium tissue of rats in various groups detected by FISH(×400)
2.3 各组大鼠心肌细胞凋亡率与假手术组(2.53%±0.26%)比较,模型组大鼠心肌细胞凋亡率(27.58%±4.35%) 明显升高(P<0.05);与模型组比较,舒芬太尼组大鼠心肌细胞凋亡率(15.90%±2.51%) 明 显 降 低 (P<0.05)。见图2。
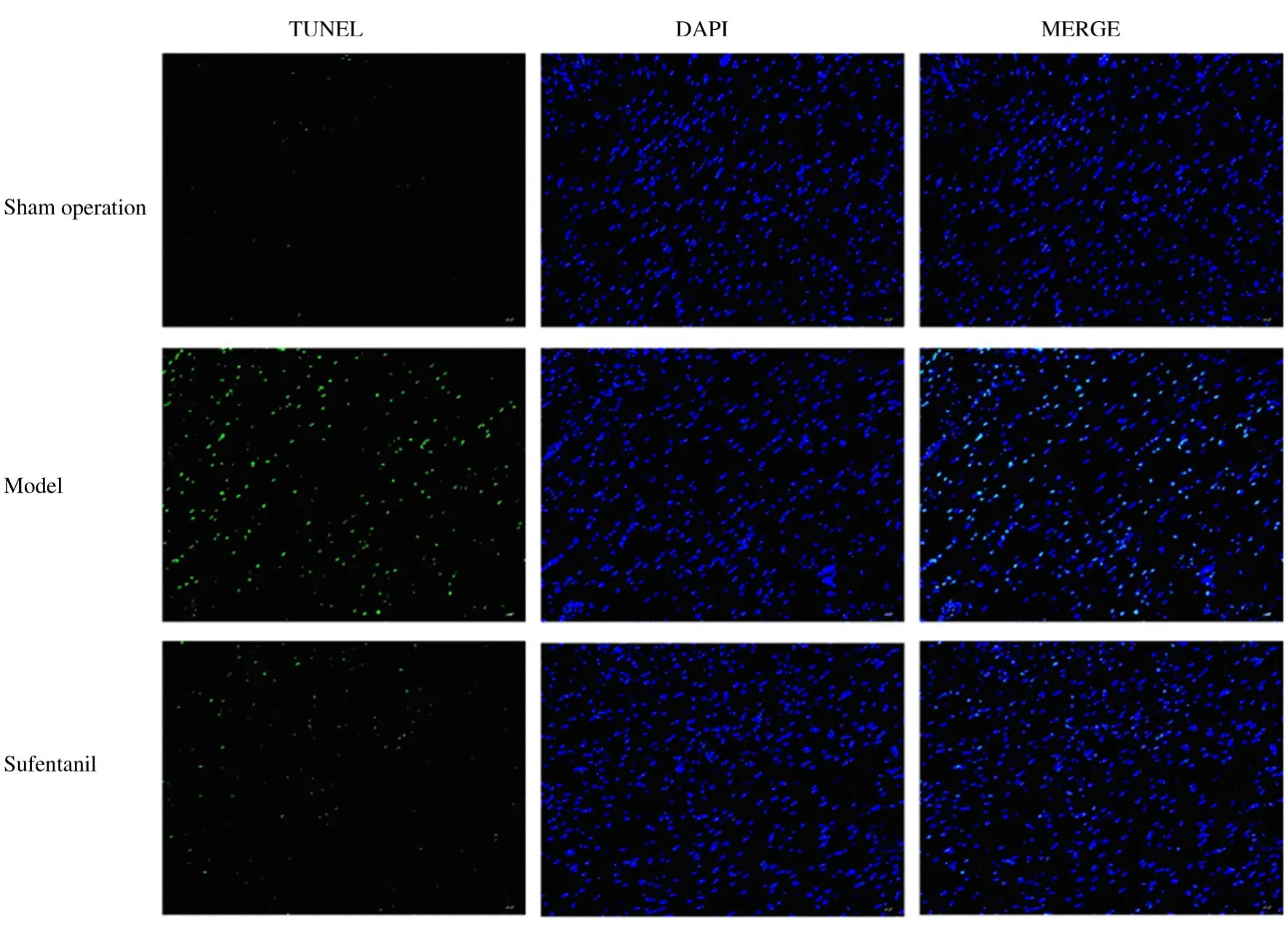
图2 TUNEL 法检测各组大鼠心肌细胞凋亡情况(×400)Fig.2 Apoptosis of cardiomyocytes in various groups detected by TUNEL method(×400)
2.4 各组大鼠心肌组织中凋亡相关蛋白表达水平与假手术组比较,模型组大鼠心肌组织中cleaved-caspase-3 蛋白表达水平和Bax/Bcl-2 比值明显升高(P<0.05);与模型组比较,舒芬太尼组大鼠心肌组织中cleaved-caspase-3 蛋白表达水平和Bax/Bcl-2 比值明显降低(P<0.05);各组大鼠心肌组织中caspase-3 蛋白表达水平比较差异无统计学意义(P>0.05)。 见图3。
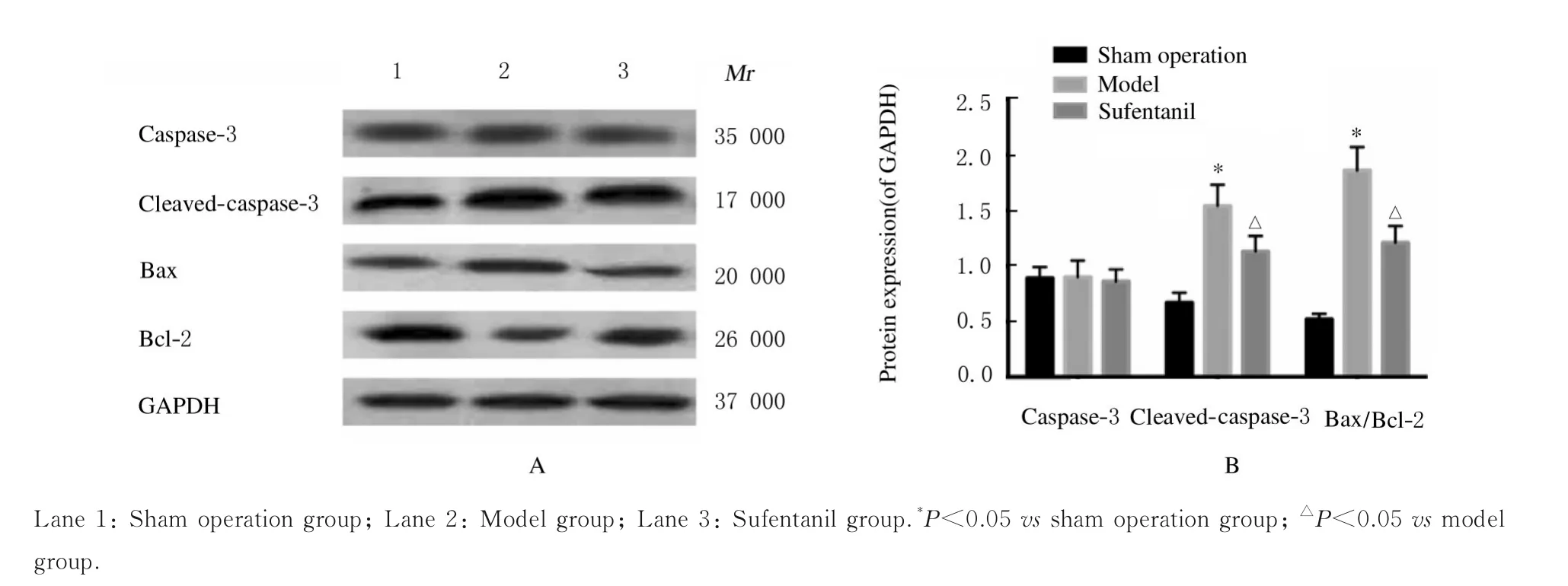
图3 Western blotting 法检测各组大鼠心肌组织中凋亡相关蛋白表达电泳图(A)和直条图(B)Fig. 3 Electrophoregram (A) and histogram (B) of expressions of apoptosis-related proteins in myocardial tissue of rats detected by Western blotting method
2.5 各组大鼠心肌组织中ERK1/2 和p-ERK1/2 蛋白表达水平与假手术组比较,模型组大鼠心肌组织中p-ERK1/2 蛋白表达水平明显降低(P<0.05);与模型组比较,舒芬太尼组大鼠心肌组织中p-ERK1/2 蛋白表达水平明显升高(P<0.05);各组大鼠心肌组织中ERK1/2 蛋白表达水平比较差异无统计学意义(P>0.05)。见图4。

图4 Western blotting 法检测各组大鼠心肌组织中ERK1/2 和p-ERK1/2 蛋白表达电泳图(A)和直条图(B)Fig. 4 Electrophoregram (A) and histogram (B) of expressions of ERK1/2 and p-ERK1/2 proteins in myocardium tissue of rats detected by Western blotting method
2.6 各组H9C2 细胞中凋亡相关蛋白表达水平与对照组比较,模型组H9C2 细胞中cleavedcaspase-3 蛋白表达水平和Bax/Bcl-2 比值明显升高(P<0.05);与模型组比较,舒芬太尼组H9C2 细胞中cleaved-caspase-3 蛋白表达水平和Bax/Bcl-2比值明显降低(P<0.05);与MALAT1 组比较,舒芬太尼+MALAT1 组H9C2 细胞中cleavedcaspase-3 蛋白表达水平和Bax/Bcl-2 比值明显降低(P<0.05);各组H9C2 细胞中caspase-3 蛋白表达水平比较差异无统计学意义(P>0.05)。见图5。
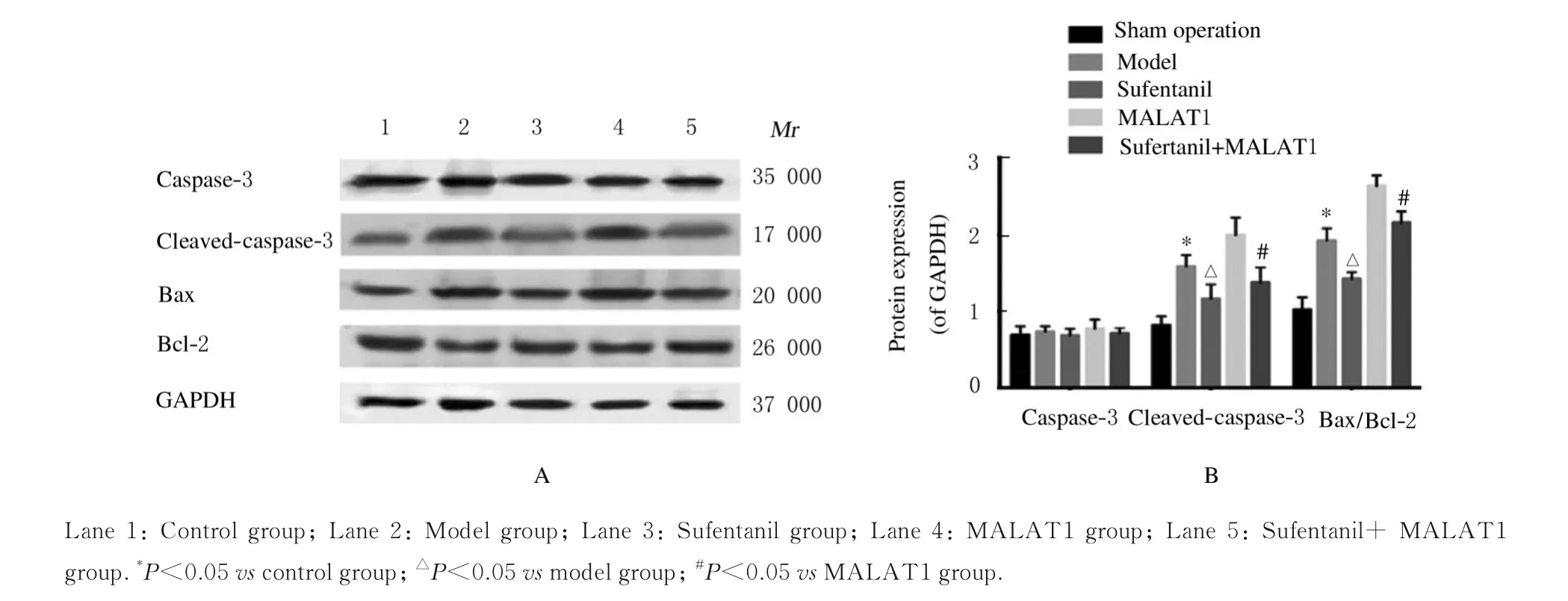
图5 Western blotting 法检测各组H9C2 细胞中凋亡相关蛋白表达电泳图(A)和直条图(B)Fig. 5 Electrophoregram (A) and histogram (B) of expressions of apoptosis-related proteins in HPC2 cells in various group detected by Western blotting method
2.7 各 组H9C2 细 胞中ERK1/2 和p-ERK1/2 蛋白表达水平与对照组比较,模型组H9C2 细胞中p-ERK1/2 蛋白表达水平明显降低(P<0.05);与模型组比较,舒芬太尼组H9C2 细胞中p-ERK1/2蛋白表达水平明显升高(P<0.05);与MALAT1组比较,舒芬太尼+MALAT1 组H9C2 细胞中p-ERK1/2 蛋白表达水平明显升高(P<0.05);各组H9C2 细胞中ERK1/2 蛋白表达水平比较差异无统计学意义(P>0.05)。见图6。
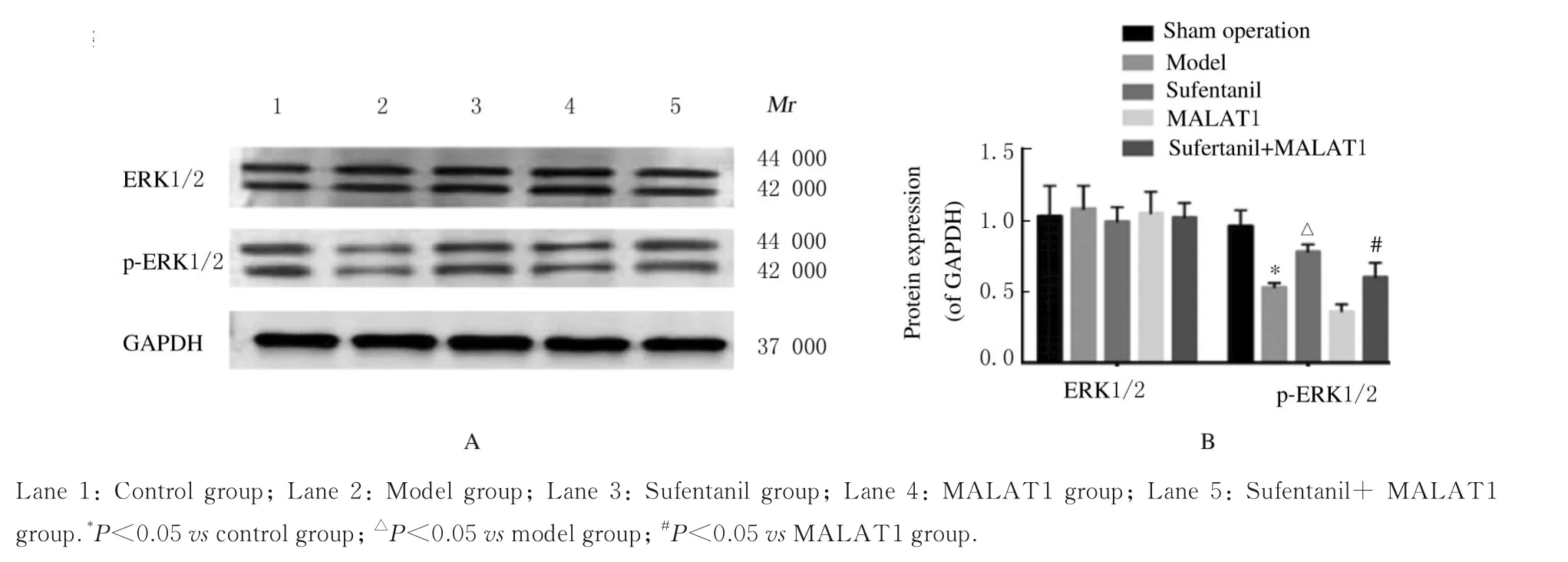
图6 Western blotting 法检测各组H9C2 细胞中ERK1/2 和p-ERK1/2 蛋白表达电泳图(A)和直条图(B)Fig. 6 Electrophoregram (A) and histogram (B) of expressions of ERK1/2 and p-ERK1/2 proteins in HPC2 cells in various groups detected by Western blotting method
3 讨论
MIRI 是指在缺血期间心肌细胞的可逆损伤,在恢复血液供应后变成不可逆损伤。本研究参照文献[9],通过结扎LAD 的方法建立大鼠MIRI 模型,具有操作简便、成功率高和模型可靠等特点。临床上,MIRI 属于较常见的心肌疾病,所涉及的机制复杂,一般认为再灌注时氧自由基增多、细胞内钙超载、线粒体损伤、心肌细胞凋亡及坏死和炎症反应等是MIRI 病理生理过程进展的重要因素[1-2]。MIRI 发展过程中伴随着基因表达的改变,研究[10-17]表明:非编码RNA 与心肌功能调节关系密切。非编码RNA 不具备编码蛋白质的能力,LncRNA 是一类长度大于200 个核苷酸单位的非编码RNA,由RNA 聚合酶Ⅱ转录合成,经RNA 剪切并经3′UTR 端修饰,不参与蛋白质的编码过程,然而研究[5-6]表明其在肿瘤发生、细胞周期调控和细胞增殖与分化等方面发挥着重要作用。LncRNA在MIRI 发生发展过程中也扮演着重要角色,KONG 等[10]发 现:LncRNA RMRP 上 调 通 过 吸 附miR-206 靶 向ATG3 表 达 而 加 重MIRI。MA 等[11]报道了LncRNA 富含转录本1 可通过自噬通量阻滞和凋亡抑制链脲佐菌素(STZ)诱导的糖尿病大鼠MIRI。HU 等[12]发 现:LncRNA OPRM1 过 表 达可通过调节OPRM1/miR-30b-5p/CSE 轴活性来增加内源性硫化氢,从而减轻大鼠MIRI。LncRNAMALAT1 最早发现于非小细胞肺癌中,其与多种肿瘤的发生与发展密切相关,LncRNA MALAT1在心血管系统疾病中亦具有调控作用[13]。RUAN 等[13]发 现: 在 MIRI 大 鼠 模 型 中,LncRNA-MALAT1 高表达, 其可通过靶向miR-26b 调节Ptgs2,从而加重炎症反应,促进MIRI 进 展。 XU 等[7]研 究 发 现: LncRNAMALAT1 可通过介导β-catenin 信号通路促进MIRI大 鼠 心 肌 细 胞 凋 亡。 ZHAO 等[14]研 究 发 现:LncRNA-MALAT1 通过负性调节miR-145/Bnip3途径消除芬太尼对MIRI 小鼠模型的心脏保护作用。SUN 等[15]研究发现:MALAT1基因敲除可显著改善I/R 诱导的大鼠心肌损伤并促进心功能,其机制可能与MALAT1 siRNA 激活AKT 信号通路有关。本研究结果显示:与假手术组比较,MIRI 大鼠心肌组织中LncRNA-MALAT1 表达水平明显升高,而经舒芬太尼处理后可明显降低MIRI 大鼠心肌组织中LncRNA-MALAT1 表达水平,与本课题组前期研究[6]结果一致。
MIRI 可引起心肌细胞凋亡,且MIRI 导致的心肌细胞凋亡是心肌损伤的重要因素之一[18]。Bcl-2家族分为抑制凋亡蛋白和促凋亡蛋白:其中Bax 是一种重要的促凋亡蛋白,其可改变线粒体膜通透性,释放细胞色素C 和凋亡诱导因子(apoptosisinducing factor, AIF),激活线粒体凋亡通路,并可下调Bcl-2 的表达,抑制其生理功能;Bcl-2 是机体重要的抑制凋亡蛋白,主要通过改变线粒体的膜通透性,阻止线粒体内的凋亡分子细胞色素C 和AIF 的释放,抑制caspase-3 活性,从而抑制细胞凋亡[19];当细胞接收到凋亡信号时,线粒体的膜通透性增加,线粒体内细胞色素C 和AIF 等促凋亡因子释放入细胞浆, 并与凋亡酶激活因子-1(apoptotic enzyme activator-1,Apaf-1)和caspase-9结合形成复合物,从而激活下游caspase-3 导致细胞凋亡[20]。本研究结果显示:与假手术组比较,MIRI 大鼠心肌细胞凋亡率、cleaved-caspase-3 蛋白表达和Bax/Bcl-2 比值明显升高;而给予舒芬太尼干预后MIRI 大鼠心肌细胞凋亡率、促凋亡蛋白cleaved-caspase-3 和Bax/Bcl-2 比值明显降低,可能是抑制了线粒体内细胞色素C 释放到细胞质中,抑制caspase-3 活性,从而抑制细胞凋亡。提示舒芬太尼对MIRI 大鼠的保护作用机制可能与抑制线粒体途径介导的心肌细胞凋亡有关。
ERK1/2 信号通路是丝裂原活性蛋白激酶(MAPK)信号通路的亚家族之一,与机体细胞增殖与分化关系密切。ERK1/2 信号通路具有明确的心肌保护作用,ERK1/2 信号通路激活可显著增强大鼠心肌细胞抗凋亡的能力,可明显减轻大鼠MIRI 损伤。孟庆莉等[21]研究发现:柿叶提取物可通过激活ERK1/2 信号通路,抑制心肌细胞凋亡,减轻大鼠MIRI。本研究结果表明: 模型组大鼠p-ERK1/2 蛋白表达水平明显降低,ERK1/2 信号通路活性被抑制,而给予舒芬太尼后p-ERK1/2蛋白表达水平明显升高,ERK1/2 信号通路被激活,表明舒芬太尼对MIRI 大鼠的保护作用机制可能与激活ERK1/2 信号通路有关。
研 究[22]表 明:LncRNA-MALAT1 可 通 过 直接靶向ERK1/2 信号通路发挥生物学功能。因此本研究推测舒芬太尼是通过抑制LncRNA-MALAT1表达,从而激活ERK1/2 信号通路,发挥抗凋亡作用。为了进一步验证此机制, 本研究参照文献[23]的方法制备大鼠心肌细胞缺氧复氧损伤模型,用以模拟在体MIRI 过程,并转染MALAT1过表达载体使MALAT1 高表达,观察舒芬太尼对H9C2 细胞的保护作用,结果显示:MALAT1 过表达可进一步促进H/R 细胞凋亡,并且进一步抑制ERK1/2 信号通路的活性;而给予舒芬太尼可明显逆转MALAT1 过表达诱导的H9C2 细胞中cleaved-caspase-3 蛋白表达水平及Bax/Bcl-2 比值升高;并且舒芬太尼逆转了MALAT1 过表达导致的H9C2 细胞ERK1/2 信号通路被抑制的现象。以上结果提示:舒芬太尼是通过抑制LncRNA-MALAT1,靶向激活ERK1/2 信号通路,抑制心肌细胞凋亡,从而发挥保护MIRI 的作用。
MIRI 的作用机制复杂,涉及多个LncRNA 和信号通路的变化,本研究只对LncRNA-MALAT1和ERK1/2 信号通路进行了初步探讨,深入研究舒芬太尼对其他MIRI 靶点的影响,对明确其保护MIRI 的作用机制至关重要。
综上所述,舒芬太尼减轻MIRI 大鼠心肌细胞凋亡可能与抑制LncRNA-MALAT1 表达从而激活ERK1/2 信号通路有关。

