急性淋巴细胞白血病移植瘤模型小鼠髓外浸润过程中血清Wnt5A 和LINE-1 启动子甲基化水平检测及其意义
王一涵, 王奕丹, 惠赫童, 范馨元, 王添琦, 夏 薇, 刘丽梅
(北华大学医学技术学院实验中心,吉林 吉林 132013)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种由淋巴细胞异常增生引起的淋巴祖细胞恶性疾病。异常增生的白血病细胞可在骨髓聚集并抑制正常造血功能,同时也可侵犯骨髓外的组织。在ALL 治疗方案中通常包括髓外浸润预防治疗,然而白血病细胞髓外浸润仍然是一个主要的临床问题,具有很高的抗化疗复发风险[1-2]。近年来,随着肿瘤细胞生物学及分子生物学检测技术的快速发展,血清游离DNA (circulating free DNA,cfDNA) 甲基化成为肿瘤检测与病情监测的研究热点[3]。血清cfDNA 是外周血中存在的非结合DNA,多种恶性肿瘤患者的血清cfDNA 具有与肿瘤组织中DNA 相同的基因特性。Wnt 家族成员 5A (Wingless-type MMTV integration site family member 5A,Wnt5A)是一种自分泌和旁分泌的β-连环蛋白非依赖性配体,已被证明可诱导肿瘤 抑 制 和 致 癌 信 号[4]。研 究[4]显 示:Wnt5A 的 表达下调与癌症的不良预后有关,表明Wnt5A 在癌症中具有肿瘤抑制作用。尽管Wnt5A 与不同病理状况有关,但其在癌症中的具体作用尚不明确,可能涉及甲基化修饰、不同的mRNA 异构体及不同的下游途径[5]。逆转座子长散布核元件1 (long interspersed nuclear element-1,LINE-1) 是目前唯一已知的具有自主活性的人类反转录转座子,约占人类基因组的1/6。LINE-1 启动子低甲基化可作为全基因组DNA 低甲基化的生物标记物,而DNA 低甲基化本身就是癌症的一种主要标志。LINE-1 甲基化在实体瘤中的研究[6]可见报道,而在淋巴肿瘤中异常LINE-1 低甲基化的研究较少。为此,本研究构建了急性淋巴细胞白血病移植瘤小鼠模型,通过绿色荧光蛋白(green fluorescent protein,GFP)监测髓外浸润情况,同时探讨白血病细胞髓外浸润过程中血清cfDNA 中Wnt5A 与癌基因LINE-1 启动子区甲基化变化,为ALL 复发及抗化疗风险提供可行的诊断和监控策略。
1 材料与方法
1.1 细胞、实验动物、试剂和主要仪器小鼠急性B 淋巴细胞白血病细胞L1210(中科院上海细胞库);60 只ICR 小鼠购自吉林省长春市亿斯实验动物技术有限公司,动物生产许可证号:SCXK(吉) -2018-0007, 体 质 量(13.94±3.42) g。DMEM 培养液(美国Gibco 公司),胎牛血清(美国Hyclone 公司),嘌呤霉素和Hoechst33258(美国Sigma 公司),慢病毒载体(苏州吉玛基因股份有限公司),血清cfDNA 提取试剂盒(天根生化科技公司),亚硫酸氢盐快速转化试剂盒(苏州唯善生物科技有限公司),RNA 提取试剂盒、反转录试剂盒、Premix Taq Hot Start 和SYBR Premix Ex Taq Ⅱ(大连宝生物公司),PCR 引物由华大科技有限公司合成。流式细胞仪(型号:NovoCyte)[艾森生物(杭州) 有限公司],倒置荧光显微镜(型号:TS100)(日本尼康公司),冰冻切片机(型号:CM1950)[徕卡显微系统(上海)贸易有限公司],PCR 扩增仪(型号:ECT811)[东胜(广州) 生物科技有限公司],Real time PCR 仪(型号:5100)[赛默飞世尔科技(中国) 有限公司]。
1.2 GFP 标记的急性B 淋巴细胞白血病小鼠模型构建采用携带有GFP 的慢病毒载体转染小鼠急性B 淋巴细胞白血病L1210 细胞,荧光显微镜下筛选表达有GFP 的细胞,流式细胞仪检测细胞荧光强度。将60 只4 周龄ICR 小鼠随机分为对照组、实验15 d 组和实验30 d 组,每组20 只。腹腔注射环磷酰胺进行免疫抑制后,实验组通过尾静脉注射L1210 细胞,每只小鼠1.0×107个细胞,对照组注射同等体积PBS 缓冲液。实验15 d 组和实验30 d组小鼠分别于接种肿瘤细胞15 和30 d 后处死,解剖,取内脏组织称质量、包埋剂包埋并进行冰冻切片,并用Hoechst 33258 工作液染色。提取血中单个核细胞与血清备用。流式细胞仪分析单个核细胞荧光强度,倒置荧光显微镜观察GFP 记录肿瘤细胞浸润情况。
1.3 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组小鼠外周血细胞中相关基因mRNA 表达水平提取血液RNA 进行反转录,再采用RT-qPCR 法扩增,反应体系为25 μL,其中上下游引物各0.75 μL,引物序 列 见 表1。cDNA 模 板2 μL,去 离 子 水9 μL,SYBR Premix Ex Taq Ⅱ12.5 μL。 反 应 程 序:95 ℃预变性30 s;95 ℃、5 s,55 ℃、30 s,72 ℃、30 s;共40 个循环。实验独立重复3 次,以Ct 值计算外周血细胞中相关基因mRNA 表达水平。

表1 RT-qPCR 法引物序列Tab.1 Primer sequences of RT-qPCR method
1.4 血清cfDNA 提取及Wnt5A 和LINE-1 基因甲基化水平检测使用血清cfDNA 提取试剂盒按说明书操作提取各组小鼠血清cfDNA,按照重亚硫酸氢盐快速转化试剂盒说明书操作,对所提取的cfDNA 进 行 处 理。MethyPrimer 软 件 设 计Wnt5A 和LINE-1 基因启动子区CpG 岛并进行引物设计,引物序列见表2。采用降落PCR 将亚硫酸盐处理后的cfDNA 进行PCR 扩增,反应体系为25 μL,其中上下游引物各1 μL,模板3 μL,去离子水7.5 μL,Premix Taq Hot Start 12.5 μL。扩增程序:95 ℃预变性,98 ℃变性10 s, 65 ℃退火30 s,每个循环降低1 ℃,共15 个循环,50 ℃退火30 s,15 个PCR循环。使用凝胶回收试剂盒按照说明书对PCR 产物进行纯化后,连接T 载体,进行转化,每个样品挑取至少20 个克隆进行质粒提取并送至华大科技有限公司测序,测序结果采用BIQ Analyzer 软件进行分析,得到单个位点甲基化水平。
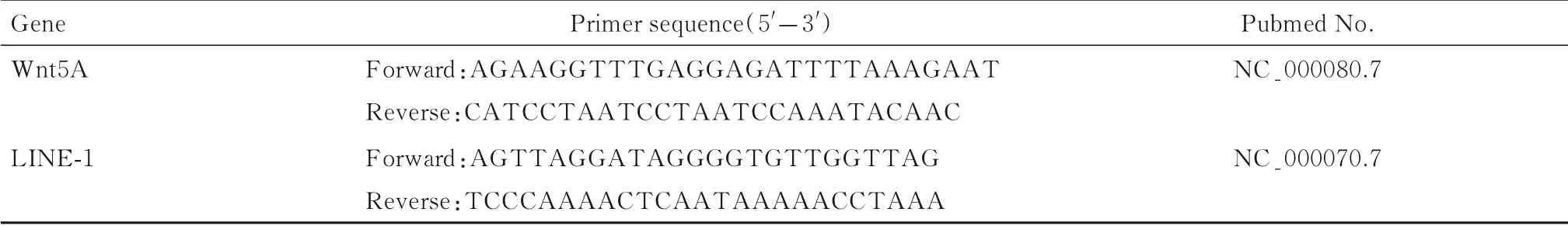
表2 BSP 法引物序列Tab.2 Primer sequences of BSP method
1.5 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组小鼠外周血细胞中相关基因mRNA 表达水平和血清中甲基化水平以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 急性B 淋巴细胞白血病小鼠模型鉴定慢病毒感染后的L1210 细胞经4 mg·L-1嘌呤霉素筛选7 d 后,荧光显微镜下可见均匀绿色荧光。连续传代培养,经流式细胞术检测GFP 阳性细胞的比例均大于80%,表明感染后L1210 细胞稳定表达GFP(图1 和2)。小鼠建模12 d,实验组小鼠出现精神萎靡、活动减少、嗜睡和脊背弓起等症状。建模15 和30 d 分别处死小鼠,取各脏器称质量,与对照组比较,实验30 d 组小鼠脾脏质量增加(P<0.05),脾肿大较为明显,小鼠肝脏、心脏和肾脏质量差异无统计学意义(P>0.05)(图3)。实验15 d 组小鼠脾组织中有明显绿色荧光,表明肿瘤细胞已浸润至小鼠脾组织中,实验30 d 组小鼠脾组织荧光强度更为明显(图4)。流式细胞术检测各组小鼠外周血细胞荧光强度,与对照组比较,实验15 d 和30 d 组小鼠外周血细胞荧光强度均明显增强,实验30 d 组小鼠外周血细胞荧光强度较实验15 d 组更高(图5)。
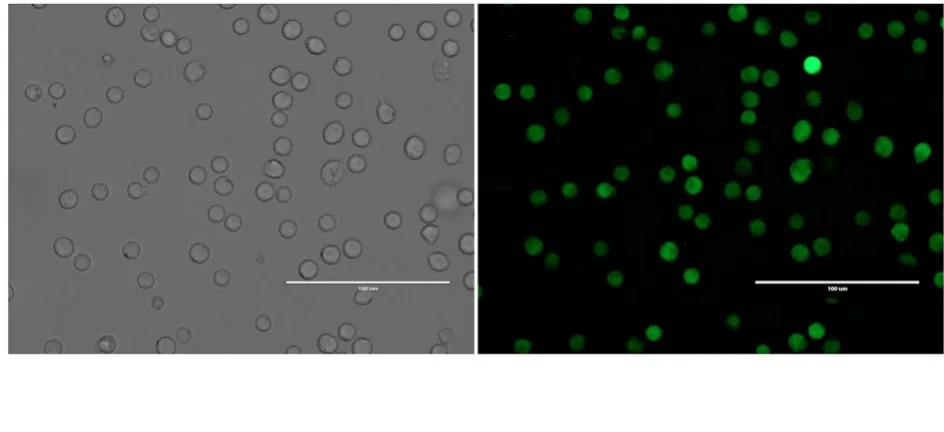
图1 倒置荧光显微镜观察慢病毒感染后L1210 细胞形态Fig. 1 Morphology of lentivirus infected L1210 cells observed by inverted fluorescence microscope
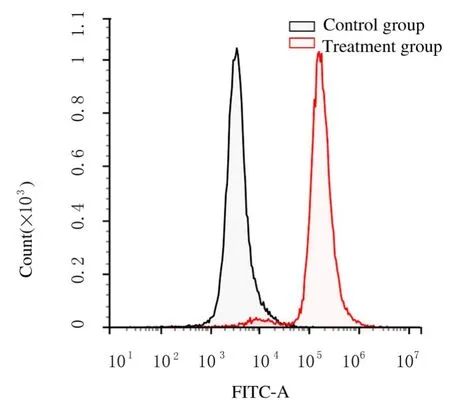
图2 流式细胞术分析慢病毒感染情况Fig. 2 Analysis on lentivirus infection by flow cytometry

图3 各组小鼠心脏、肾脏、脾脏和肝脏大体表现(A)和质量(B)Fig.3 Mass of heart,kidney,spleen and liver of mice in various group
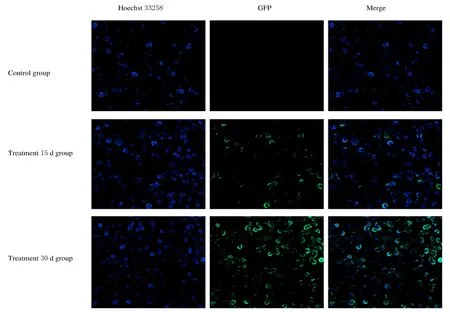
图4 各组小鼠脾组织浸润情况(Hoechst33258,×400)Fig.4 Infiltration of spleen tissue of mice in various groups(Hoechst33258,×400)

图5 流式细胞术检测各组单个核细胞绿色荧光强度Fig. 5 Green fluorescence intensities of mononuclear cells in various groups detected by flow cytometry
2.2 各组小鼠血细胞中相关基因mRNA 表达水平与对照组比较,实验15 d 组和实验30 d 组小鼠血清中单个核细胞中去甲基转移酶双加氧酶2(methylcytosine dioxygenase 2,TET2) mRNA 表达水平明显降低,DNA 甲基转移酶3a (DNA methyltransferase 3a,DNMT3a)、DNA甲基转移酶3b(DNA methyltransferase 3b,DNMT3b) mRNA表达水平明显升高;Wnt5A mRNA 表达水平明显 降 低(P<0.05), LINE-1 mRNA 表 达 水 平明显升高(P<0.05)。见表3。

表3 各组小鼠细胞中癌基因和抑癌基因mRNA 表达水平Tab. 3 Expression levels of oncogenes and tumor suppressors mRNA in cells of mice in various groups (n=20,x±s)
2.3 各组小鼠血清中Wnt5A 与LINE-1 基因启动子区甲基化水平实验15 d 组小鼠血清中抑癌基因Wnt5A 基因启动子区甲基化水平(90.00%±12.91%) 明显高于对照组(73.75%±3.95%)(P<0.05), 实 验30 d 组Wnt5A 甲 基 化 水 平(75.00%±22.68%) 高 于 对 照 组 (P<0.05)(图6A);实验15 d 组LINE-1 基因启动子区甲基化水 平 (53.41%±20.87%) 明 显 低 于 对 照 组(71.59%±25.45%)(P<0.05),实验30 d 组启动子区甲基化水平(44.32%±12.95%) 低于实验15 d 组(P<0.05)(图6B)。

图6 各组小鼠血清中基因启动子区甲基化水平差异Fig.6 Differences of methylation levels in promoter regions of genes in serum of mice in various groups
3 讨论
与实体肿瘤动物模型不同,血液肿瘤的侵袭转移难以定位。近年来,荧光免疫标记技术在许多研究领域中得到应用,提示研究者可以采用荧光标记对血液肿瘤细胞进行更明确的体内追踪。本研究应用表达有GFP 的慢病毒载体成功构建了急性淋巴细胞性白血病小鼠模型,并通过脾组织切片监测到肿瘤细胞的髓外浸润。在此基础上进行血液特征的分析。
Wnt5A 信号的异常激活或抑制正在成为肿瘤发生过程中的一个重要事件,同时发挥致癌和抑癌作用[7],其基因的异常甲基化会导致其表达沉默[8]。Wnt5A 下调或沉默可见于多种血液肿瘤细胞系,包括鼻NK/T 细胞淋巴瘤和NK 白血病细胞系、白血病和伯基特淋巴瘤[9]。由于Wnt5A 可以抑制B 细胞的增殖,因此其在血液系统恶性肿瘤中发挥肿瘤抑制作用,从而抑制肿瘤细胞的生长和迁移,但在ALL 血清cfDNA 中其启动子甲基化状态尚未可知。本研究通过对cfDNA 甲基化水平分析发现:肿瘤细胞接种15 d 时Wnt5A 基因已呈现高甲基化状态,其甲基化表达明显下降,提示其高甲基化状态抑制了mRNA 的转录水平。在ALL 患者中Wnt5A 的高甲基化,可直接影响mRNA 的表达[10]。注射30 d,甲基化水平有所降低,这可能由于注射肿瘤细胞后,细胞逐渐释放到血液中,但随着细胞生长,部分肿瘤细胞无法适应导致其不能全部存活,故肿瘤细胞浓度有所降低。且DNA 甲基化水平与DNA 甲基转移酶(DNMT)、组蛋白甲基化、RNA 干扰和病毒感染等多种因素有关。
在癌细胞中,LINE-1 逆转录转座子可以通过插入突变、异常剪接或DNA 断裂使基因功能失活,导致基因组不稳定[11-12]。LINE-1 插入更多地发生在基因间或异染色质区域[13]、癌症特异性低甲基化区域和癌症中常见突变的基因中,表明LINE-1转 导 的 致 癌 性 质[11,14]。LINE-1 反 向 启 动 子 通 过 基于小干扰RNA 的机制调节LINE-1 逆转录转座,还可能调节其他临近基因的转录[10]。目前研究者认为LINE-1 低甲基化是癌症发生的起始因素,在某些癌症中,癌前病变在癌症转化前可观察到LINE-1 明显的去甲基化。本研究结果显示:LINE-1 基因在髓外浸润过程中呈现逐步低甲基化,其转录水平明显上调,提示LINE-1 可作为一种癌基因成为ALL 中病情监测的靶点。
综上所述,通过尾静脉注射表达GFP 的小鼠ALL L1210 细胞构建ALL 小鼠髓外浸润模型,可方便地监测其髓外浸润情况。血清中抑癌基因Wnt5A 与癌基因LINE-1 作为ALL 的监测靶点,可为ALL 早期诊断与治疗监测提供新的手段与策略,为预后判断及个体化治疗提供新的方向。

