REG1A 通过调控Wnt/β-catenin 信号通路对肺腺癌细胞增殖和迁移的促进作用
李小燕, 张 维, 何 杰
(1. 成都医学院临床医学院,四川 成都 610500;2. 成都医学院第一附属医院内分泌科,四川 成都 610500;3. 成都医学院第一附属医院呼吸与危重症医学科,四川 成都 610500)
肺癌是目前全球发病率仅次于乳腺癌的恶性肿瘤,其中,肺腺癌的发病率在非小细胞肺癌(non small cell lung cancer,NSCLC)中居第1 位,约占所有肺癌的40%[1],且其预后较差。虽然肺腺癌的免疫治疗和靶向药物治疗发展迅速,但其5年生存率仅为4%~17%[2-4],因此需要寻找肺腺癌细胞相关的关键调控基因,研究肺腺癌治疗的新靶点。再生基因1A(regenerating gene 1A,REG1A) 是一种人胃黏膜中的促生长因子,对胃颈部干细胞生长增殖具有重要作用,可促进胃黏膜细胞增生,修复胃黏膜细胞损伤[5]。既往研究[6-7]显示:REG1A在胃恶性肿瘤患者中表达水平明显高于正常人,且高表达REG1A 胃癌患者预后较差。也有研究[8-10]显示:除胃癌外,REG1A 在多种肿瘤(鼻咽癌、乳腺癌和膀胱癌等)组织中也呈现高表达,且与肿瘤的预后存在紧密的关联。MINAMIYA 等[11]研究显示:REGA1 表达水平低的NSCLC 患者5年生存率明显高于REGA1 表达水平高的患者。但是,上述研究仅研究了REGA1 与NSCLC 患者预后的关系,未针对REGA1 在肺腺癌中涉及的具体通路进行深入研究,REGA1 导致肺癌预后差的分子机制尚不清楚。本研究利用肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)公共数据库及相关生物信息学分析网站分析REG1A 在肺腺癌中的表达及相关通路,并结合临床样本和肺腺癌细胞株对生物信息学分析结果进行验证,探讨REG1A 对肺腺癌细胞增殖和迁移的促进作用,以揭示REG1A在肺腺癌发展中的可能调控机制。
1 资料与方法
1.1 生物信息学分析
1.1.1 REG1A 表达水平分析 采集来自TCGA数据库的515 例肺腺癌组织和59 例癌旁正常组织的基因表达谱信息,使用在线分析网站UALCAN(http://ualcan. path. uab. edu/cgi-bin/ualcan-res.pl)分析肺腺癌患者癌组织和正常组织中REG1A基因mRNA 表达水平。采用R3.6.1 软件中的“merge”函数,以REG1A 表达水平的中位数值为截断值,将肺腺癌样本分为低表达REG1A 组和高表达REG1A 组用于后续分析。
1.1.2 低表达REG1A 组与高表达REG1A 组差异基因分析 来自TCGA数据库中的高表达REG1A组258 例和低表达REG1A 组患者257 例差异基因通过Wilcoxon 秩和检验在R 软件中的“limma”程序包中进行分析。设定阈值调整后P<0.05 和log2折点变化的绝对值(|log2Fold Change |) >1.5,差异基因均以热图形式呈现。
1.1.3 基因富集分析 采用R 软件中的“Cluster Profiler GO”程序包和GSEA 4.1.0 软件对低和高表达REG1A 组差异基因进行基因本体(Gene Ontology,GO)功能注释和京都基因与基因组百科 全 书 (Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析,基于缺省加权富集统计法,最终设定随机组合次数为1000 次,P<0.05 和错误发生率(false discovery rate,FDR)<0.25 的基因集作为显著富集基因集,挑选其中得分最高的信号通路作为研究对象。
1.2 实验验证
1.2.1 细胞、主要试剂和仪器 4 种人肺腺癌细胞系(A549、LC-2、HCC515 和PC14)和人肺上皮细胞系(BEAS-2B) 购于上海生命科学院。shRNA-REG1A 和shNC 质粒寡核苷酸片段由上海和生生物科技有限公司合成,胰酶消化液购于美国Hyclone 公 司,FBS、OptiMEN 和DMEM 购 于 美国Gbico 公司,Transwell 小室购于美国Coring 公司,脂质体Lipofectamine 2000 购于美国Invitrgen公司,REG1A 引物序列由杭州齐步生物有限公司合成,免疫组织化学试剂盒购于广州辉俊生物科技有限公司,β-连环素(β-catenin)、无翅型MMTV整合位点家族成员3a (wingless type MMTV integration site family member 3a,Wnt-3a)、c-Myc原癌基因和REG1A 蛋白抗体购于美国Cellular Signaling Technology 公司。168-1130 酶标仪(美国Bio-Rad 公司)。
1.2.2 标本来源 选 择2018年1月—2020年12月成都医学院第一附属医院外科接受肺癌切除术患者40 对经组织病理学证实的人肺腺癌样本和距肿瘤至少5 cm 的正常肺组织标本。本实验经成都医学院第一附属医院伦理委员会审批通过,取组织样本前患者本人及家属均知情,并签署相关同意书。
1.2.3 免疫组织化学检测阳性染色细胞数 将组织放置于石蜡之中包埋,切片厚度为4 μm,将载玻片依次放入二甲苯与不同浓度酒精中进行脱蜡,脱蜡后在清水中冲洗一段时间,加入3%H2O2浸泡20 min 后倒掉H2O2,加入枸橼酸盐缓冲液,放入微波炉中蒸煮至沸腾(中火),冷却至室温后再蒸煮一次,冷却至室温,倒掉枸橼酸盐缓冲液,将载玻片置于PBS 缓冲液中清洗5 min,重复3 次,擦干组织周围的PBS 缓冲液,立即加上10%血清,使一些非特异性的位点封闭起来,然后放入37 ℃温箱中10 min;加一抗4 ℃过夜,加PBS 缓冲液再次清洗5 min,重复3次,再加二抗,37 ℃、30 min,再次清洗,滴加辣根过氧化物酶标记的链霉素卵白素工作液37 ℃孵育30 min;DAB 显色,苏木精复染,将复染后的片子置于水中冲洗后,将载玻片放入不同浓度酒精和二甲苯中脱水,干燥后,用中性树胶封片,放于显微镜下观察。当每张切片至少用5 个高倍视野进行观察时,染色细胞数占总细胞数目5%以下,则标本结果为REG1A 阴性,反之则为REG1A 阳性。
1.2.4 细胞培养 本实验分为 shNC 组、shREG1A 组、shREG1A+PBS 组和shREG1A+氯化锂(LiCl) 组。在含5% CO2湿润状态下,将A549 细胞在含有10% FBS 的DMEM 完全培养液中37 ℃常规培养。将处于活性状态的A549 细胞消化、离心后接种于培养板上,置于细胞孵育箱继续培养,细胞密度>80%后用脂质体Lipofectamine 2000 转染试剂转染细胞,转染shREG1A 和阴性对照质粒shNC,每孔5 μg 质粒,shREG1A 质粒组加入 浓 度 为20 mmol·L-1且 溶 于 去 离 子 水 的LiCl(shREG1A+LiCl) 或 等 体 积 PBS 缓 冲 液(shREG1A+PBS)。转染成功后培养48 h,收集细胞继续用于后续实验。
1.2.5 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR) 法检测目的基因mRNA 表达水平 使用Trizol 按说明书提取细胞中总RNA,将其反转录为cDNA,再以cDNA 为模板进行PCR 扩增。各基因引物序列见表1。反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃反应20 s,70 ℃反应30 s;循环次数40 次。以GAPDH 为 内 参,采 用2-△△Ct法 计 算 目 的 基 因mRNA 表达水平。

表1 RT-qPCR 法的引物序列Tab.1 Primer sequences of RT-qPCR method
1.2.6 Western blotting 法检测各组细胞中蛋白表达水平 转染质粒24 h,从细胞中提取全部蛋白质,经BCA 试剂盒定量检测浓度合格,将灌有PAGE 的小玻璃板放入足够的电泳液中,用SDS缓冲液将蛋白样品煮沸变性,然后将变性的样品上样至凝胶中进行电泳分离。电泳后,将凝胶中的蛋白转移至PVDF 膜上。加入5%脱脂牛奶在室温下缓慢摇荡封闭2 h。将一抗用TBST 稀释至适当浓度,室温条件下,在摇床上缓慢摇动孵育2 h;孵育完成后吸取一抗,将膜放入TBST 中,使TBST没过PVDF 膜,在摇床上低速震荡10 min,重复洗3 次。相同的方法处理二抗。使用酶促反应使底物显色出现条带,对蛋白条带进行相对分子质量和灰度值分析。以GAPDH为内参,以目的蛋白条带灰度值与GAPDH条带灰度值比值表示目的蛋白表达水平。
1.2.7 细胞计数试剂盒(Cell Counting Kit-8,CCK-8)法检测各组细胞增殖活性 将每组细胞按每孔200 μL 培养,每隔24 h 后将每个孔中加入20 μL CCK-8 试剂,然后用酶联免疫检测仪在450 nm 波长下检测各组吸光度(A) 值。以细胞A 值表示细胞增殖活性,并绘制细胞增殖曲线。1.2.8 细胞迁移实验 常规胰酶消化细胞,PBS缓冲液冲洗1 次去除血清的影响,用无血清培养基重悬细胞。添加1×105个细胞至Transwell 小室上层,24 孔细胞培养板下室内加入700 μL 含20%血清的DMEM-H 培养液,注意上、下层无气泡产生。培养板置于37 ℃、5%CO2培养箱中培养24 h,取出小室,PBS 缓冲液冲洗2 遍,用棉棒小心擦洗干净小室微孔膜上层内的细胞,在24 孔细胞培养板内采用1 mL 甲醇室温固定15 min,结晶紫溶液染色15 min。倒置显微镜下取像。使用Image J 软件计算迁移细胞数。以每个100 倍镜下细胞数表示细胞迁移能力。
1.3 统计学分析
采用R 3.6.1、Graph Pad Prism 7.0 和GSEA 4.1.0 统计软件进行统计学分析。生物信息学分析基因表达谱数据不符合正态分布,以中位数(M)[四分位数间距(Q)]表示,低表达REG1A 组与高表达REG1A 组差异基因比较采用非参数秩和检验。实验验证数据分析中,各组细胞中REG1A、Wnt-3a、β-catenin 和c-Myc mRNA 及 蛋 白 表 达 水平,细胞增殖活性和迁移细胞数均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验,两组间样本均数比较采用两独立样本t检验。检验水准为α=0.05。
2 结果
2.1 肺腺癌组织和癌旁正常组织中REG1A mRNA 表达水平
TCGA 公共数据库分析结果显示:肺腺癌组织中REG1A mRNA 的表达水平[0.085(0.019,0.683)]高于癌旁组织[0.012(0.008,0.219)](Z=2.498,P=0.012)。
2.2 低表达REG1A 组和高表达REG1A 组差异基因分析
2 组共有78 个差异表达基因,其中20 个下调基因和58 个上调基因。差异基因的热图见图1。
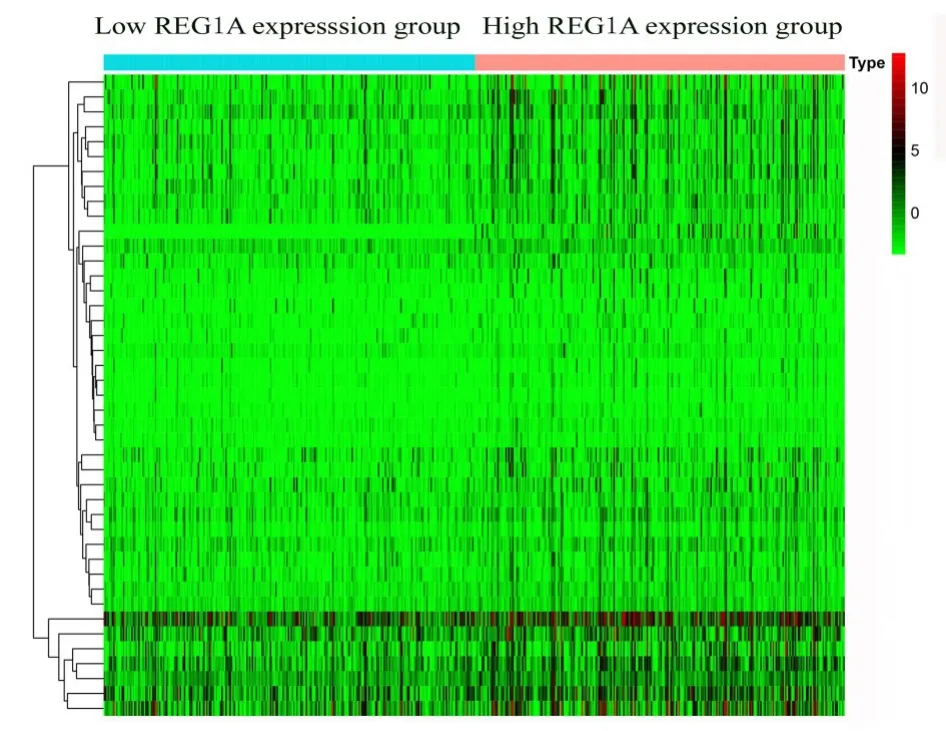
图1 2 组差异基因的热图Fig.1 Heat map of differential genes in two groups
2.3 差异基因GO 注释和KEGG 途径富集分析
GO 注释结果显示:差异基因涉及到10 个生物学过程,10 个分子功能和1 个细胞组分,见图2A。KEGG 途径富集分析表明:低和高表达REG1A 组差异基因在Wnt 信号通路得分最高,标准化富集分数 (Normalization Enrichment Score, NES) =2.248。因此选取Wnt 信号通路作为研究通路,探索REG1A 是否可通过Wnt 信号通路对肺腺癌增殖和迁移产生影响。见图2B 和表2。

图2 低和高表达REG1A 组差异基因富集分析Fig.2 Enrichment analysis of differentially genes in low and high expression REG1A groups

表2 KEGG 富集分析Tab.2 KEGG enrichment analysis
2.4 免疫组织化学检测肺腺癌组织和癌旁组织中REG1A 蛋白表达情况
免疫组织化学检测结果显示:REG1A 蛋白主要分布在肺腺癌细胞胞膜上,少量定位于间质,而几乎不存在于正常肺组织中。REG1A 阳性表达呈棕黄色或深棕色。见图3。

图3 肺腺癌组织(A)和癌旁正常肺组织(B)中REG1A 蛋白表达情况(免疫组织化学,×400)Fig.3 Expressions of REGA1 in lung adenocarcinoma(A)and para-cancerous normal lung(B) tissues (Immunohistochemistry,×400)
2.5 REG1A 在多种肺腺癌细胞和人正常肺上皮细胞中表达水平
RT-qPCR 法和Western blotting 法检测结果显示: 人肺腺癌A549、LC-2、HCC515 和PC14 细胞中REG1A mRNA 水平高于人正常肺上皮细胞BEAS-2B,其中以A549 细胞差异最为显著(P<0.05)。见图4。因此,选取A549 细胞作为研究对象继续研究。

图4 人正常肺上皮细胞和肺腺癌细胞中REGA1 表达情况Fig.4 REGA1 expressions in human normal lung epithelial cells and lung adenocarcinoma cells
2.6 REG1A 基因敲减后REG1A 表达情况
为进一步验证REG1A 基因能作为功能性癌基因参与肺腺癌的进程,本研究进一步对A549 细胞中的REG1A 基因进行敲减。转染48 h 后,与shNC 组 比 较,shREG1A 组A549 细 胞 中REG1A mRNA 和蛋白表达水平均降低(P<0.05)(图5)。提示转染成功,可以用于后续实验。

图5 RT-qPCR 和Western blotting 法验证REG1A 敲减效率Fig.5 Knockdown efficiencies of REG1A verified by RT-qPCR and Western blotting methods
2.7 REG1A基因敲减后shNC 和shREG1A 组细胞增殖活性和迁移细胞数
CCK-8 法 检 测 结果 显 示: 转 染 后0 h,shREG1A 组与shNC 组细胞增殖活性比较差异无统计学意义(P>0.05);但转染24、48 和72 h 后,与shNC 组比较,shREG1A 组细胞增殖活性降低(P<0.05)。见图6。Transwell 实验结果显示:与shNC 组[(158.46±15.25) 个] 比较,shREG1 A 组迁移细胞数[(52.47±12.44)个]明显减少(t=-9.321,P<0.05)。见图7。
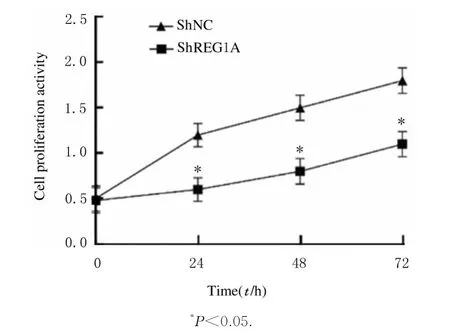
图6 CCK-8 法 检 测shNC 组 和shREG1A 组A549 细胞增殖活性Fig.6 Proliferation activities of A549 cells in shNC group and shREG1A group measured by CCK-8 method

图7 Transwell 实验检测shNC 组(A)和shREG1A 组(B)细胞迁移情况(结晶紫,×100)Fig. 7 Migration of cells in shNC group(A) and shREG1A group(B) detected by Transwell assay(Crystal violet,×100)
2.8 敲减REG1A 实验检测各组细胞中Wnt-3a、β-catenin和c-Myc mRNA及蛋白表达水平
shREG1A 组 细 胞 中Wnt-3a、β-catenin 和c-Myc mRNA 及蛋白表达水平在REG1A 基因敲减后明 显 低 于shNC 组(P<0.05); 与shREG1A+PBS 组 比 较, shREG1A+LiCl 组 Wnt-3a、 βcatenin 和c-Myc mRNA 及蛋白表达水平升高(P<0.05)。见图8。

图8 转染后各组A549 细胞中Wnt/β-catenin 通路相关蛋白表达情况Fig.8 Expressions of Wnt/β-catenin pathway-related proteins in A549 cells in various groups after transfection
2.9 转染后各组细胞增殖活性和迁移细胞数
shNC 组、shREG1A 组、shREG1A+PBS 组和shREG1A+LiCl 组细胞增殖活性比较差异有统计学意义(P<0.05),shREG1A 组细胞增殖活性低 于shNC 组 和shREG1A+LiCl 组(P<0.05),shREG1A 组与shREG1A+PBS 组细胞增殖活性比较差异无统计学意义(P>0.05)。见图9。shNC 组、shREG1A组、shREG1A+PBS组和shREG1A+LiCl组48 h 迁 移 细 胞 数 分 别 为(180.00±10.33)、(70.33±22.00)、(64.33±9.33) 和(174.00±20.00) 个,4 组间比较差异有统计学意义(F=43.423,P<0.05); shREG1A 组迁移细胞数少于shNC 组和shREG1A+LiCl(P<0.05),shREG1A组与shREG1A+PBS 组迁移细胞数比较差异无统计学意义(P>0.05)。见图10。
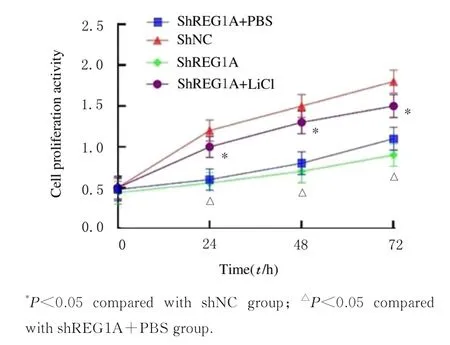
图9 CCK-8 法检测各组A549 细胞增殖活性Fig.9 Proliferation activities of A549 cells in various groups measured by CCK-8 method
图10 Transwell 实验检测各组A549 细胞迁移情况(结晶紫,×100)Fig.10 Migration of A549 cells in various groups detected by Transwell assay(Crystal violet,×100)
3 讨论
REG 是从仅剩下10%胰腺的大鼠再生胰岛源性cDNA 文 库 筛 检 鉴 定 获 得 的[10,12]。 其 中,REG1A 位于人类2 号染色体p12 区,其属于REG基因家族17 个成员中的一员,是一种由6 个外显子和5 个内含子组成的全长2962 bp 的单拷贝基因[13]。REG1A 是一种癌基因,在多种消化系统疾病病变组织中表达上调,如消化系统炎症病变或消化系统肿瘤等,研究[14-15]发现:炎性肠病患者炎症结直肠组织中REG1A 表达水平明显升高,异常表达的REG1A 可以明显抑制炎症反应,促进细胞增殖,抑制肠道上皮的细胞凋亡;REG1A 在胰腺癌中表达上调,可以作为胰腺腺泡细胞癌的诊断标志物。本研究通过TCGA 公共数据库初筛发现REG1A 在肺腺癌组织中呈现高表达,进一步结合临床40 对肺腺癌组织样本的免疫组织化学检测结果发现:REG1A 蛋白主要分布在肿瘤细胞胞膜上,少量定位于间质,而几乎不存在于正常肺组织中,进一步证实了REG1A 在肺腺癌中也是一种癌基因。肺腺癌和多数消化系统肿瘤均属于腺癌,可能在肿瘤的生物学行为和特征上存在相似性,因此消化系统 肿瘤和肺腺癌中REG1A 的表达均上调。除此之外,REG1A 与许多其他疾病也存在紧密的联系,如鼻咽癌、乳腺癌和膀胱癌等多种恶性肿瘤,其发生、发展、治疗反应性及预后均明显与REG1A 的 表 达 相 关[8,13,16]。本 研 究 通 过 对4 种 不同肺腺癌细胞进行RT-qPCR 法和Western blotting法检测,结果显示:上述细胞中REG1A 也呈现高表达,并且敲减REG1A 后能够明显抑制A549 细胞增殖和迁移,表明REG1A 可能在促进肺腺癌的发展中起着重要作用。KIMURA 等[17]研究表明:过表达REG1A 的肺腺癌细胞表现出更强的增殖和侵袭能力,与本研究部分结果类似。MINAMIYA等[11]研究显示:高表达REG1A 是NSCLC 患者的独立预后因素。结合之前的研究结果,本文作者推测高表达REG1A 的肺癌患者预后更差的原因可能与REG1A 促进肿瘤细胞增殖和迁移能力有关,但具体的分子机制值得深入研究。
本研究进一步对TCGA 数据库中低表达和高表达REG1A 的肺腺癌样本进行差异分析,共发现58 上调的基因和20 下调的基因,高表达REG1A 组的差异基因主要涉及到10 个生物学过程,主要集中在消化系统和上皮结构的稳定;10 个分子功能,主要富集在离子转运体活动和内切核糖核酸酶活性;1 个 细 胞 组 分 为 高 尔 基 腔。ASTROSINI 等[18]发现:REG1A 在结直肠癌中也呈现高表达,高表达 REG1A 的结直肠癌患者生存期更短。SEKIKAWA 等[19]研 究 显 示:REG1A 可 以 促 进 胃癌细胞的分化和增殖,其机制是通过REG1A 增强蛋白激酶B(protein kinase B,Akt)激活、B 细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)相关死亡促进因子的磷酸化和B 细胞淋巴瘤XL (B cell lymphoma-XL,Bcl-XL)表达介导信号转导与转录激活因子3 (signal transducers and activators of transcription 3,STAT3) 信号在胃癌细胞中的抗凋亡作用,上述文献报道进一步佐证了本研究前期生物信息分析的正确性。本研究结果表明:肺腺癌中高表达REG1A 组差异基因在Wnt 信号通路和癌症信号通路富集,其中Wnt 信号通路得分最高。Wnt 信号通路的异常活化与肺腺癌的发生发展有密切关联,调控着肺腺癌细胞的增殖、黏附、侵袭和转移等诸多过程。本研究结果提示:REG1A 可能通过激活Wnt 信号通路促进肺腺癌细胞的增殖和迁移。然而,这一受调控的信号通路与REG1A在胃癌中涉及的通路不同,其原因可能是REG1A 涉及的通路在肺癌组织和胃癌组织中各有其组织特异性有关。
本研究结果显示:实验组Wnt-3a、β-catenin 和c-Myc 表达水平均明显下调。加入LiCl 处理肺腺癌细胞后,shREG1A+LiCl 组Wnt-3a、β-catenin 和c-Myc mRNA 及蛋白表达水平升高。采用Wnt 通路激动剂LiCl 处理肺腺癌细胞后,敲减REG1A 基因对细胞的增殖和迁移的抑制作用被显著逆转,表明REG1A 可以直接通过Wnt/β-catenin 信号通路促进肺腺癌细胞的增殖和迁移。Wnt/β-catenin 是Wnt信号通路经典途径,现已证实其转录活性紊乱与包含肺腺癌在内的十多种常见恶性肿瘤有关[20-22]。Wnt-3a 作为经典Wnt 配体的代表及β-catenin 的上游基因,能够促进肺癌血管生成拟态形成与上皮-间质转化(epithelial-mesenchymal transition,EMT),因此与肺腺癌的转移相关[23]; 肺癌的发生也与β-catenin 多 功 能 蛋 白 的 异 常 活 化 相 关[24];c-Myc是Wnt 信号通路的主要下游靶基因,能调节细胞的增殖,促进G1期细胞进入S 期,激活细胞端粒酶并诱导其转录,增大肿瘤的发生概率[25]。本研究结果提示REG1A 可能通过Wnt/β-catenin 通路促进肺腺癌的进展。SHA 等[26]研究表明:在肝母细胞瘤中,Wnt/β-catenin 可与REG1A 和REG3A 协同作用,诱导肝母细胞瘤的发生。CAVARD 等[27]研究显示:REG1A 与肝脏和胰腺的再生及增殖相关,REG1A 在肝癌发生过程中是Wnt 信号通路的靶点。上述研究也证明了REG1A 在其他肿瘤中可以通过调控Wnt/β-catenin 影响肿瘤细胞的进展,与本研究结果相似。但本研究也存在一定的局限性,REG1A 调控Wnt/β-catenin 通路的具体机制尚未完全阐明,且未进行动物实验进一步加以验证。
综上所述,REG1A 可能通过调控 Wnt/β-catenin通路促进肺腺癌细胞增殖和迁移,进而影响肺腺癌的发生和发展。本研究丰富了对肺腺癌增殖和迁移的分子机制的研究,为肺腺癌的早期诊断及靶向治疗提供了一定的基础实验和生物信息学依据。

