基于CRISPR/Cas9 技术构建LDLR 基因敲除的免疫缺陷小鼠模型及其表型分析
王兆卫, 吕亚楠, 胡 正, 杨永广
(吉林大学第一医院 器官再造与移植教育部重点实验室,吉林 长春 130061)
高脂血症又称血脂谱异常症,一般特指甘油三酯和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)升高伴或不伴高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)降低的症状;临床上,通常根据引起高脂血症的原因将其分为原发性和继发性2 类[1]。原发性高脂血症是由于遗传基因缺陷所致,分为单基因高脂血症和散发性或多基因高脂血症;继发性高脂血症的原因主要包括高脂肪饮食与高热量饮食、肥胖、增龄、不良生活习惯和某些疾病等。高脂血症的病理生理过程复杂,高脂血症容易引起脂质在血管内皮的沉积,导致动脉粥样硬化(atherosclerosis,AS) 和心脑血管等病症的发生发展[2]。AS 是导致心血管疾病(cardiovascular disease,CVD) 的主要病理生理基础,现被认为是一种慢性炎症性疾病。实验和临床证据[3]表明:适应性免疫反应可加速或抑制AS,包括T 细胞和B 细胞在内的适应性免疫细胞可以通过分泌不同的细胞因子或抗体发挥促炎或抗炎作用。
近年来,研究[4-6]表明:AS 的诱导和进展主要与免疫机制有关,适应性免疫应答在AS 的发病机制中具有重要作用。然而,这些研究多数是在普通小鼠模型中进行的。CVD 研究人员采用近交系LDLR-KO C57BL/6J 小鼠作为金标准,然而这种小鼠有很强的T 细胞亚群偏向,不能完全适用于更为复杂的人免疫系统研究[7-8]。并且小鼠和人类免疫系统具有很大的差异,这导致从普通小鼠模型中获得的研究成果通常无法解释人类的生理或病理问题。免疫系统人源化小鼠模型为研究高胆固醇对人体免疫细胞功能的作用提供了一条新的途径。枯草溶菌素转化酶9 (proprotein convertase subtilisin/kexin type 9,PCSK9) 是一种肝源性分泌蛋白,其与低密度脂蛋白受体(low density lipoprotein receptor,LDLR)的胞外区结合,产生降解作用,进而升高血液中的胆固醇水平。研究[9]表明:通过对NSG 小鼠进行高脂喂养和前蛋白转化酶腺相关病毒8-枯草杆菌蛋白酶/kexin 9 型(adenoassociated virus 8-proprotein convertase subtilisin/kexin type 9,AAV8-PCSK9) 的感染,可以用于模拟高血脂条件下的人免疫功能异常。但该方法较为复杂,不易于推广应用。因此,本研究选择对NOD/SCID 小 鼠 进 行LDLR 基因敲除, 使其LDLR 表达量减少,使小鼠体内LDL-C 水平升高,采用人胎胸腺移植和胎肝CD34+造血干细胞重建,与人T 细胞和B 细胞重建良好[10-12],以此作为后期免疫系统人源化的基础。该方法与目前已报道的策略相比,简单且长效。
1 材料与方法
1.1 实验动物、主要试剂和仪器本实验室自主知识产权的NOD SCID LDLR+/-基因编辑小鼠正常膳食喂养,实验动物使用许可证号:SYXK(吉)2019-0012,按照《实验动物许可管理办法》 和《实验动物管理条例》的相关规定进行实验。PCR引物购自吉林省库美生物科技有限公司,200 bp DNA Ladder(货号:MD115-02)购自天根生化科技有限公司,GelStain(货号:GS101-03)购自北京全式金生物技术股份有限公司,10×Loading Buffer(货号:9157)、5×PrimeSTAR Buffer(货号:R050A) 和dNTP Mixture(货号:4030) 购自TaKaRa 宝生物工程(大连)有限公司,琼脂糖(货号:75510019) 购自Thermo 赛默飞世尔科技有限公司,血胆固醇水平测试试剂盒(货号:999-02601) 购自日 本FUJIFILM Cholesterol E kit 公司。酶标仪(型号:SPARK) 购自瑞士TECAN公司, 干式恒温器 (型 号: MK-20) 购 自ALLSHENG 杭州奥盛仪器有限公司,PCR 仪(型号:T100TMThermal Cycler)和凝胶成像系统(型号: ChemiDocTMXRS+)购自美国BioRad 公司。
1.2 小鼠模型的构建将外显子exon2-18 删除,采用百奥赛图公司基于CRISPR/Cas9 开发的EGE系统制备基因敲除小鼠。采用Cas9/sgRNA 注射受精卵的方法构建基因敲除小鼠时,由于胚胎早期卵裂速度很快,因此得到的F0 小鼠为嵌合体。将F0 代阳性小鼠与野生型小鼠交配,获得具有稳定基因型的F1 代小鼠。将得到F1 代阳性小鼠与野生型小鼠交配,获得稳定基因型来源的F2 代阳性小鼠,在F2 代阳性小鼠间进行合笼扩繁,使用F3 代小鼠进行实验。
1.3 鉴定小鼠基因型的PCR 引物设计Mut-F1/WT-R:扩增出突变型等位基因的PCR 产物。2 条引物分别设计在敲除序列的两侧。对于杂合子动物,使用该引物进行PCR 时会得到野生型等位基因的PCR 产物和突变型等位基因的PCR 产物;这2 条PCR 产物的长度差别很大,野生型等位基因的PCR 产物较长,而突变型等位基因的PCR 产物较短,行PCR 时仅能扩增出突变型等位基因上的PCR 产物,再进行电泳即可显示出条带,表示该小鼠有突变型等位基因,反之则没有该等位基因。WT-F/WT-R:扩增出野生型等位基因的PCR 产物,将产物进行电泳即可显示出条带,表示该小鼠有野生型等位基因,反之则没有该基因。结合Mut-F1 / WT-R 的PCR 扩增结果,将可以确定动物的具体基因型为纯合子/杂合子/野生型。以下将LDLR+/+记 为AA、将LDLR+/-记为Aa。PCR 引物序列:WT-F,5′-TGACCGGGTCCTGGGTACCAT-3′; Mut-F, 5′-TGTACCAGTATGTTAGGAGATCAGGTGG-3′; Mut-R/WT-R, 5′-TGCACCAGGGTCAGTGCAACC-3′ (吉林省库美生物科技有限公司)。见图1。
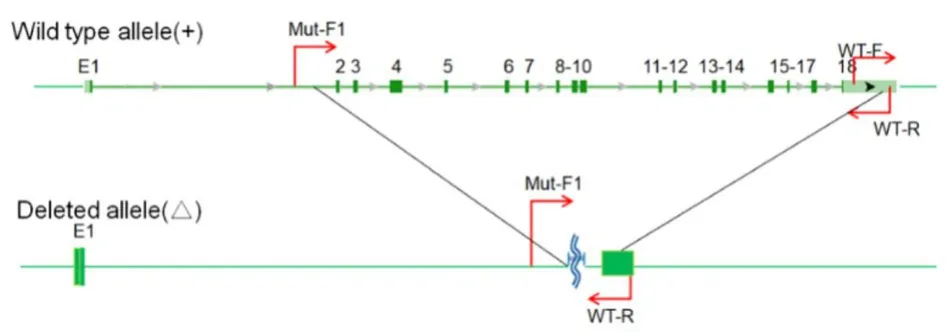
图1 用于鉴定小鼠基因型的引物设计Fig.1 Primer design for idenifying genotypes of mice
1.4 提取和扩增小鼠基因剪下约3 mm 的小鼠鼠 尾,加 入30 μL A 液(将0.0399 g NaOH 和0.0234 g EDTA 溶 入40 mL 纯 水 中),100 ℃加热30 min,冷却后加入等体积的B 液(0.2522 g Tris-HCl 溶入40 mL 纯水中) 获得小鼠基因提取物。野生型等位基因按下述体系和反应温度进行PCR 扩增。
野生型等位基因反应体系1: 2 μL 5×PrimeSTAR Buffer, 0.8 μ L dNTP Mixture,0.5 μL WT-F 引物,0.5 μL WT-R 引物,0.2 μL PrimeSTAR GXL DNA Polymerase, 3.5 μL ddH2O,2.5 μL 小鼠基因组提取物。野生型等位基因反应温度及步骤1:94 ℃、5 min;94 ℃、30 s,62 ℃、30 s,72 ℃、30 s,72 ℃、10 min,4 ℃、∞;30 个循环。
突变型等位基因按下述体系和反应温度进行PCR 扩增。突变型等位基因反应体系2:2 μL 5×PrimeSTAR Buffer; 0.8 μL dNTP Mixture;0.5 μL Mut-F 引物;0.5 μL WT-R 引物;0.2 μL PrimeSTAR GXL DNA Polymerase; 3.5 μL ddH2O;2.5 μL 小鼠基因组提取物。突变型等位基因反应温度及步骤2:94 ℃、2 min;98 ℃、10 s,62 ℃、30 s,68 ℃、40 s,68 ℃、10 min,4 ℃、∞,30 个循环。
1.5 核酸电泳鉴定小鼠基因型采用TAE 缓冲液、琼脂糖和荧光核酸染色试剂(GelStain)(×10000)配制成浓度为1.5%琼脂糖核酸凝胶。将得到的9 μL PCR 产物与1 μL 10×Loading Buffer混匀,加入凝胶的上样孔里。在120 V 条件下电泳30 min 后,使用凝胶成像系统进行观察。
1.6 小鼠外周血胆固醇测定空腹状态下,采得外周血。离心取上清,将每个样品、标准品和空白品(蒸馏水)吸取20 μ L,并预先标记管。添加2 mL 显色剂。混匀,37 ℃孵育5 min。测量样品(As)和标准品(Astd)在600 nm 处对空白的吸光度(A)值。对于样品,测量样品(As)和标准品(Astd)相对于空白的A 值,并计算Csample总胆固醇浓度(mg·dL-1)。Csample=AAs/AAstd×Csta。
1.7 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组小鼠体质量和外周血中胆固醇水平均服从正态分布,以±s表示,多组样本均数比较采用单因素方差分析,组间均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 F2小鼠基因型鉴定通过碱裂法提取小鼠鼠尾基因组后,进行PCR 扩增和核酸凝胶电泳,在凝胶成像系统下进行观察。野生型等位基因小鼠基因条带和突变型等位基因小鼠基因条带见图2 和3(图中标注为小鼠耳号)。鉴定每只小鼠的基因型并记录小鼠基因型的数量,经过繁育后得到的AA 数量是22 只,Aa 数量是32 只。在得到繁育小鼠中,挑选得到相同周龄的小鼠,并进行分组。总共分为4 组,每组各5 只,分别为雄性AA、雄性Aa、雌性AA 和雌性Aa。

图2 野生型等位基因电泳图Fig.2 Electrophoregram of wild type alleles

图3 突变型等位基因电泳图Fig.3 Electrophoregram of mutant type alleles
2.2 各组小鼠体质量在各组小鼠成年后,进行体质量监测。 隔2 周记录小鼠体质量,各组小鼠体质量逐渐升高,记录各组小鼠体质量以±s表示。与雄性小鼠比较,雌性小鼠体质量普遍较小(P<0.05)。相同性别的不同基因型小鼠之间的体质量比较差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠每周体质量Tab.1 Body weights of mice every week in various groups (n=5,±s,m/g)
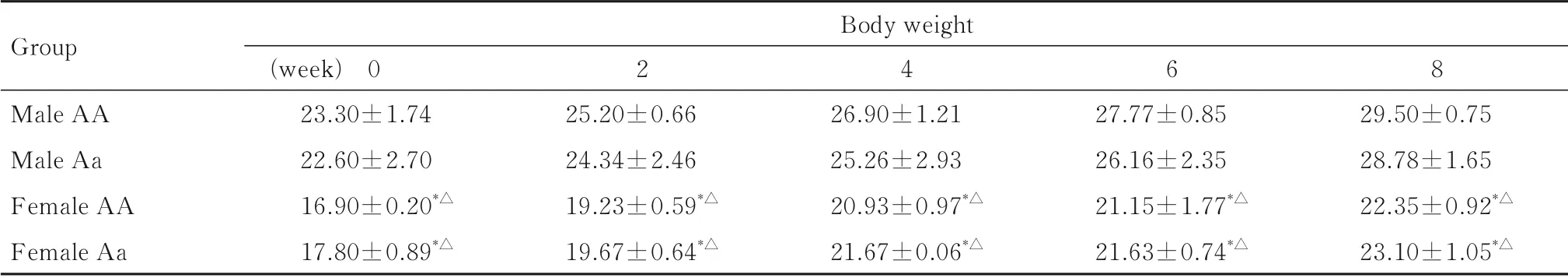
表1 各组小鼠每周体质量Tab.1 Body weights of mice every week in various groups (n=5,±s,m/g)
*P<0.05 compared with male AA group;△P<0.05 compared with male Aa group.
Group Male AA Male Aa Female AA Female Aa Body weight(week) 023.30±1.7422.60±2.7016.90±0.20*△17.80±0.89*△225.20±0.6624.34±2.4619.23±0.59*△19.67±0.64*△426.90±1.2125.26±2.9320.93±0.97*△21.67±0.06*△627.77±0.8526.16±2.3521.15±1.77*△21.63±0.74*△829.50±0.7528.78±1.6522.35±0.92*△23.10±1.05*△
2.3 各组小鼠外周血中胆固醇水平体质量监测结束后,取小鼠外周血,进行小鼠外周血中胆固醇水平检测。雄性AA 小鼠胆固醇水平为(75.43±10.06) mg·dL-1,雌性AA 小鼠胆固醇水平为(60.78±2.11) mg·dL-1,雄性Aa 小鼠胆固醇水平为(120.56±11.16)mg·dL-1,雌性Aa 小鼠的胆固醇水平为(100.80±4.42) mg·dL-1。与AA基因型比较,Aa 基因型小鼠血中胆固醇水平明显升高(P<0.05)。
3 讨论
全世界每年死于心脑血管疾病的人数高达1500 万人,居各种死因首位,全球对心血管类药物的需求持续增长。LDL-C 升高,而由其引起的血脂异常被认为是AS 等CVD 发生的主要原因。LDLR 是机体通过内吞机制清除血液中LDL-C 的关键受体,在维持体内胆固醇代谢平衡方面具有核心地位[4]。
脂质与适应性免疫细胞之间的相互作用及与这些细胞类型相关的共刺激和共抑制途径一直是心血管疾病研究的重点。高胆固醇血症可刺激适应性免疫系统,促进AS 等炎症性疾病的发生。胆固醇在T 细胞的活化和增殖中起重要作用[13]。最新研究[14]表明:高胆固醇血症可调节肝脏中分化的T细胞亚群, 并通过增加转化生长因子β1(transforming growth factor-β1,TGF-β1) 介 导 肝内Treg 和Th17 分化,诱导肝脏耐受,导致肝脏呈特异性免疫抑制状态。但当严重的高胆固醇血症引起肝脏炎症时,则会抑制肝脏耐受性诱导,阻碍肝内Treg 分化,而促进AS 的Th1 分化。
调节胆固醇代谢可以影响CD4+T 细胞和CD8+T 细胞的增殖和效应功能[15-16]。T 细胞是AS病变中主要白细胞类型之一[17]。在斑块病变中,分布最为丰富的适应性免疫细胞为CD4+T 细胞,也可观察到少量CD8+T 细胞。在疾病进程中,CD4+T 细胞可以分化成不同类型的辅助性T 细胞亚型,而这些具有免疫抑制或免疫激活作用的辅助性T 细胞亚型可以发挥直接抗炎或促炎作用。同时CD4+T 细胞功能表型可因内环境的改变而发生改变,随之其作为调节细胞和炎性细胞发挥功能的相对能力也会发生变化[17]。
AS 形成时会发生动脉周围及全身的B 细胞反应,心血管疾病的风险也取决于B 细胞的增殖和活化状态。B 细胞产生的抗体可抑制细胞对氧化低密度 脂 蛋 白 (oxidized low density lipoprotein,OxLDL)颗粒的摄取,也可以通过与多种免疫细胞表面表达的Fc 受体相互作用来发挥功能[18]。研究[19]表明:B 细胞除了具有产生抗体的功能外,也充当主要抗原提呈细胞(antigen presenting cell,APC)激活幼稚CD4+T 细胞并促进其分化。
但近年来的研究[20]显示:高胆固醇血症在活化小鼠与人类T 细胞亚群的分化过程中存在明显差异。在对LDLR-/-小鼠研究[21]中,当严重高胆固醇血症引起肝脏炎症时,肝脏中Treg 的分化被阻断,进而促进AS 的Th1 的分化被促进。临床高脂血症患者表现为Th2 的比例增加。因此,采用传统小鼠模型研究人体免疫系统与高胆固醇血症之间的关系不合适。为了解决将非人类动物模型中的研究发现转化为临床应用的局限性,研究人员设计并开发了人源化小鼠模型,以求在细胞和分子水平上模拟人类[22-23]。近年来研发的具有人类免疫系统的人源化小鼠模型已广泛应用于理解疾病的发病机制和评估药物对于人类疾病的治疗,研究的疾病主要包括癌症、传染病、自身免疫疾病及移植物抗宿主病等。目前应用最广的具有人类免疫系统的人源化小鼠模型是Hu-BLT 小鼠模型,该模型是将免疫缺陷小鼠经亚致死剂量辐照处理后,将人胎肝和胸腺组织移植到小鼠肾脏被膜下,同时静脉注射同一个体的造血干细胞[10]。因此,构建可以发生高脂血症的免疫缺陷小鼠模型是研究人体免疫系统与高胆固醇血症间的关系的基础。
LDLR 是分布于细胞表面网格蛋白包膜窦区的一种内吞受体,其能结合并内化LDL 和载脂蛋白b-100 及载脂蛋白E,是维持哺乳动物脂质代谢稳态的关键受体[12]。LDLR 广泛分布于多种组织和细胞,尤其是肝脏。肝脏是应对膳食胆固醇摄入的核心器官,其有助于脂蛋白颗粒的释放和清除。增加LDLR 的表达可降低血浆胆固醇水平。综上,在NOD/SCID 小鼠的基础上进行基因编辑,通过合笼杂交获得LDLR+/-的杂合子与野生型小鼠。本研究结果显示:在经过普通饲料喂养8 周后,小鼠体质量均增加,不同性别小鼠的体质量有区别,与雌性小鼠比较,雄性小鼠体质量较大。空腹测得外周血中胆固醇水平有明显变化,其中与野生型小鼠比较,雄性小鼠和雌性小鼠中基因突变型杂合子的血中胆固醇水平较高,且差异有统计学意义。在繁育饲养过程中,研究发现未出现LDLR-/-的纯合子的NOD/SCID 小鼠,出现这种情况的的原因暂不明确,也未见有关报道,对此现象还有待研究发现。本研究结果显示:通过对LDLR 基因编辑,实现了免疫缺陷小鼠自发性血脂水平的升高,并有望通过高脂喂养进一步提高血脂水平,为研究高血脂环境下人免疫系统的反应与机制提供了新方法。

