阿托伐他汀对Ox-LDL/β2GPⅠ/anti-β2GPⅠ诱导的血管内皮功能紊乱的改善作用及其机制
刘依侬, 张 强, 徐 立
(吉林大学第二医院检验科,吉林 长春 130041)
心血管系统疾病是目前全球范围内人类死亡的主 要 原 因 之 一[1], 而动脉粥样硬化(atherosclerosis,AS)是心血管疾病发生的首要因素,其特征是内皮功能紊乱、活性氧(reactive oxygen species,ROS)产生增加、内膜脂质沉积、平滑肌细胞增殖、细胞凋亡和坏死,以及局部和全身炎症[2-3]。血管内皮功能紊乱是AS 发生的首发事件,其破坏血管收缩和舒张之间的平衡,增加内皮通透性,并引发局部炎症反应[4]。抗磷脂综合征(antiphospholipid syndrome,APS) 是一种自身免疫性疾病,其特点是血栓形成和妊娠失败。但APS 背景下的AS 研究少见报道。AS 病变细胞内累积的氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL),是引发内皮功能紊乱的关键因素,其累积程度是反映AS 病变程度的重要指标[5-7],但Ox-LDL/β2 糖蛋白Ⅰ(β2-glycoprotein Ⅰ,β2GPⅠ)/抗β2GPⅠ抗体(anti-β2GPⅠ)复合物在内皮细胞功能损伤以及AS 疾病进展中的作用尚不清楚。核因子κB (nuclear factor kappa-B,NFκB)是调控AS 疾病的关键炎性因子[8],TRAF3-相互作用蛋白2 (TRAF3 interacting protein 2,TRAF3IP2)作为细胞质接头分子,是Ikappa B 激酶 (I kappa B kinase, IKK)/NF- κB 的 激 活剂[9-10]。但TRAF3IP2 在AS 中 的 具 体 作 用 机 制 尚不明确。阿托伐他汀(atorvastatin,ATO)作为临床常规降血脂药物,其是否通过TRAF3IP2 发挥抗AS 的作用尚不清楚。本研究通过给予人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs) Ox-LDL 复合物建立内皮细胞损伤模型,探讨其是否激活TRAF3IP2/IKK/NF-κB 信号通路,进而探讨ATO是否特异靶向抑制TRAF3IP2,保护内皮细胞功能,延缓AS 的发生发展,为APS背景下抑制AS 发生发展奠定理论基础。
1 材料与方法
1.1 细胞、主要试剂和仪器HUVECs 购自中科院上海细胞库,人Ox-LDL 购于广州奕源生物科技有限公司,β2GPⅠ、ATO、MTT 溶液和DMSO购自美国Sigma 公司,anti-β2GPⅠ购自美国Santa Cruz 公 司, H-DMEM 培 养 基、 PBS 缓 冲 液、0.25% 胰蛋白酶和胎牛血清购自美国Hyclone 公司,1%青-链霉素双抗购自美国Invitrogen 公司,鼠 抗 人GAPDH、TRAF3IP2 和p-IKKγ 一 抗 购 自美国Santa Cruz 公司,兔抗人p-NF-κB p65 一抗和羊抗鼠(兔)二抗购自美国CST 公司,ROS 检测试剂盒购于上海碧云天生物技术有限公司,人内皮素1(endothelin 1,ET-1)ELISA 试剂盒购于上海酶联生物科技有限公司。高速低温离心机(型号:Micro 17) 和CO2细胞培养箱(型号:371) 购于美国Thermo Fisher 公司,荧光显微镜(型号AF6000)购于德国Leica 公司,全自动化学发光图像分析系统(型号Tanon5200) 购于上海天能公司。
1.2 细胞培养HUVECs 在含有10%胎牛血清和1% 青-链霉素的H-DMEM 培养基中培养,置于37 ℃、5% CO2培养箱孵育。待细胞长至培养皿80%~90%时开始传代,用胰蛋白酶消化细胞,终止消化后得单细胞悬液后按照1∶2 或1∶3 进行传代,均采用3~8 代处于对数生长期的细胞用于实验。将HUVECs 分成8 组:对照组、β2GP Ⅰ组(100 mg·L―1)、 Ox-LDL 组(50 mg·L―1)、β 2GPⅠ/anti-β2GPⅠ组(100 mg·L―1)、Ox-LDL/β2GP Ⅰ组、 Ox-LDL/β2GP Ⅰ/anti-β2GP Ⅰ组、ATO (10 μmol·L―1) +Ox-LDL/β2GP Ⅰ组 和ATO+ Ox-LDL/β2GPⅠ/anti-β2GPⅠ组。
1.3 MTT 法检测各组细胞存活率96 孔细胞培养板中每孔加入100 μL 细胞悬液,调整待测细胞密度至每孔1×105个,每组设6 个复孔,于37 ℃、5% CO2培养24 h,至细胞完全贴壁。分别加入不同刺激物,37 ℃、5% CO2培养。每孔加入20 μL MTT 溶液(5 g·L―1),37 ℃孵育4 h。去除孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶标仪490 nm处检测各孔的吸光度(A)值,计算细胞存活率。细胞存活率=(处理组A 值―调零孔A 值)/(对照组A 值―调零孔A 值)×100%。
1.4 Western blotting 法检测各组蛋白表达水平采用Western blotting 法检测各组蛋白表达水平,将细胞接种于6 孔细胞培养板中,细胞培养终止后,弃去培养液,预冷生理盐水洗涤细胞3 遍,加入RIPA 裂 解 液, 冰 上 裂 解5 min, 4 ℃、12000 r·min―1、离 心15 min,去 沉 淀 留 取 上 清,进行BCA 蛋白定量。采用SDS-PAGE 电泳,转膜, 5% 脱脂牛奶室温封闭1 h, 加入一抗GAPDH、 TRAF3IP2、 p-IKKγ 和p-NF- κB p65(1∶1000),4 ℃孵育过夜,加入辣根过氧化物酶标记羊抗鼠(兔)二抗(1∶2000),摇床室温孵育 2 h, 增 强 化 学 发 光 法 (enhanced chemiluminescence,ECL)显色。以GADPH 为内参蛋白,采用Image J 软件分析蛋白灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.5 化学荧光探针法检测各组细胞内ROS 荧光强度按照说明书用无血 清H-DMEM 培 养 基1∶1000 稀释探针得到终浓度为10 μmol·L―1ROS 荧光探针(DCFH-DA)工作液。将细胞接种于6 孔细胞培养板中,培养终止后,弃去培养液,生理盐水洗涤细胞3 遍。每孔中加入DCFH-DA 探针工作浓度,37 ℃孵育20 min。用无血清H-DMEM 培养基洗涤细胞3 次,以完全去除未进入细胞内的DCFH-DA 探针。使用激发波长488 nm,发射波长525 nm 进行荧光定量检测,采用倒置荧光显微镜观察并拍照保存。应用Image J 软件进行荧光强度分析,计算ROS 荧光强度。ROS 荧光强度=呈现荧光的面积/总面积。
1.6 ELISA 法检测各组细胞上清液中ET-1 水平将HUVECs 接种于6 孔细胞培养板中,培养终止后,收集培养基,1000 g 离心20 min,取上清。按照ELISA 试剂盒说明书进行检测。
1.7 统计学分析采用Graph Pad Prism 8.0 统计软件进行统计学分析。各组HUVECs 存活率,TRAF3IP2、IKK 和NF-κB 蛋 白 表 达 水 平,ROS荧光强度,细胞上清中ET-1 水平均符合正态分布,以-±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组HUVECs 存活率与对照组比较,Ox-LDL 组、 β2GPⅠ/anti-β2GPⅠ组、 Ox-LDL/β2GP Ⅰ 组 、 Ox-LDL/β2GP Ⅰ/anti-β2GP Ⅰ组HUEVCs 12 h 存活率明显降低(P<0.05);与Ox-LDL/ β 2GP Ⅰ组 和 Ox-LDL/ β 2GP Ⅰ/antiβ 2GPⅠ组比较,ATO 预处理1 h 后,ATO+Ox-LDL/β2GPⅠ 组 和 ATO+Ox-LDL/ β 2GPⅠ/anti- β2GPⅠ组HUVECs 存活率升高(P<0.05)。见图1。

图1 MTT 法检测各组HUVECs 存活率Fig.1 Survival rates of HUVECs in various groups detected by MTT assay
2.2 各组HUVECs 中ROS 荧光强度和细胞上清中ET-1 水平与对照组比较,Ox-LDL 组、Ox-LDL/β2GP Ⅰ组 和Ox-LDL/β2GP Ⅰ/anti-β2GP Ⅰ组ROS 荧光强度及细胞上清中ET-1 水平明显升高(P<0.05)。与Ox-LDL/β 2GPⅠ组 和Ox-LDL/β 2GPⅠ/anti-β2GPⅠ组比较,ATO 处理后ATO+Ox-LDL/β2GP Ⅰ组 和ATO+Ox-LDL/β2GP Ⅰ/anti-β2GPⅠ组HUVECs 中ROS 荧光强度和细胞上清中ET-1表达水平明显降低(P<0.05)。见图2和3。

图2 各组HUVECs 中ROS 荧光强度Fig.2 Fluorescence intensities of ROS in HUVECs in various groups
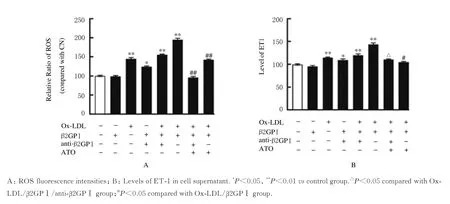
图3 各组HUVECs 中ROS 荧光强度(A)和细胞上清中ET-1 水平(B)Fig.3 Fluorescence intensities of ROS in HUVECs and ET-1 levels in cell supernatant in various groups
2.3 各组HUVECs 中TRAF3IP2、IKK 和NF-κB蛋白表达水平与对照组比较,Ox-LDL 组、Ox-LDL/β2GPⅠ组和Ox-LDL/β2GPⅠ/anti-β2GPⅠ组HUVECs 中 TRAF3IP2、 p-IKK γ 和 p-NF- κ B p65 蛋白的表达水平升高(P<0.05)。与Ox-LDL/β2GP Ⅰ组 和Ox-LDL/β2GP Ⅰ/anti-β2GP Ⅰ组 比较,ATO 预处理后,ATO+Ox-LDL/β2GPⅠ组和 ATO+Ox-LDL/β2GP Ⅰ/anti-β2GP Ⅰ 组HUVECs 中TRAF3IP2、p-IKKγ 和p-NF-κB p65蛋白表达水平降低(P<0.05)。见图4。

图4 Western blotting 法检测各组HUVECs 中TRAF3IP2、p-IKK 和p-NF-κB p65 蛋白表达电泳图(A)和直条图(B-D)Fig. 4 Electrophoretogram (A) and histogram (B-D) of TRAF3IP2,p-IKK,and p-NF-κB p65 proteins in HUVECs in various groups detected by Western blotting method
3 讨论
氧化应激、内皮细胞活化和内皮细胞功能障碍在很大程度上被认为是大血管疾病发病机制的主要改变。在APS 背景下的AS 患者早期口服ATO 可早期改善血管内皮功能紊乱,延缓AS 的发生和发展,旨在防止AS 的早期进展,并减少患者后期的不良事件。
生理条件下ROS 作为信号分子,在维持血管稳态、预防心血管炎症和损伤中发挥重要作用[11-12]。然而在病理应激过程中,血管壁产生异常水平的ROS,扰乱了氧化还原稳态,进而影响血管细胞的功能。氧化应激驱动转录因子,从而诱导炎症因子、可溶性介质和趋化因子的表达。而且炎症细胞分泌的细胞因子和趋化因子导致ROS 水平升高,从而形成不良循环加剧炎症的发生[13]。本课 题 组 前 期 研 究[6]表 明:Ox-LDL 是 反 映AS 病 变程度的重要指标,可引发内皮功能紊乱。氧化应激是AS 发病机制中的重要组成部分,与促炎信号通路的激活和细胞因子/趋化因子的表达并行发生[2]。血脂异常等动脉粥样硬化性心血管疾病(cardiovascular disease,CVD)危险因素均伴随机体ROS 水 平 的 升 高[3]。APS 患 者 体 内 主 要 的 靶 抗原β2GPⅠ通过V 结构域与Ox-LDL 结合构成循环免疫复合物加速AS 的进程[14-15]。Ox-LDL/β2GPⅠ在体内可与anti-β2GPⅠ抗体进一步结合形成复合物,本 研 究 首 次 证 实Ox-LDL/ β 2GPⅠ/antiβ2GP Ⅰ复合物对内皮细胞功能损伤最显著,为APS 的AS 进展提供理论依据。
研究[16]表明:ATO 对内皮祖细胞动员有积极作用,但在血管内皮功能紊乱方面的机制尚不清楚。内皮细胞、平滑肌细胞和巨噬细胞等是参与AS 斑块形成的主要细胞类型, 均可表达TRAF3IP2[17-18]。Ox-LDL 可 诱 导TRAF3IP2 的 表达和内皮功能障碍[17]。研究[17,19]表明:血管紧张素Ⅱ(angiotesin Ⅱ,Ang Ⅱ)、醛固酮、白细胞介素18 (interleukin-18,IL-18) 和高级氧化蛋白产物(advanced oxidative protein products,AOPPs)在体外可上调TRAF3IP2 的表达。TRAF3IP2 是NF-κB 的上游激活因子,TRAF3IP2 通过泛素化结合TRAF6 并激活IKK,从而使NF-κB 磷酸化、降解以及核转位[20-21]。本研究结果表明:在Ox-LDL/β2GPⅠ及Ox-LDL/β2GPⅠ/anti-β2GPⅠ复合物刺激下,HUVECs 中TRAF3IP2、p-IKKγ 和p-NF-κB p65 蛋白表达水平明显上调,TRAF3IP2/IKK/NF-κB 信号通路在Ox-LDL 复合物所致AS 中起重要作用。ATO 预处理后,可逆转由Ox-LDL/β2GPⅠ/anti-β2GPⅠ复 合 物 诱 导 的TRAF3IP2、p-IKKγ 和p-NF-κB p65 蛋 白 表 达 水 平 升 高。本 研究表明Ox-LDL/β2GPⅠ/anti-β2GPⅠ复合物可通过调节TRAF3IP2/IKK/NF-κB 信号通路引起血管内皮功能紊乱,临床常规降血脂药物ATO 可通过抑制此通路改善血管内皮功能。
综上所述,Ox-LDL复合物中Ox-LDL/β2GPⅠ/anti-β2GPⅠ复合物对于血管内皮功能紊乱作用最强。降血脂药物ATO 可下调TRAF3IP2/IKK/NFκB 信号通路改善内皮功能的紊乱,为探讨APS 下抑制AS 的发生发展奠定了理论基础。

